基于缺血半暗帶為基礎探究急性腦梗死溶栓治療預后不良發生的危險因素及預測模型構建
張春海,閆 坤,周建昌,王樹純,劉子波
(河北北方學院附屬第二醫院,河北 張家口 075100)
在我國,腦卒中是導致成年人殘疾和認知障礙的主要原因,約占全球死亡人數的5.2%[1]。腦梗死是最常見的缺血性腦卒中,約占全部腦卒中總人數的70%[2],也是導致我國成年人致殘率第一和致死率第二的危重疾病[3]。急性期是腦梗死疾病進展的重要環節,也是治療該疾病的重要節點。腦梗死急性期的核心治療措施使梗阻血管再通,以挽救梗死核心周圍區域,這部分區域因缺血性損傷而發生功能異常,但神經細胞尚未死亡[4],該區域被稱為缺血半暗帶(Ischemic penumbra,IP)。IP最重要的特點是,其具有和梗死核心區相同的供應血管,這部分區域存在不穩定性,如果能夠及時恢復血液供應,則可以轉變為正常組織,如不能及時恢復血流,該區域也將轉變為不可逆的梗死區。基于以上原因,急性腦梗死(Acute cerebral infarction,ACI)治療的關鍵在于早期及時地恢復IP區域的血流供應,以避免更多的腦細胞死亡[5]。溶栓治療是ACI最有效的治療方法之一[6],而IP的存在是溶栓是否實施的有力依據,但在急性期內,即使無法證實IP的存在也應進行溶栓等積極有效的治療。臨床工作中,ACI溶栓治療的效果不盡相同,受一些高危因素的影響,部分患者存在預后不良的情況。在此基礎上,本研究旨在探討基于IP為基礎的ACI患者溶栓治療預后不良發生的危險因素及預測模型構建,以期望對臨床起到指導作用。
1 對象與方法
1.1 研究對象 收集河北北方學院附屬第二醫院于2018年1月至2023年1月在神經內科治療的402例ACI患者的臨床資料。病例納入標準:①患者年齡≥18歲;②主要診斷為ACI;③所有患者均應用阿替普酶(國藥準字SJ20160055)進行溶栓治療。排除標準:①溶栓治療后發生腦出血等并發癥者;②既往患有顱內病變者;③患有神經系統相關疾病影響病情評估者;④患有癲癇或精神疾病者;⑤臨床資料不完整者。經篩查共有402例患者納入本項研究,根據術后預后情況,分為預后不良組(n=43)和預后良好組(n=359)。
1.2 研究方法
1.2.1 患者臨床資料的收集:①一般資料:性別,年齡,體重指數(BMI),吸煙史、飲酒史,伴發疾病如高血壓、糖尿病、腎功能不全、貧血等;②血液指標:血脂、血小板計數及血同型半胱氨酸;③腦梗死診斷情況:有無IP,美國國立衛生研究院卒中量表(NIHSS)評分,腦梗死程度等;④治療情況:溶栓開始時間,溶栓持續時間及溶栓藥物劑量。
1.2.2 預后評估:患者的預后情況采用改良Rankin量表(MRS)進行評估[7],MRS根據腦卒中患者神經功能恢復情況評分,范圍為0~6分。本項研究中,設定當MRS評分≤2分時為預后良好,而當MRS評分>2分時為預后不良。
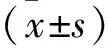
2 結 果
2.1 兩組臨床資料比較 單因素分析結果顯示,糖尿病、無IP、高血壓、年齡>60歲、發病至溶栓時間>4.5 h、大面積腦梗死、溶栓持續時間、溶栓藥物劑量及NIHSS評分是ACI患者溶栓后預后不良發生的相關因素(均P<0.05),見表1。
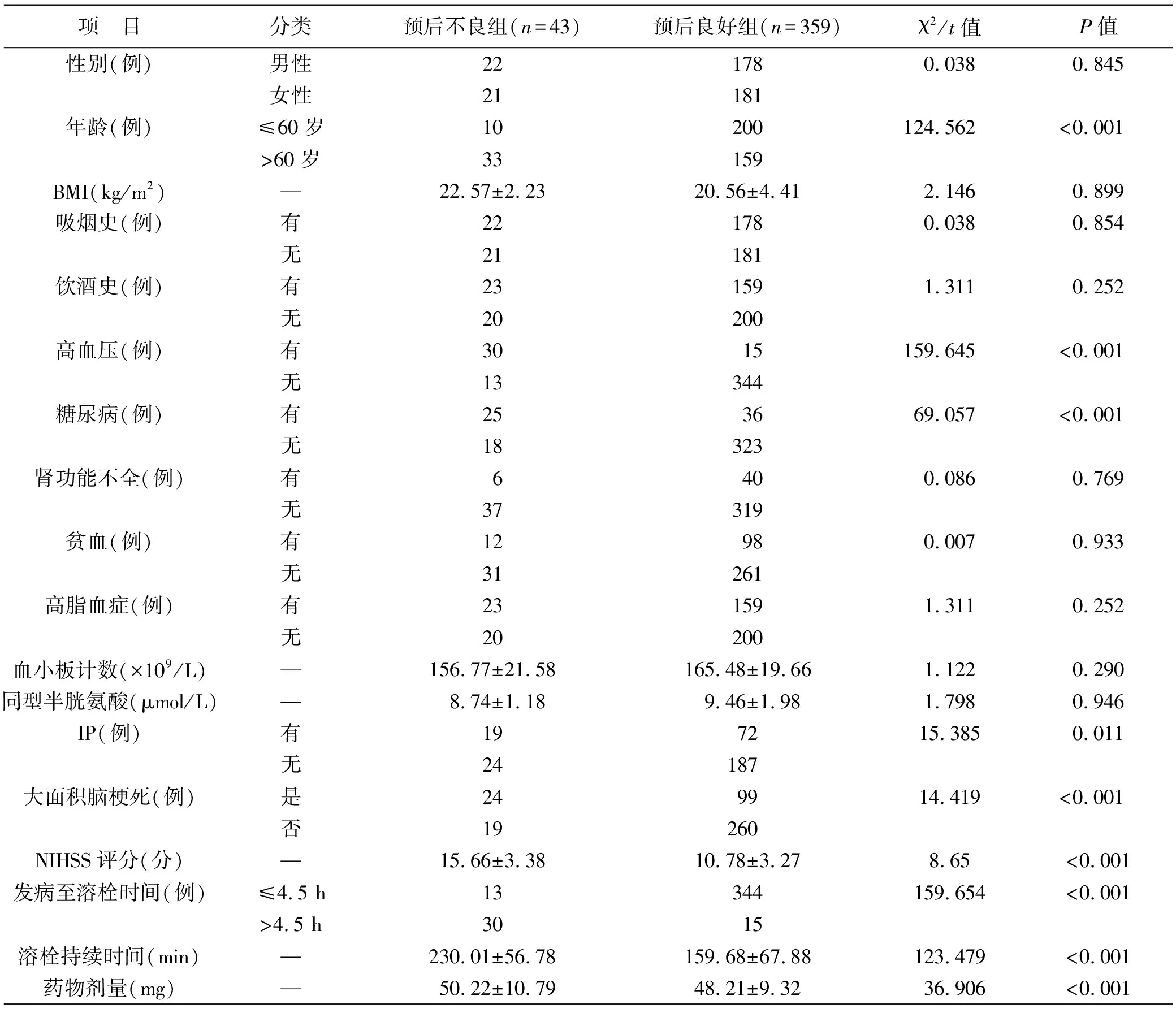
表1 兩組臨床資料比較
2.2 Logistic回歸分析 結果顯示NIHSS評分、溶栓持續時間、高血壓、發病至溶栓時間>4.5 h、大面積腦梗死以及無IP是ACI患者溶栓后不良預后發生的獨立危險因素(均P<0.05),見表2。
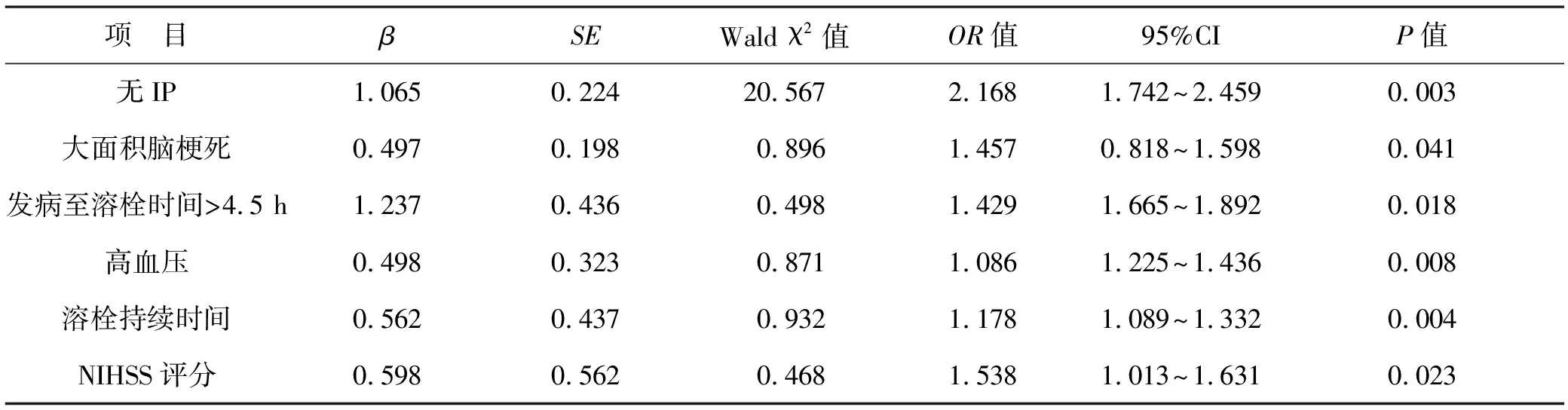
表2 多因素Logistic回歸分析
2.3 列線圖的建立及評估 基于IP、高血壓、發病至溶栓時間>4.5 h、大面積腦梗死、溶栓持續時間及NIHSS評分是溶栓治療后的ACI患者預后不良發生的獨立危險因素,構建了預測急性腦梗死溶栓后預后不良發生的風險列線圖,C指數為0.769。校準曲線顯示實際發生情況與列線圖擬合良好,進一步驗證了預測模型的準確性和可靠性。預測模型的AUC為0.769,說明預測模型在診斷方面表現良好,能夠有效地區分患者的預后情況。而根據決策曲線結果,當閾值概率設定在0%~73.1%之間時,對患者進行及早干預可以帶來一定的益處。這意味著在這個閾值范圍內,通過預測模型得出的預測概率可以作為決策干預的依據,有助于提高患者的治療效果。見圖1~4。

圖1 ACI患者溶栓預后不良發生風險預測模型

圖2 預測模型校準曲線
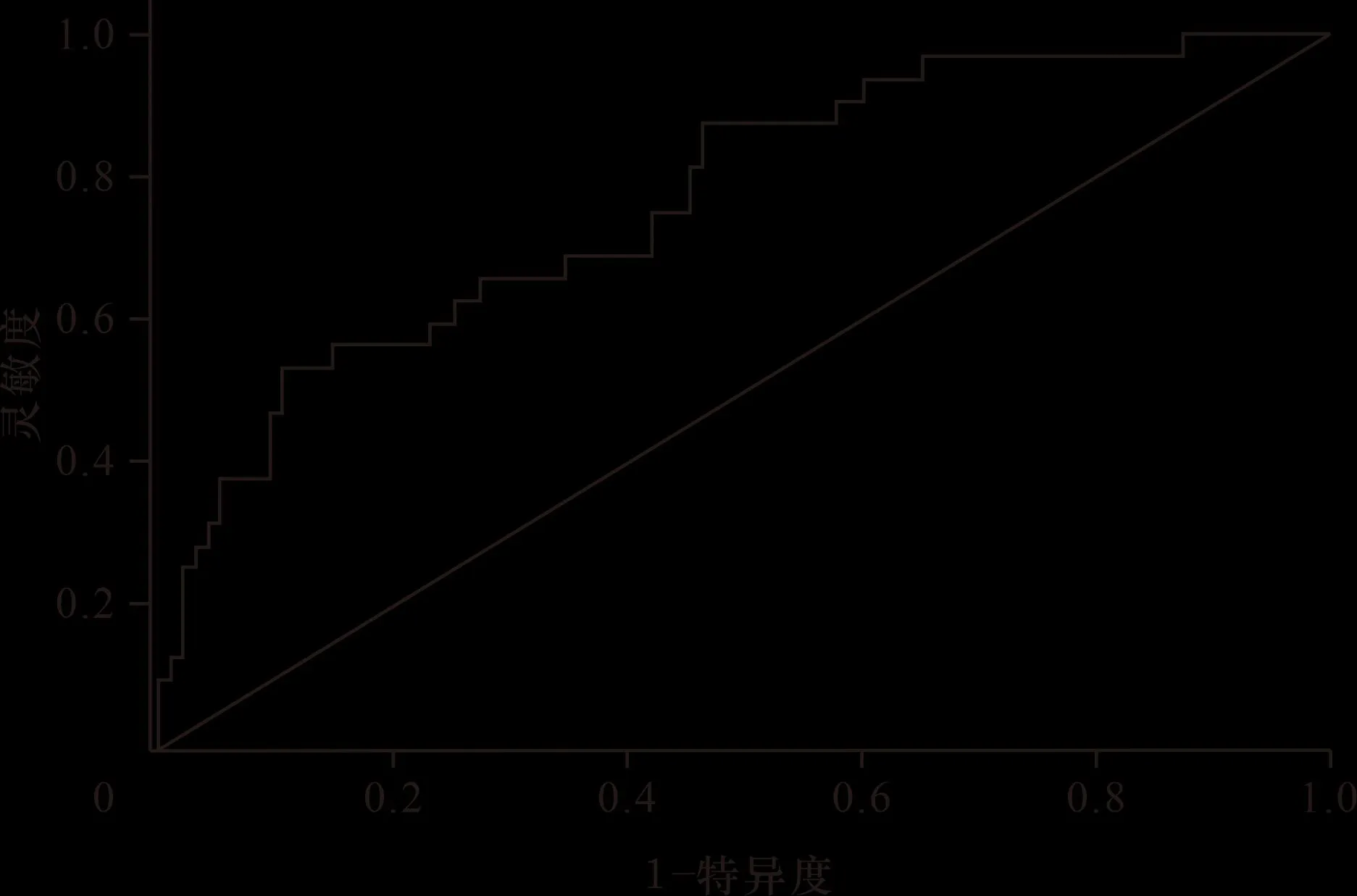
圖3 預測模型ROC曲線
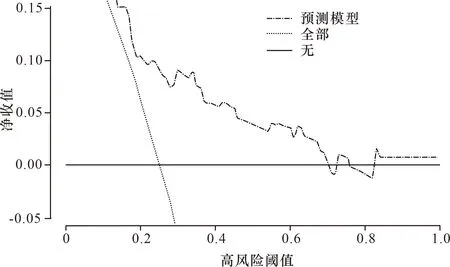
圖4 預測模型臨床決策曲線
3 討 論
ACI可以導致腦卒中患者致殘及認知障礙等情況[8-10],給社會及家庭帶來了巨大的經濟負擔。ACI溶栓的預后受到許多因素影響,其中包括患者一般情況、梗死特點及治療情況等。大量研究[11-13]表明,IP是否存在對于ACI治療方案的選定及判定其預后有重要意義,所以判斷IP是否存在至關重要。目前,憑借臨床癥狀或體征變化尚無法判斷IP是否存在,而依靠影像學“不匹配”的評價方法進行評估在臨床被廣泛應用。核磁共振彌散加權成像(DWI)可通過表現彌散系數(ADC)進行量化,其反映了腦組織內水分子的擴散速度[14-16]。在MRI模式中,DWI可以準確顯示腦梗死的范圍和程度,其顯示的彌散受限區域為梗死核心。磁共振灌注加權成像(PWI)可反映血流動力學狀態,可提供腦血容量(CBV)、腦血流量(CBF)、達峰時間(TTP)和平均通過時間(MTT)四個腦灌注參數圖,可用于急性缺血性梗死病情的判斷[17-18]。目前,臨床上運用MRI技術評估IP最經典的方法即是PWI/DWI不匹配模式[19-20]。本研究所有患者溶栓前均進行PWI/DWI檢查,結果表明無IP是ACI溶栓治療后預后不良的危險因素,因此入院后應積極完善相關檢查,評價是否存在IP,以評估患者溶栓后的預后。臨床經驗表明,有無IP并不是判定是否進行溶栓或溶栓預后情況的絕對因素,其他因素也對溶栓結局有著或多或少的影響,需要我們進行系統分析。
本研究還表明,高血壓是溶栓治療后預后不良發生的危險因素。高血壓患者存在顱內大、小血管病變,不但可能影響溶栓的效果,同時容易發生腦出血等并發癥而導致預后不良[21]。大面積腦梗死的原因是大腦中動脈主干、頸動脈主干或皮質支完全性梗死,導致該動脈供血區的腦組織壞死、軟化,進而導致神經功能缺失,而大面積腦梗死NIHSS評分往往較高,NIHSS評分較高時常常提示梗死嚴重。本組資料結果還顯示,大面積腦梗死及溶栓前NIHSS評分是預后不良的危險因素,這可以解釋為,大面積腦梗死及NIHSS評分較高證明患者病情較重,增加了預后不良的可能性[22]。溶栓持續時間受到醫生操作技術的影響,同時也與患者血栓負荷有關。本項研究結果還表明,溶栓時間較長是預后不良的危險因素,分析其原因為,溶栓時間較長證明血栓負荷較重,側面證實了病程時間長、病情較重。長時間的血栓形成也可能說明患者在發病后到接受溶栓治療之間的時間較長,這可能是由于患者就醫延遲或治療方案選擇上的考慮。這種情況下,腦組織會經歷較長時間的缺血缺氧,導致中央壞死區域更加嚴重。更大的壞死區域會導致生成更多的氧自由基,加劇再灌注損傷的嚴重程度。因此,患者在溶栓治療后的臨床預后可能會更加不樂觀[23]。本研究結果也表明,發病至溶栓時間>4.5 h是預后不良的危險因素,這與歐洲卒中組織急性缺血性腦卒中靜脈溶栓指南中觀點一致[24]。
本項研究中,與Logistic回歸分析相比較,列線圖有諸多優點,其中最主要優點的是不需要將連續變量轉變為分類變量,同時可以基于總得分合并多個概率尺度,而將多個感興趣的時間點包含在一個列線圖中。另外可以通過列線圖中的線條長度來判斷預測變量的相對重要性,從而幫助醫師更好的識別預后不良的高危患者,從而可以進行更好的臨床管理[25]。同時需要說明的是,在單因素分析中,年齡、糖尿病、藥物劑量也是ACI溶栓治療后預后不良的相關因素,但Logistic回歸分析結果提示,以上因素不是預后不良發生的高危因素。但我們在臨床工作中,也應繼續重視具有以上因素的患者,提高溶栓的成功率。
綜上所述,NIHSS評分、溶栓持續時間、高血壓、發病至溶栓時間>4.5 h、大面積腦梗死以及無IP是ACI患者溶栓后預后不良發生的獨立危險因素。臨床工作中,應予以高度重視并進行及早干預,而本研究中所構建的預測模型對ACI溶栓治療后預后不良的發生有較高的預測價值。臨床工作者通過預測模型,提前預知ACI溶栓的預后情況,制訂應對方案,從而提高溶栓的成功率。

