自然殺傷細胞2組成員A、程序性死亡因子配體1表達檢測對PD-L1阻斷免疫治療肌層浸潤性膀胱癌反應性的預測價值
趙剛剛,張鴻毅,肖克兵,楊 輝,李子峰,趙華才
(西安醫學院第一附屬醫院泌尿外科,陜西 西安 710077)
膀胱癌是一種發病率和病死率極高的惡性腫瘤,其在全球范圍內對人類的生命健康均有較大威脅[1]。腫瘤浸潤是造成患者病死的最主要原因,而患者出現腫瘤浸潤主要是免疫逃逸造成的[2-3]。近年來,關于膀胱癌的治療已取得較大進展,程序性死亡因子配體1(Programmed death factor ligand 1,PD-L1)阻斷免疫治療在膀胱癌中的應用取得了較為理想的效果,其能夠通過抑制腫瘤細胞結合PD-1,減少腫瘤細胞的免疫逃逸,進而促進細胞毒性T淋巴細胞的死亡[4-5]。自然殺傷細胞2組成員A(Natural killer cell group 2 member A,NKG2A)是抑制NK細胞的抑制性受體,其對于自然殺傷細胞殺傷靶細胞具有抑制作用[6]。PD-L1是一種存在于多種癌癥中的T細胞調節因子,有研究顯示腫瘤內CD8+T細胞浸潤數量越多,其表達水平越低,提示其表達與腫瘤浸潤存在負相關[7]。但是目前關于NKG2A和PD-L1表達是否能預測膀胱癌治療反應性的研究不足,因此本研究對接受PD-L1阻斷免疫治療的肌層浸潤性膀胱癌患者NKG2A和PD-L1表達對其治療反應性的預測價值進行觀察,現報告如下。
1 對象與方法
1.1 研究對象 回顧性選取2019年1月至2022年11月收治的100例肌層浸潤性膀胱癌患者為研究對象,病例納入標準:經病理檢查診斷為膀胱尿路上皮癌;分期為pT2N0M0[8];于我院接受PD-L1阻斷免疫治療;未合并其他惡性腫瘤。排除標準:病理檢查確診為非肌層浸潤性膀胱癌;發生遠處轉移;合并自身免疫性疾病;嚴重器官功能異常;臨床資料不完整。本研究經醫院醫學倫理委員會同意。
1.2 研究方法 ①治療前NKG2A和PD-L1表達水平檢測:采集患者空腹靜脈血5 ml置于樣本管中,對其采用熒光標記法進行染色。取5 ml在樣本管內加入100 μl EDTA 抗凝全血,將單克隆抗體CD3(PE-Cy7標記)、CD4(Per CP標記)、CD8(FITC標記)、NKG2A(PE標記)以及PD-L1(PE標記)分別加入樣本管內,在室溫避光25 min 后加入3 ml溶血素,繼續于室溫避光孵育12 min,保證樣本管內溶血充分。以3000 r/min的速度進行離心10 min,棄去上清液,采用磷酸緩沖液進行洗滌2次,最后加入200 μl含有1% 多聚甲醛的磷酸緩沖液進行懸浮。采用Wmini5146流式細胞儀(長沙市微米生物科技有限公司)進行檢測,結果以陽性率(%)表示。②治療方法:一線治療中順鉑耐受患者采用吉西他濱聯合順鉑方案,吉西他濱分別于第1、8天行靜脈滴注1000 mg/m2,順鉑于第2天開始分2~3 d靜脈滴注,總劑量為70 mg/m2。二線治療中,采用吉西他濱聯合卡鉑或紫杉醇(150 mg/m2)聯合卡鉑方案。PD-1抑制劑應用國產藥物(信迪利單抗200 mg、特瑞普利單抗240 mg、替雷利珠單抗200 mg),1次/3周,治療4周期,治療期間對患者行血常規監測(1次/3 d),肝腎功能及激素水平監測(1次/周)。每2周期結束后行療效評估。③緩解與未緩解評價標準:在治療計劃結束1個月后,參照實體瘤療效評價標準[7]進行評價,完全緩解:腫瘤消失且時間超過1個月;部分緩解:腫瘤縮小超過50%且持續超過1個月;穩定:腫瘤在縮小50%與增大25%之間,且時間持續超過1個月;進展:腫瘤增大超過25%或有新病灶出現。緩解組為完全緩解+部分緩解+穩定患者,未緩解組為進展患者。對緩解組患者隨訪3個月,出現復發和轉移的患者納入復發組,未出現復發和轉移的患者納入未復發組。
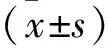
2 結 果
2.1 緩解組與未緩解組患者一般資料比較 100例研究對象中,緩解組患者72例(72.00%),未緩解組患者28例(28.00%)。兩組患者性別、年齡比較無統計學差異(均P>0.05),但緩解組患者腫瘤直徑小于未緩解組,NKG2A、PD-L1/CD4+和PD-L1/CD8+表達水平均低于未緩解組,兩組比較差異有統計學意義(均P<0.05)。見表1。
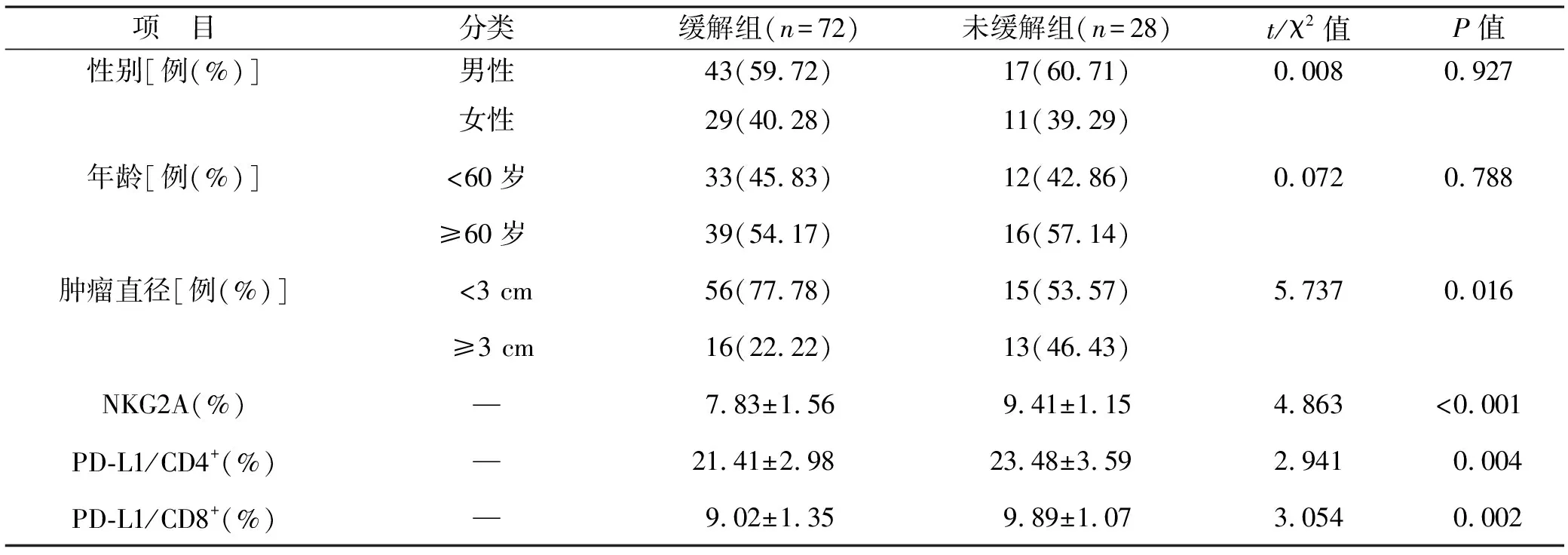
表1 緩解組與未緩解組患者一般資料比較
2.2 NKG2A和PD-L1預測膀胱癌患者免疫治療后緩解的ROC曲線 經ROC曲線分析可知,膀胱癌患者NKG2A、PD-L1/CD4+和PD-L1/CD8+表達預測免疫治療后緩解的AUC值分別為0.771、0.724、0.710;聯合診斷的AUC為0.836。見表2(圖1)。

圖1 NKG2A和PD-L1預測膀胱癌患者免疫治療后緩解的ROC曲線

表2 NKG2A和PD-L1預測膀胱癌患者免疫治療后緩解的ROC曲線分析
2.3 復發組與未復發組患者一般資料比較 72例緩解患者中,復發組29例(40.28%),未復發組43例(59.72%)。兩組患者性別、年齡以及腫瘤直徑之間比較無統計學差異(均P>0.05),但復發組NKG2A、PD-L1/CD4+和PD-L1/CD8+表達水平均高于未復發組(均P<0.05)。見表3。
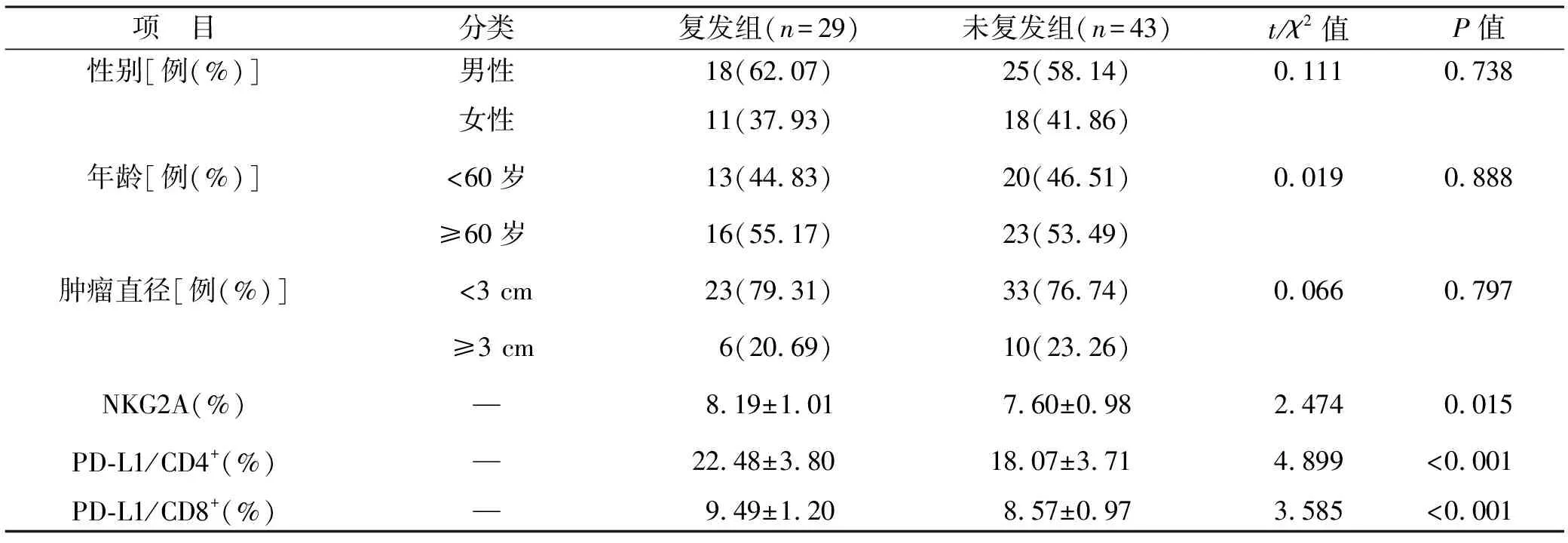
表3 復發組與未復發組患者一般資料比較
2.4 NKG2A和PD-L1預測膀胱癌患者緩解后復發的ROC曲線 經ROC曲線分析可得,NKG2A、PD-L1/CD4+和PD-L1/CD8+表達預測膀胱癌患者緩解后復發的AUC值分別為0.775、0.740、0.728;聯合診斷的AUC為0.874。見表4(圖2)。

圖2 NKG2A和PD-L1預測膀胱癌患者緩解后復發的ROC曲線
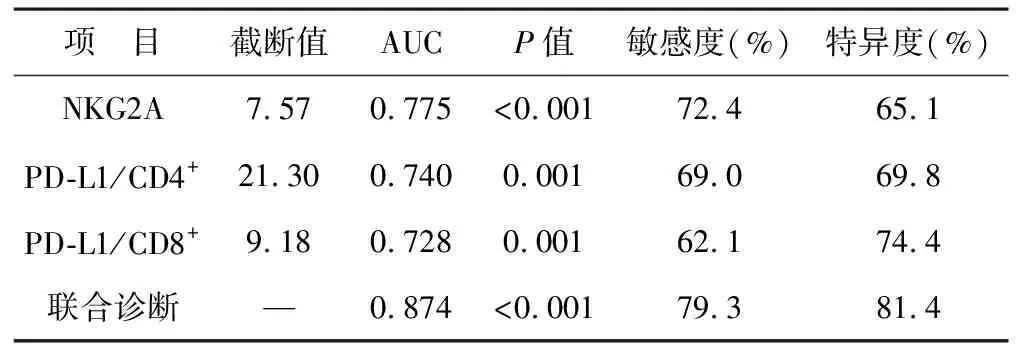
表4 NKG2A和PD-L1預測膀胱癌患者緩解后復發的ROC曲線分析
3 討 論
膀胱癌是一種泌尿系統惡性疾病,其在泌尿系統惡性腫瘤中,發病率與致死率均處于首位[9-10]。對于肌層浸潤性膀胱癌,主要治療手段是根治性切除手術,但是從臨床經驗來看,約半數浸潤性膀胱癌患者在行根治術后仍會出現術后復發轉移[11]。因此結合非手術手段進行膀胱癌治療是提升治療效果的重要舉措。化療是其中一種輔助治療方式,但由于不同個體對于化療藥物的耐受程度和敏感程度不同,導致其治療效果存在很大差異,尤其是對于高齡患者,其應用局限極大[12]。免疫治療是一種新興的惡性腫瘤治療手段,其具有不良反應小、適應證范圍廣以及對高齡患者友好等優勢,對于肌層浸潤性膀胱癌有著重要價值[13]。
細胞免疫是免疫阻斷治療的主導部分。在浸潤淋巴細胞中,NK細胞、CD8+T細胞等是最主要的效應細胞,其能夠將腫瘤細胞殺滅,降低癌細胞轉移風險[14-15]。腫瘤細胞通過釋放出抑制性細胞因子,參與細胞免疫應答過程,使其完成免疫逃逸[16]。腫瘤細胞表面PD-L1陽性表達,會使活化T細胞結合PD-1,無法形成有效的第二信號,使腫瘤免疫應答反應無法建立,導致T細胞失能,進一步導致腫瘤細胞逃避宿主攻擊,迅速增殖轉移[17-18]。PD-L1阻斷免疫治療能夠改變腫瘤微環境,使上述免疫逃逸機制被打破,進而恢復T細胞對于癌細胞的免疫效應。有研究發現,膀胱癌患者PD-L1阻斷免疫治療反應性和腫瘤細胞PD-L1蛋白的表達水平之間有相關性,能夠通過腫瘤細胞PD-L1蛋白的表達水平對其治療效果進行有效預測[19-20]。在本研究中,通過比較不同治療效果的患者的PD-L1蛋白水平發現,治療后緩解患者治療前外周血中PD-L1在CD4+T細胞和CD8+T細胞上的表達明顯低于未緩解患者,通過ROC曲線發現,其對于患者接受PD-L1阻斷免疫治療后是否緩解有較高的預測價值,敏感性和特異性均較高,這與過往研究結果大體一致[21]。將治療后緩解患者根據隨訪結果進行分組發現,相較于未復發組患者,復發組患者PD-L1在CD4+T細胞和CD8+T細胞上的表達水平更高。提示PD-L1表達水平對于患者術后是否發生復發轉移也有較高的預測價值,其表達水平越高,發生復發轉移的可能性越高。
NKG2A是一種NK細胞抑制性受體,其在健康人群外周血中的表達較低,而在存在慢性抗原刺激時,其表達會明顯上調[22-23]。該受體能夠參與形成異二聚體,結合相應的分子復合物進行抑制信號傳導,使NK細胞的活性受到明顯抑制[24]。新研究發現,將CD8+T細胞表面NKG2A受體進行阻斷,能夠提升腫瘤的治療效果,提示NKG2A受體在CD8+T細胞表面的表達水平對于惡性腫瘤治療反應性有一定的影響[25]。在本研究中,NKG2A在緩解組患者外周血中表達水平低于未緩解組患者,復發組患者外周血中表達水平高于未復發組,提示NKG2A表達水平對于肌層浸潤性膀胱癌患者PD-L1阻斷免疫治療反應性有重要價值。通過ROC曲線分析發現,NKG2A表達水平對于治療反應性的預測價值高于PD-L1/CD4+和PD-L1/CD8+的預測效能,其對于治療效果的預測敏感性和特異性分別為64.3%和83.3%,其對于緩解后出現復發的預測敏感性和特異性分別為72.4%和65.1%。聯合三者預測發現,NKG2A、PD-L1/CD4+和PD-L1/CD8+對于肌層浸潤性膀胱癌患者治療反應性的預測效能高于單項指標的預測效能。
綜上所述,NKG2A、PD-L1/CD4+和PD-L1/CD8+在不同治療反應性肌層浸潤性膀胱癌患者外周血中表達水平不同,三者對于膀胱癌患者PD-L1阻斷免疫治療反應性均有一定的預測價值,且三者聯合預測效能最佳。

