超重對急性輕型缺血性腦卒中或中高危短暫性腦缺血發作患者預后的影響探討
穆靜麗, 徐青云, 王瑞莉, 楊嬪妮, 程 銘, 王 丹,張 晉, 王奕楠, 趙性泉, 常立國, 王艾麗
(1. 山東省聊城市第三人民醫院, 山東 聊城, 252000;2. 蘇州大學蘇州醫學院 公共衛生學院流行病與衛生統計學系, 江蘇 蘇州, 215123;3. 江蘇省蘇州工業園區疾病防治中心, 江蘇 蘇州, 751599)
腦卒中為全球范圍內的重大公共衛生問題之一[1-2], 是成人殘疾和死亡的主要原因[3], 其中缺血性腦血管疾病占60%~80%, 包括缺血性腦卒中和短暫性腦缺血發作(TIA)[4]。既往研究[5-6]報道,高體質量指數(BMI)與心血管疾病和腦卒中發病及預后風險增加顯著相關。然而研究[7-9]指出,與一般人群相比,腦卒中患者存在“肥胖悖論”,即高BMI對腦卒中預后存在“保護作用”。因此, BMI與腦卒中預后的關系仍無定論,有必要開展隊列研究探討兩者關系。本研究探討基線BMI與急性輕型缺血性腦卒中或中高危TIA患者發病后3個月內臨床結局的關系,現報告如下。
1 對象與方法
1.1 研究對象
本研究基于一項隨機對照臨床試驗(該試驗旨在比較2種雙重抗血小板策略對輕度卒中或中高危TIA的治療效果,其中實驗組應用替格瑞洛和阿司匹林治療,對照組應用氯吡格雷和阿司匹林治療),于2019年9月—2021年3月納入366例急性輕型缺血性腦卒中或中高危TIA患者作為研究對象,均隨訪3個月。納入標準: ① 年齡≥40歲者; ② 符合急性非致殘性缺血性卒中定義[入組時美國國立衛生研究院卒中量表(NIHSS)評分≤3分(評分范圍0~42分,評分越高表示卒中越嚴重)]或具有中高危卒中風險的TIA定義[ABCD2評分(基于年齡、血壓、臨床特征、TIA持續時間以及有無糖尿病的卒中風險評分)≥4分(評分范圍0~7分,評分越高表示卒中風險越高)]者; ③ 攜帶CYP2C19功能缺失型(LOF)等位基因者; ④ 癥狀出現24 h內可應用研究藥物者; ⑤ 已簽署知情同意書者。排除標準: ① 非腦梗死或TIA患者; ② 難以依據方案服藥者; ③ 難以判斷事件是否致殘者; ④ 可能出現出血風險增加者; ⑤ 可能出現藥物不良反應者; ⑥ 涉及倫理問題及其他風險者。
1.2 資料收集
患者入院 24 h內由經過專業培訓的神經內科醫生使用統一規范的調查問卷收集基線資料,包括人口學資料、既往疾病史(高血壓、糖尿病、血脂異常、高血糖、缺血腦性卒中、TIA、腦梗死和冠心病)、發病前1個月內用藥情況(抗血小板藥、降脂藥、降壓藥和降糖藥)和腦卒中分型等。按照TOAST分型標準,缺血性腦卒中患者可分為大動脈粥樣硬化型腦卒中(LAA)、心源性栓塞型腦卒中(CE)、小動脈閉塞型腦卒中(SAO)、其他病因型腦卒中(ODE)和原因不明型腦卒中[包括檢查完全而原因不明型腦卒中(UEN)、檢查不完全而原因不明型腦卒中(UEI)][10]。通過NIHSS評估缺血性卒中的嚴重程度[11], 通過TIA早期卒中風險預測工具(ABCD2評分)評估TIA的短期卒中風險[12]。患者入院后第1次常規實驗室檢查指標(血糖、血脂等指標)由檢驗科醫生使用全自動生化分析儀進行測定。患者入院血壓由接受專業培訓并通過考核的護士根據美國心臟協會推薦方案[13]使用自動血壓計進行測量,共測量3次,每次間隔30 s, 取3次測量值的平均值作為入院血壓值。
1.3 隨訪與研究結局
患者出院后(90±7) d, 由經過培訓并考核合格的研究人員對有效性及安全性終點事件進行面對面訪視,收集期間卒中復發、死亡及其他血管事件等資料。本研究主要結局為3個月內復發任何腦卒中事件(缺血性腦卒中或出血性腦卒中),次要結局包括3個月內卒中復發或死亡的復合結局和血管性事件(任何卒中/TIA/心肌梗死/血管性死亡)以及3個月生活質量[歐洲生活質量-5維量表(EQ-5D)評分][14]。EQ-5D共包括5個維度,分別為行動能力、自己照顧自己、日常活動、疼痛與不舒服、焦慮,每個維度5分,總分25分; 將5個維度各為1分者定義為生活質量好,否則為生活質量較差。
1.4 統計學分析
比較基線特征時,正態分布的計量資料采用均數±標準差描述,組間比較采用方差分析; 非正態分布的計量資料采用中位數(四分位間距)表示,組間比較采用Wilcoxon檢驗; 計數資料采用[n(%)]描述,組間比較采用卡方檢驗。各臨床結局發生情況采用累計發生率(%)描述,采用Kaplan-Meier法繪制各組患者的累計結局發生率曲線,通過Log-rank檢驗分析組間差異性。采用多因素COX比例風險模型評估超重與3個月卒中復發、3個月卒中復發或死亡復合結局、3個月血管事件的關系,計算風險比(HR)和 95%置信區間(CI)。由于生活質量的非事件性特征,采用多因素 Logistic回歸模型分析BMI與3個月EQ-5D評分的關系,計算比值比(OR)和95%CI。以上分析均對已知的重要混雜因素進行調整,包括性別、年齡、吸煙、飲酒、發病至隨機化時間、基線NIHSS評分、發病前改良Rankin量表(mRS)評分、腦卒中分型、高血壓、糖尿病、血脂異常、發病前1個月降糖藥用藥史、腦卒中史、抗血小板干預(干預與對照)。基于凈重分類改善指數(NRI)和綜合判別改善指數(IDI)計算結果,評估在傳統模型基礎上增加BMI的新模型對急性缺血性腦卒中或TIA預后的預測價值。所有統計學分析應用SAS 9.4軟件進行,雙側P<0.05表明差異有統計學意義。
2 結 果
2.1 研究對象的基線特征
本研究共納入366例急性輕型缺血性腦卒中或中高危TIA患者,根據入院BMI情況將其分為未超重組(BMI<25 kg/m2)208例和超重組(BMI≥25 kg/m2)158例。相較于未超重組,超重組體質量更大,年齡、基線ABCD2評分、高密度脂蛋白水平更低,基線甘油三酯、總膽固醇、空腹血糖、糖化血紅蛋白水平更高,差異有統計學意義(P<0.05); 2組其他基線特征比較,差異無統計學意義(P>0.05), 見表1。
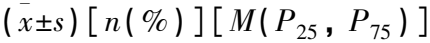
表1 未超重組與超重組患者基線特征比較
2.2 BMI與不良結局的關系
隨訪3個月, 28例患者卒中復發, 1例患者死亡, 31例患者發生血管事件,無失訪病例。采用Kaplan-Meier法分別繪制未超重組與超重組患者的卒中復發、卒中復發或死亡、血管事件累計發生率曲線,結果顯示,超重組患者發病后3個月卒中復發、卒中復發或死亡、血管事件累計發生率均低于未超重組,差異有統計學意義(Log-rankP=0.042、0.030、0.015), 見圖1。
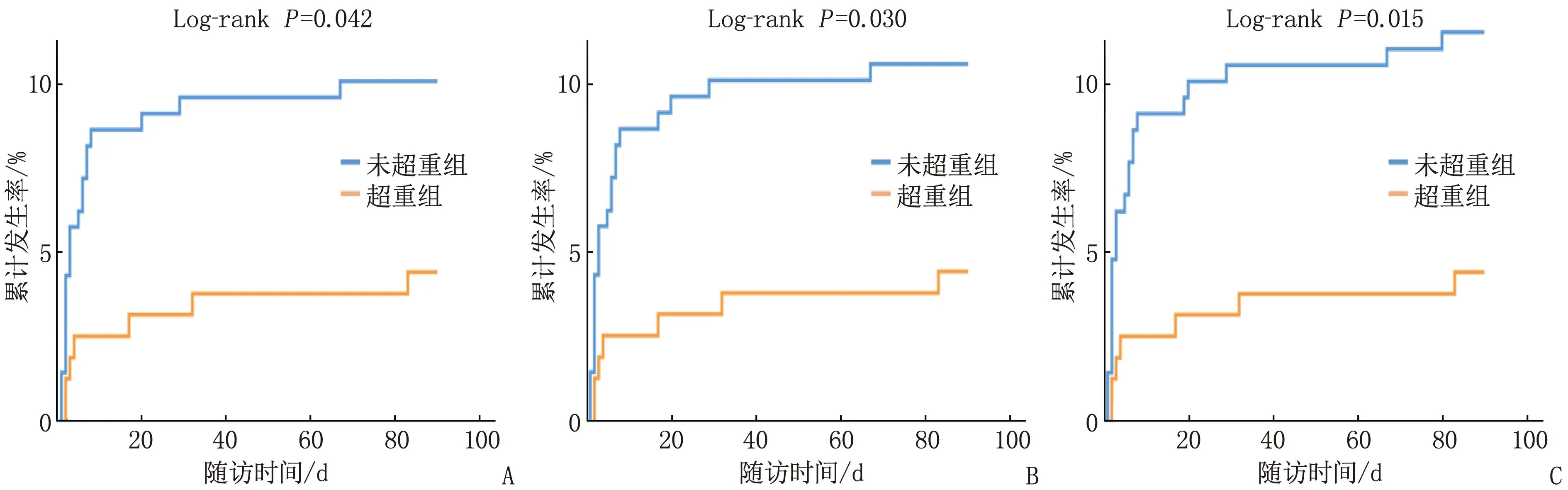
A: 卒中復發; B: 卒中復發或死亡; C: 血管事件。
調整后的多因素COX回歸分析(調整因素: 年齡、性別、吸煙、飲酒、發病至隨機化時間、基線NIHSS評分、發病前mRS評分、腦卒中分型、高血壓、糖尿病、血脂異常、發病前1個月降糖藥用藥史、腦卒中史、抗血小板干預)結果顯示,與未超重組比較,超重組患者3個月卒中復發風險顯著降低(HR=0.24, 95%CI: 0.08~0.71), 卒中復發或死亡復合結局(HR=0.24, 95%CI: 0.08~0.69)和血管事件(HR=0.22, 95%CI: 0.07~0.63)風險也顯著降低; 多因素有序Logistic回歸分析結果顯示,超重組患者3個月生活質量(EQ-5D評分)顯著優于未超重組(OR=0.39, 95%CI: 0.20~0.76), 見表2。

表2 BMI(是否超重)與3個月卒中復發、卒中復發或死亡、血管事件關系的多因素分析結果[n(%)]
進一步調整住院期間是否服用降脂藥、是否服用降壓藥、是否服用降糖藥之后發現,高BMI(超重)仍然對急性輕型缺血性腦卒中或中高危TIA患者的預后發揮保護作用(P<0.05), 見表3。

表3 BMI(是否超重)與急性輕型缺血性腦卒中或中高危TIA預后的關系(敏感性分析)
IDI和NRI計算結果顯示,與包含傳統危險因素的傳統模型比較,增加BMI(是否超重)后的新模型對急性輕型缺血性腦卒中或中高危TIA患者3個月卒中復發(IDI=2%, 95%CI: 0.49%~4.01%,P=0.012;NRI=48%, 95%CI: 13.52%~82.23%,P=0.024)、卒中復發或死亡(IDI=2%, 95%CI: 0.34%~3.82%,P=0.019;NRI=42%, 95%CI: 7.19%~77.79%,P=0.041)、血管事件(IDI=2%, 95%CI: 0.53%~4.06%,P=0.011;NRI=45%, 95%CI: 11.02%~79.57%,P=0.027)和生活質量(IDI=2%, 95%CI: 0.68%~4.08%,P=0.006;NRI=36%, 95%CI: 11.00%~61.41%,P=0.010)的預測能力均得到顯著提高,見表4。

表4 BMI(是否超重)對急性輕型缺血性腦卒中或中高危TIA患者3個月不良結局的預測價值
3 討 論
本研究是一項基于大型臨床隨機對照試驗的前瞻性研究,探討了超重對攜帶CYP2C19LOF等位基因的急性輕型缺血性腦卒中或中高危TIA患者預后的影響。本研究發現,相較于未超重患者,超重患者3個月卒中復發、卒中復發或死亡復合結局、血管事件的發生風險均顯著降低,且發病后3個月生活質量更高。在傳統危險因素模型基礎上增加BMI(是否超重),可以提高模型對急性輕型缺血性腦卒中或中高危TIA患者3個月不良結局的預測能力,提示高BMI對急性輕型缺血性腦卒中或中高危TIA預后具有“保護性”效應。
既往研究中,超重或肥胖被認為是心血管疾病的重要危險因素。一項關于女性健康的隊列研究[15]發現,與BMI<25 kg/m2的女性相比, BMI≥30 kg/m2的女性發生腦卒中的HR為1.50,發生缺血性腦卒中的HR為1.72。瑞典的一項前瞻性研究[16]也發現,與低BMI(20.00~22.49 kg/m2)的研究對象相比, BMI>30.00 kg/m2的中年男性發生腦卒中的風險增加93%,發生缺血性腦卒中的風險增加78%。另一項納入5 163名研究對象的隨機對照研究[17]則發現,超重與輕度缺血性腦卒中或TIA患者復發性腦卒中風險增加有關。然而,近年來越來越多的研究者提出了“肥胖悖論”。一項納入782例腦卒中患者和2 346名對照者的研究[18]發現,相較于正常體質量者,超重和輕度肥胖者在缺血性卒中后具有更高的10年生存率。回顧性隊列研究[19]表明,相較于體質量正常,超重和肥胖對缺血性腦卒中患者發病后1年的生存情況具有保護作用。DOEHNER W等[8]基于4 428例急性腦卒中或TIA患者開展前瞻性研究,發現超重和肥胖患者的功能性、非致死性結局和復發性卒中、死亡的風險顯著低于體質量正常患者。另一項納入30 702例患者的英國隊列研究[20]提出,較高的BMI可顯著降低腦卒中后不良血管事件和死亡的風險。目前,缺血性腦卒中的推薦治療方案是采用氯吡格雷進行抗血小板治療,但氯吡格雷治療CYP2C19LOF等位基因攜帶者發生不良結局的概率高于非攜帶者[21-22]。盡管以上研究均為大樣本研究,但不可避免存在人群CYP2C19LOF等位基因分層偏倚,本研究的研究對象均為CYP2C19LOF等位基因攜帶者,可很好地避免由基因攜帶情況不同對超重與急性輕型缺血性腦卒中或中高危TIA預后的關聯造成的可能影響[23]。
超重對缺血性腦卒中或TIA具有保護效應的可能機制包括: ①缺血性腦卒中或TIA患者可能由于生理性應激使得分解代謝狀態的超負荷增加,而超重和肥胖患者由于代謝儲備較高,能夠更好地承受營養損傷[24-25]; ②脂肪細胞可以合成腫瘤壞死因子-α(TNF-α)和多種白細胞介素(IL),特別是 IL-1β和IL-6[26-27],因此超重或肥胖患者長期處于低度炎癥狀態,可能對急性缺血性腦卒中表現出一定耐受性,并在一定程度上抵消炎癥反應和促炎癥信號的有害作用[28-29]。本研究認為,超重患者在發生缺血性腦卒中或TIA后的減輕體質量療法有待斟酌,應根據個體情況和代謝水平進行體質量管理。
本研究基于設計嚴謹的臨床隨機對照試驗,根據標準化的研究方案收集患者全面的基線信息和隨訪結局資料并進行嚴格的質量控制,有助于在盡可能充分調整混雜因素影響的情況下系統評估BMI與急性輕型缺血性腦卒中或中高危TIA預后的關系。然而本研究亦存在一定局限性: ① 研究對象嚴格符合納入標準與排除標準,存在一定的選擇偏倚; ② 無法排除低體質量者可能因代謝性疾病、慢性疾病、營養不良等增加不良預后風險,故不能完全證明入院BMI與預后的因果關系[30]; ③ 雖然本研究調整了主要混雜因素,但不能完全排除其他潛在的混雜因素[31]; ④ 既往研究[32-33]提出BMI與腦卒中預后的劑量-反應關系可能為“U型”或“J型”曲線,但由于本研究樣本量有限,難以描繪出BMI與腦卒中預后的劑量-反應關系圖。
綜上所述,超重可能是攜帶CYP2C19LOF等位基因的急性輕型缺血性腦卒中或中高危TIA患者預后的保護因素。與未超重患者相比,超重患者3個月卒中復發、卒中復發或死亡復合結局、血管事件的發生風險均降低,且發病后3個月的生活質量提高。

