CT影像組學結合臨床特征預測活動性耐藥肺結核的模型構建與驗證
潘犇 梁長華 韓東明 崔俊偉 姚陽陽 魏正琦 甄思雨 危涵羽 楊鑫淼
耐藥結核病是許多國家的一個主要公共衛生問題[1]。耐藥結核病指患者感染的結核分枝桿菌經體外藥物敏感性試驗(簡稱“藥敏試驗”)證實對利福平或異煙肼等任意一種或多種抗結核藥物耐藥[2]。對耐藥結核病的不正確診斷可能導致治療效果降低、不良反應增加,以及患者依從性降低[3]。耐藥肺結核的準確診斷需要進行分枝桿菌培養和藥敏試驗[4],而痰菌陰性肺結核患者很難診斷,并且可能有漏診的風險[5]。因此,早期、無創地識別耐藥肺結核患者能夠有效阻止結核病的人際傳播,增加治療成功的概率。
影像組學是一種從標準醫學影像中高通量挖掘定量圖像特征的方法,可以在臨床決策支持系統中提取和應用數據,以提高診斷、預后和預測準確性,在癌癥研究中日益重要[6]。本研究旨在通過構建影像組學模型預測肺結核患者耐藥性,進一步幫助臨床醫生早期識別耐藥肺結核患者。
資料和方法
一、研究對象
1.患者選擇:采用回顧性研究方法,參照入組標準納入2020年1月1日至2022年12月31日河南省新鄉醫學院第一附屬醫院收治的88例耐藥肺結核(耐藥組)和146例藥物敏感肺結核(藥物敏感組)患者。影像組學工作流程如圖1所示。將所有患者按7∶3的比例隨機分為訓練集和測試集。
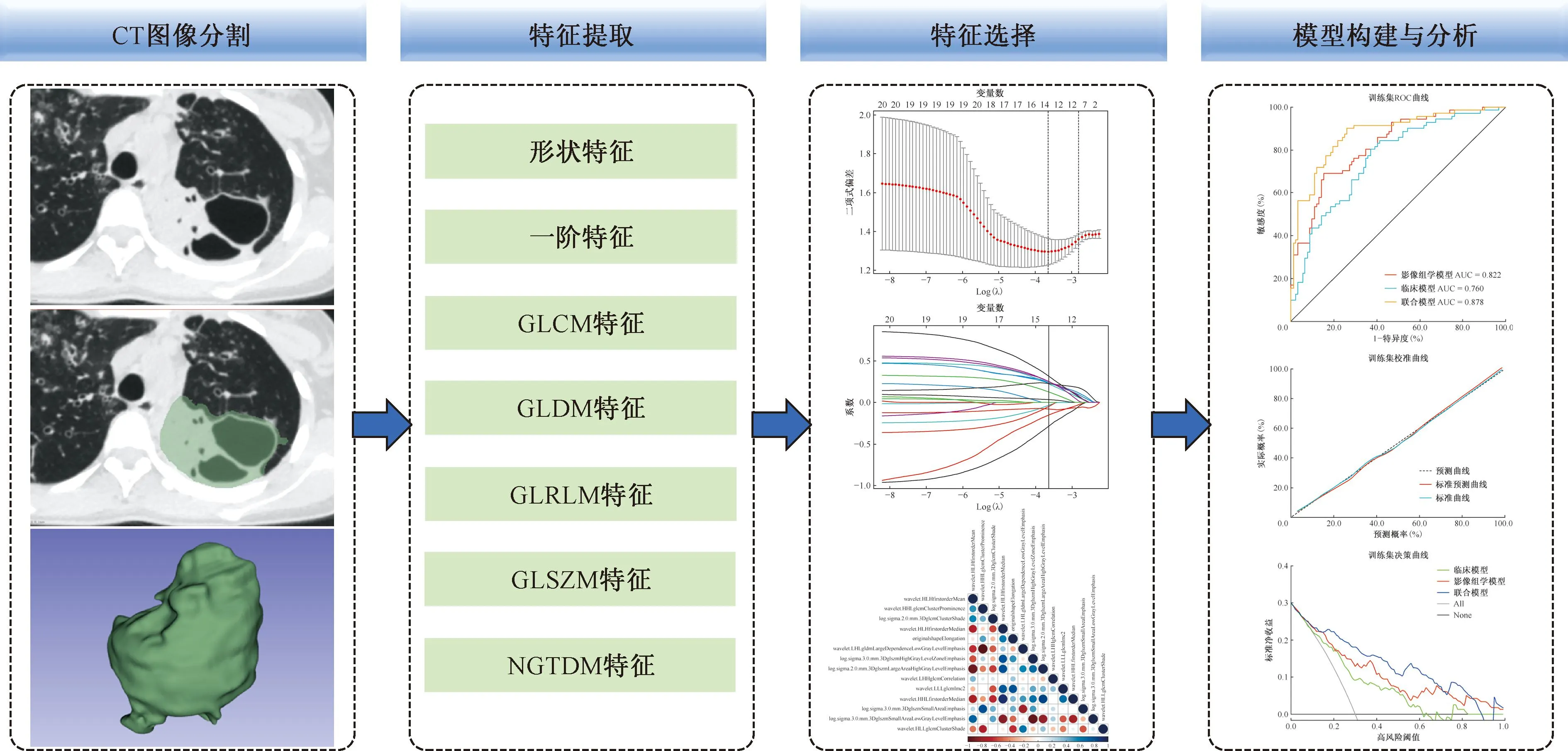
注 GLCM:grey-level co-occurrence matrix features,灰度共生矩陣; GLDM:grey-level dependence matrix,灰度相關矩陣; GLRLM:grey-level run-length matrix,灰度游程矩陣; GLSZM:grey-level size-zone matrix,灰度區域大小矩陣; NGTDM:neighboring gray tone difference matrix,鄰域灰度差矩陣
2.納入標準:(1)所有患者治療前均行胸部CT掃描;(2)患者符合《肺結核活動性判斷規范及臨床應用專家共識》[7]中的診斷標準;(3)通過藥敏試驗或GeneXpert MTB/RIF檢測以區分藥物敏感肺結核和耐藥肺結核患者。
3.排除標準:(1)合并艾滋病、糖尿病的患者;(2)合并其他肺部疾病,如肺癌、矽肺等;(3)CT掃描圖像質量較差;(4)影像資料或臨床資料不完整。
二、研究方法
1.一般數據收集:收集患者的一般臨床資料,包括年齡、性別、體質量指數(body mass index,BMI)、吸煙史、飲酒史、治療史。
2.掃描方法:分別采用聯影uCT 550 (80層螺旋CT)、GE revolution、東軟NeuViz 128三臺儀器進行CT掃描。掃描范圍:從肺尖掃描至橫膈水平。掃描條件:管電壓為100~120 kV,管電流采用自動毫安技術,掃描層厚5~8 mm,重建層厚0.625~1.25 mm,螺距為1,矩陣為512×512。從圖片存檔及通信系統(picture archiving and communication system,PACS)中以DICOM格式導出重建圖像,并應用3D Slicer 5.3.0軟件進行影像組學分析。
3.CT掃描圖像分析:2名胸部放射診斷醫師(分別具有3年、7年工作經驗)獨立分析患者的CT征象,并且對患者藥敏試驗結果不知情。CT圖像主要征象包括:(1)結節及衛星灶;(2)鈣化結節;(3)實變;(4)纖維條索;(5)支氣管擴張;(6)樹芽征。共同討論不同意見并且達成一致。
4.病灶分割與特征提取:使用3D Slicer軟件在薄層肺窗圖像上進行處理,由1名經驗豐富的胸部放射診斷醫師沿最大病灶邊緣(包括大片實變及空洞、病灶內支氣管)逐層獲得感興趣區(region of interest,ROI),并避開大血管及主支氣管。最后所勾畫的病灶所有層面通過軟件自動融合為感興趣體積(volume of interest,VOI),并由另1名高年資放射診斷醫師進行最終確認。首先對圖像進行1 mm×1 mm×1 mm重采樣,以減小不同設備之間的圖像差異。隨后對每例患者的VOI進行影像組學特征提取,包括形態特征、一階特征及紋理特征,后者包括灰度共生矩陣(gray level co-occurrence matrix,GLCM)及灰度游程矩陣(gray level run length matrix,GLRLM)等,并應用2個基本的內置濾波器,包括小波變換和高斯拉普拉斯濾波器(LoG),共提取1037個特征。1個月后隨機選擇30例患者病灶再次進行勾畫,進行組內相關性分析(intraclass correlation coefficient,ICC)以評估觀察者內一致性,>0.75表明相關性較好[8]。
5.特征選擇:對所有數據進行Z-score標準化處理后,采用最小冗余最大相關(minimum redundancy maximum relevance,MRMR)算法對訓練集特征進行篩選。然后采用最小絕對收縮與選擇算子(least absolute shrinkage and selection operator,LASSO)算法從剩余候選特征中選擇最優特征(圖2,3),采用10折交叉驗證避免過擬合。
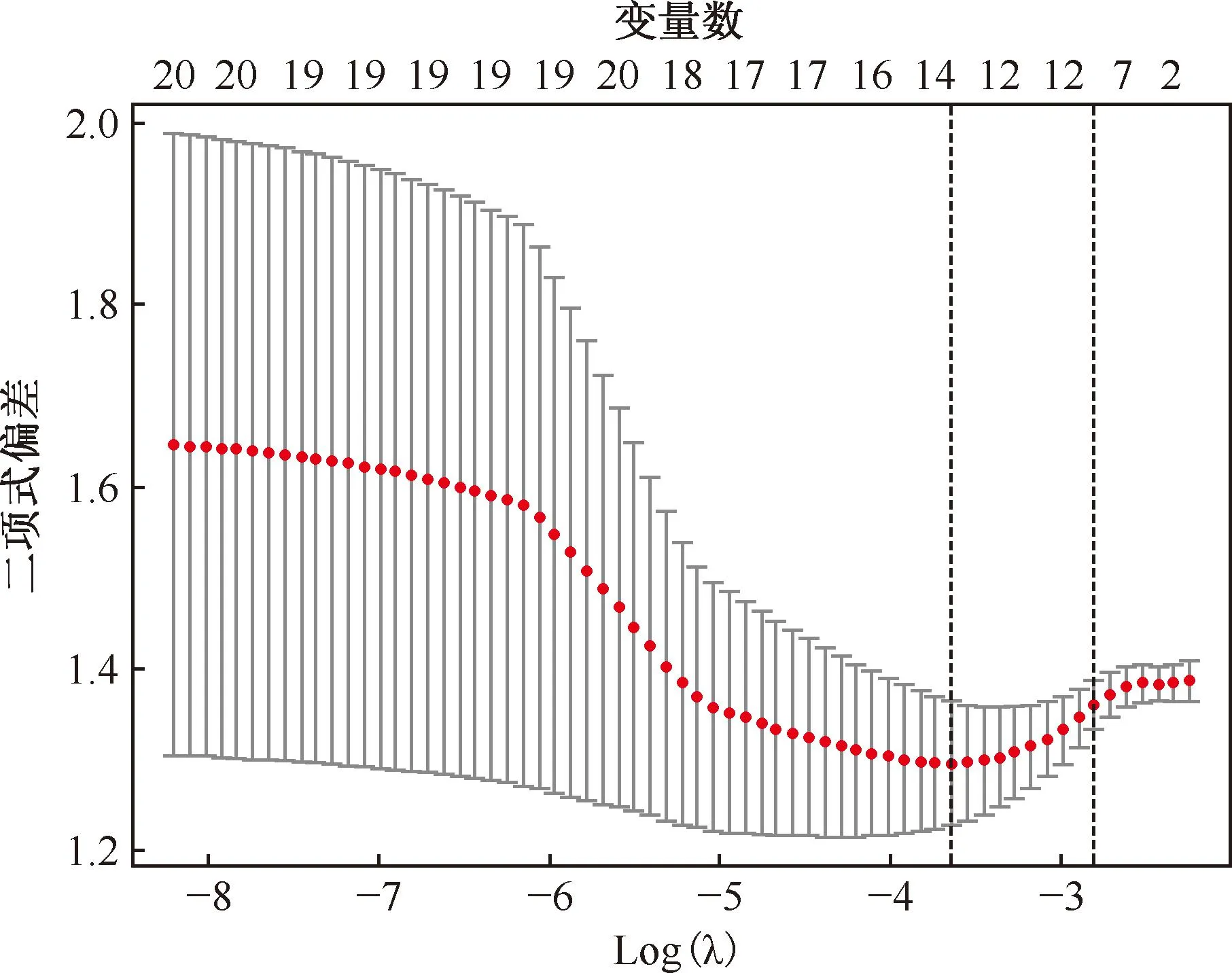
注 最小均方誤差處的最佳λ值為0.0262。左邊垂直虛線表示最佳λ值及所對應的特征數量,右邊虛線表示1倍標準差所對應最佳λ值
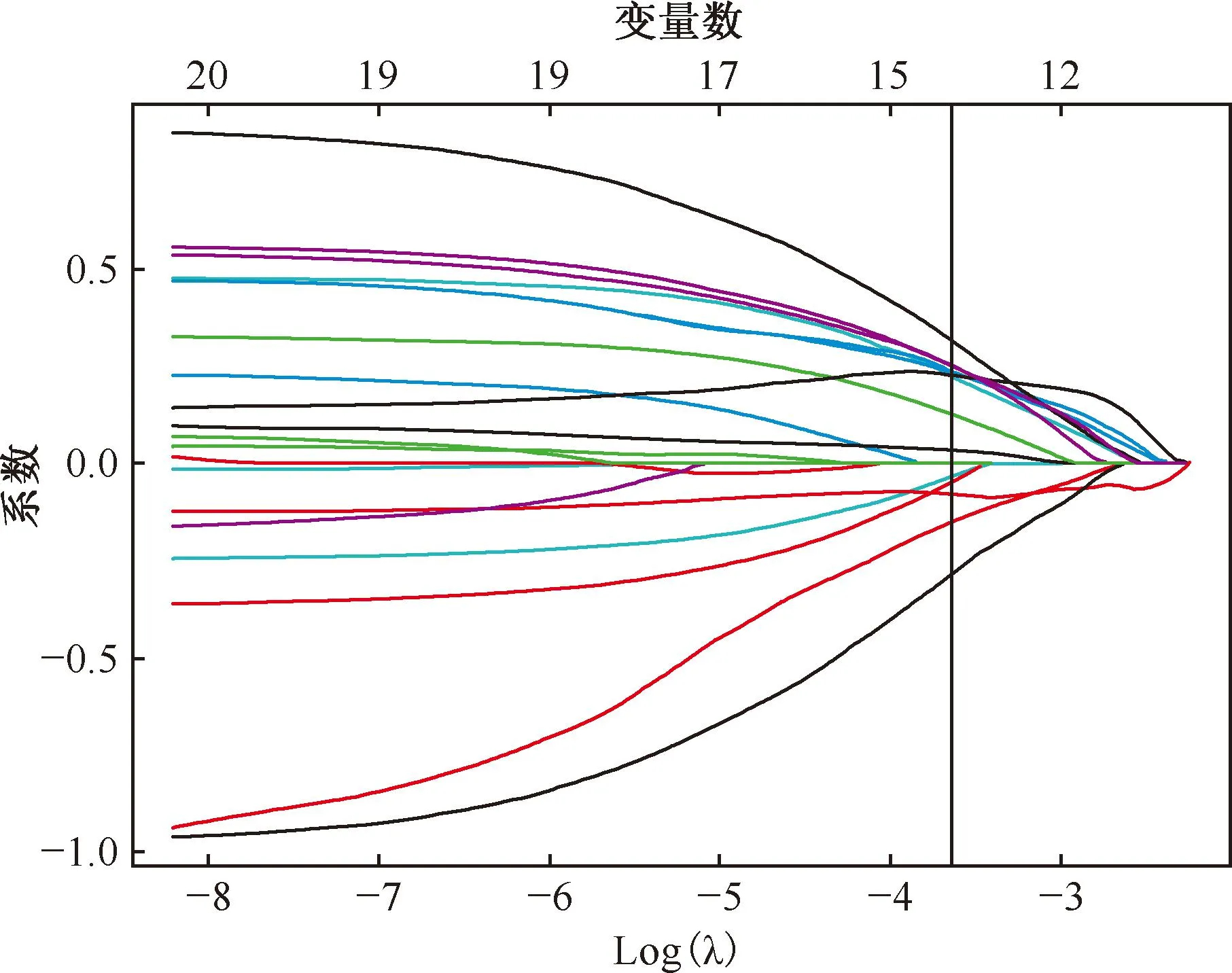
注 垂直線對應最佳λ值,保留此處系數不為0的14項影像組學特征
6.模型構建:為了評估不同模型在預測肺結核患者耐藥性的性能,采用logistic回歸方法分別建立臨床模型、影像組學模型和聯合模型。將所選擇的臨床特征及CT征象納入臨床模型;將經過MRMR和LASSO篩選的最優特征納入影像組學模型;最后將經過篩選的有統計學意義的臨床變量及CT征象與最優影像組學特征結合,構建聯合模型。
三、統計學處理
結 果
一、兩組患者一般資料及CT掃描結果比較
234例患者的臨床特征和CT特征見表1,耐藥肺結核患者和藥物敏感肺結核患者的治療史(P<0.001)和樹芽征(P=0.032)的差異均有統計學意義。其余選擇特征在兩組間的差異均無統計學意義。在CT征象分析中,2名醫師對結節及衛星灶(Kappa=0.757,P<0.001)、鈣化結節(Kappa=0.784,P<0.001)、實變(Kappa=0.818,P<0.001)、纖維條索(Kappa=0.777,P<0.001)、支氣管擴張(Kappa=0.863,P<0.001)、樹芽征(Kappa=0.781,P<0.001)的觀察一致性均較好。
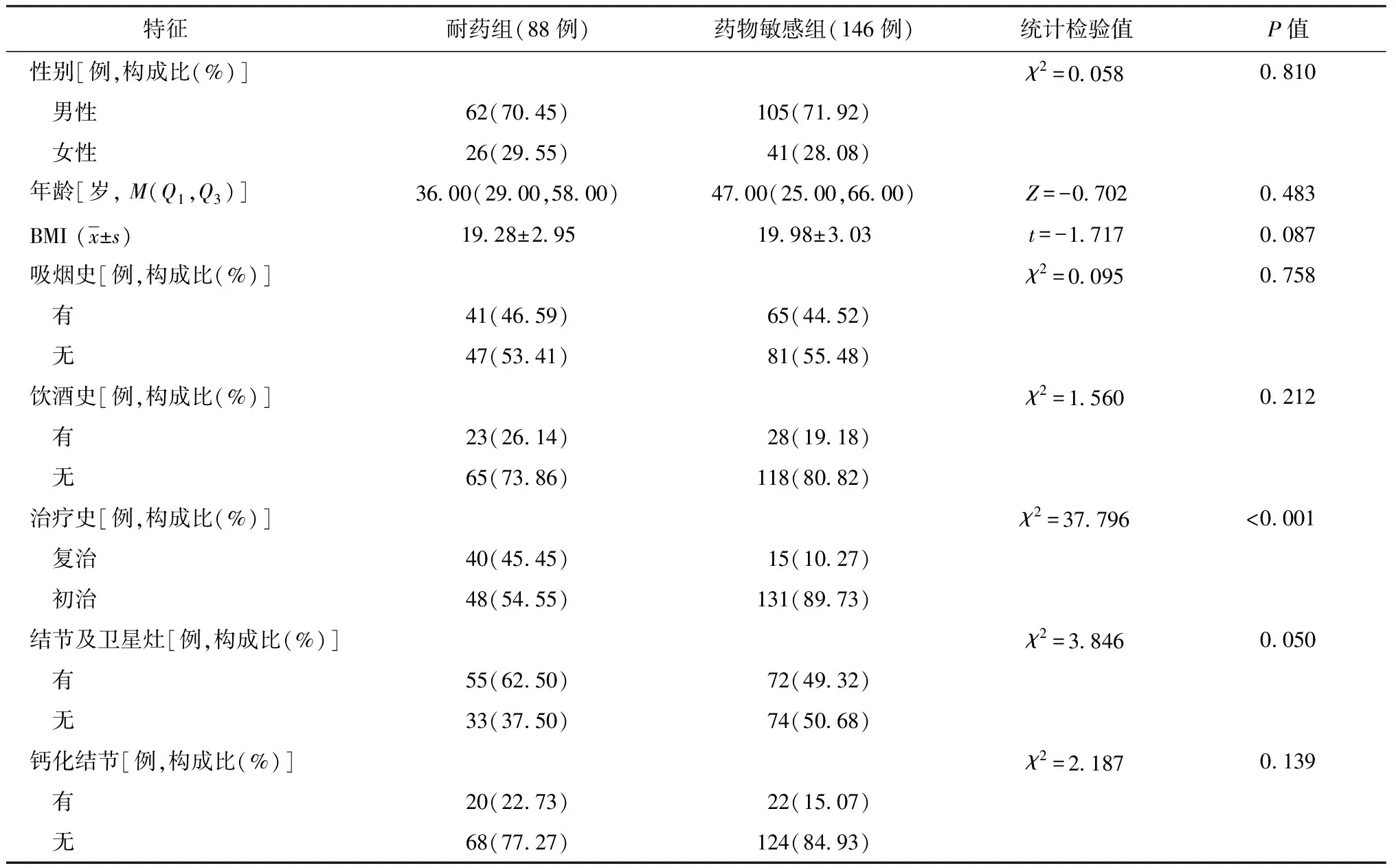
表1 兩組患者一般資料及CT掃描結果的比較
二、特征選擇
最初從CT掃描圖像中提取1037個定量影像組學特征。使用MRMR方法選擇前20個相關性最高的特征。使用LASSO篩選了14個影像組學特征,篩選的最佳影像組學特征相關性見圖4。

注 wavelet-HLH_firstorder_Mean:小波-HLH_階灰度特征_均值;wavelet-HHL_glcm_ClusterProminence:小波-HHL_灰度共生矩陣_集群突出;log-sigma-2.0 mm-3D_glcm_ClusterShade:log-σ-2.0 mm-3D_灰度共生矩陣_集群陰影;wavelet-HLH_firstorder_Median:小波-HLH_一階灰度特征_中值;original_shape_Elongation:原始_形狀_伸長率;wavelet-LHL_gldm_LargeDependenceLowGrayLevelEmphasis:小波-LHL_灰度相關矩陣_大依賴低灰度強調;log-sigma-3.0 mm-3D_glszm_HighGrayLevelZoneEmphasis:log-σ-3.0 mm-3D_灰度區域大小矩陣_高灰度區域強調;log-sigma-2.0 mm-3D_glszm_LargeAreaHighGrayLevelEmphasis:log-σ-2.0 mm-3D_灰度區域大小矩陣_大區域高灰度強調;wavelet-LHH_glcm_Correlation:小波-LHH_灰度共生矩陣_相關性;wavelet-LLL_glcm_Imc2:小波-LLL_灰度共生矩陣_相關信息測度2;wavelet-HHL_firstorder_Median:小波-HHL_一階灰度特征_中值;log-sigma-3.0 mm-3D_glszm_SmallAreaEmphasis:log-σ-3.0 mm-3D_灰度區域大小矩陣_小面積強調;log-sigma-3.0 mm-3D_glszm_SmallAreaLowGrayLevelEmphasis:log-σ-3.0 mm-3D_灰度區域大小矩陣_小區域低灰度強調;wavelet-HLL_glcm_ClusterShade:小波-HLL_灰度共生矩陣_集群陰影
三、模型性能和驗證
臨床模型、影像組學模型及聯合模型在訓練集和測試集中的ROC曲線見圖5、6。通過logistic回歸構建3種模型的預測性能見表2。在訓練集中臨床模型、影像組學模型、聯合模型的AUC值分別為0.760(95%CI:0.687~0.834)、0.822(95%CI:0.758~0.885)、0.878(95%CI:0.823~0.932),在測試集中臨床模型、影像組學模型、聯合模型的AUC值分別為0.820(95%CI:0.704~0.937)、0.845(95%CI:0.744~0.947)、0.888(95%CI:0.788~0.987),聯合模型在訓練集及測試集中均表現最好。Delong檢驗結果顯示,聯合模型與影像組學模型(Z=-2.625,P=0.009)、聯合模型與臨床模型的預測效能差異(Z=-3.073,P=0.002)均有統計學意義。
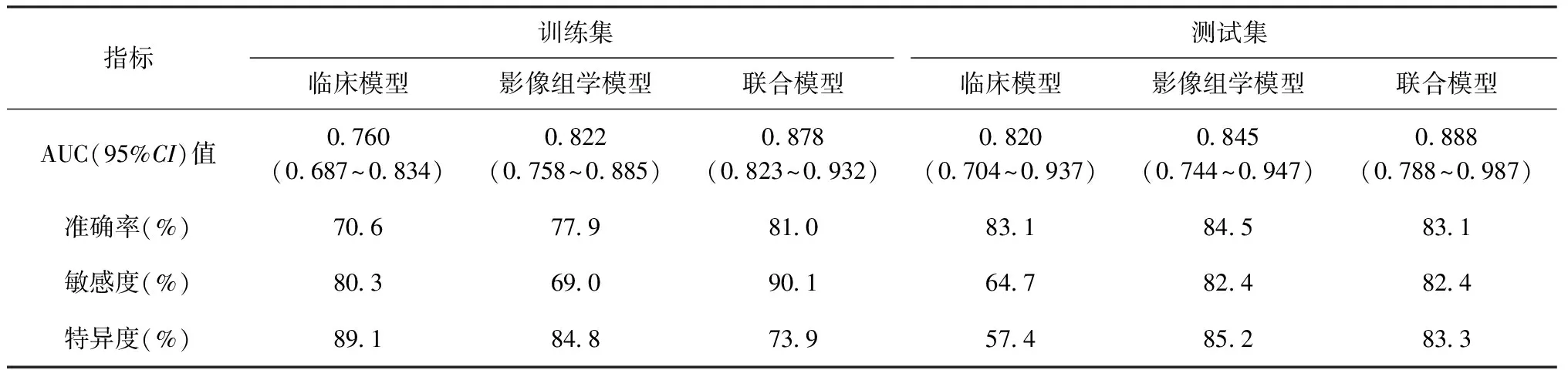
表2 3種模型在訓練集和測試集中的預測性能
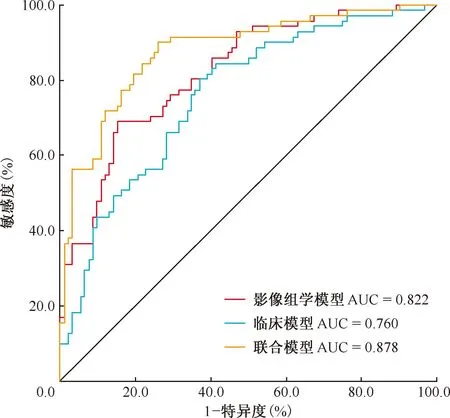
圖5 訓練集ROC曲線
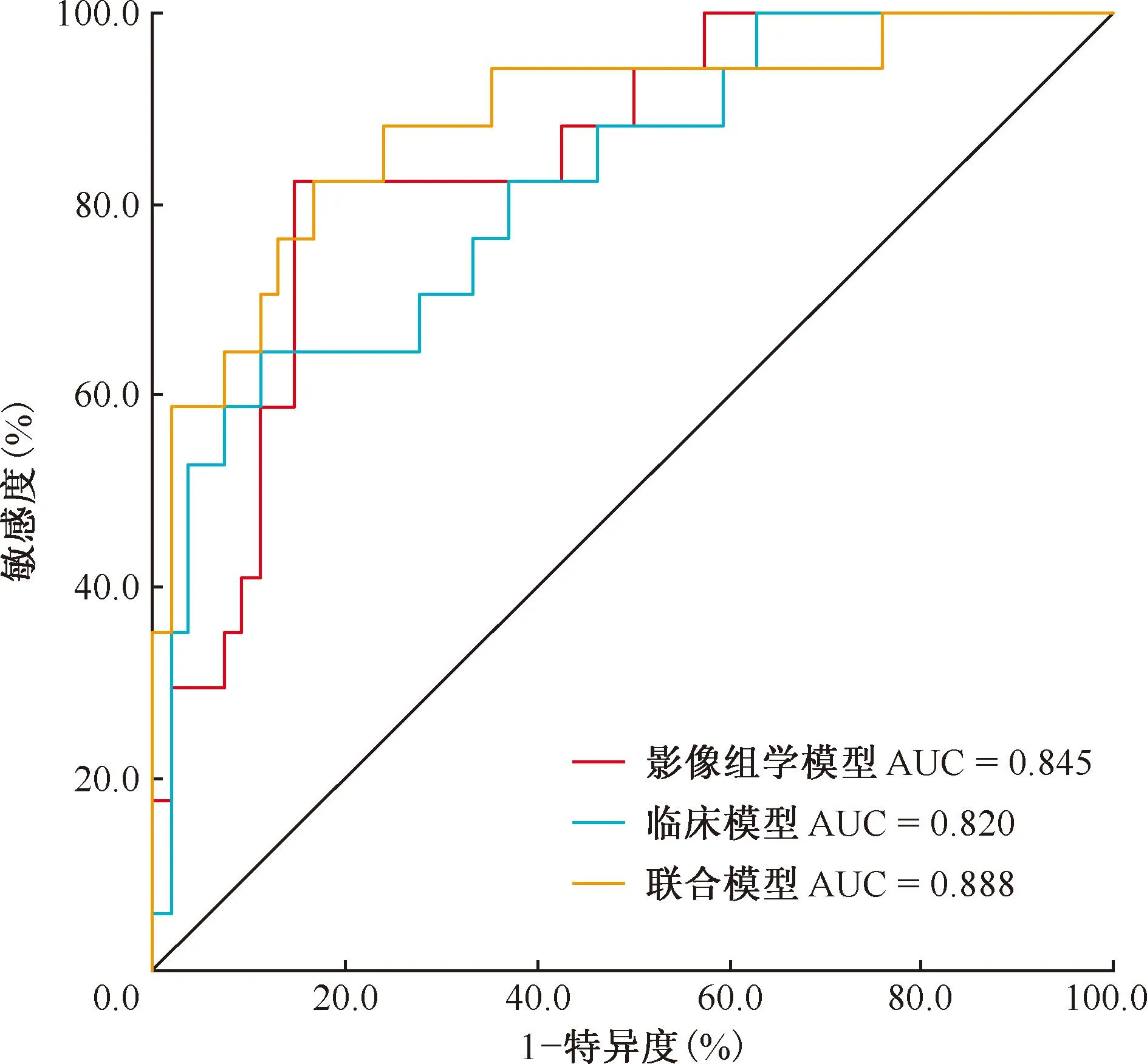
圖6 測試集ROC曲線
訓練集及測試集的校準曲線圖(圖7,8)顯示,校準預測曲線與標準曲線貼合尚可,提示聯合模型對耐藥肺結核與藥物敏感肺結核患者的預測概率與實際概率均具有良好的一致性。決策曲線(圖9,10)表明,在大多數概率閾值范圍內,聯合模型對患者進行耐藥性預測指導治療的臨床凈收益最高。

圖7 訓練集校準曲線
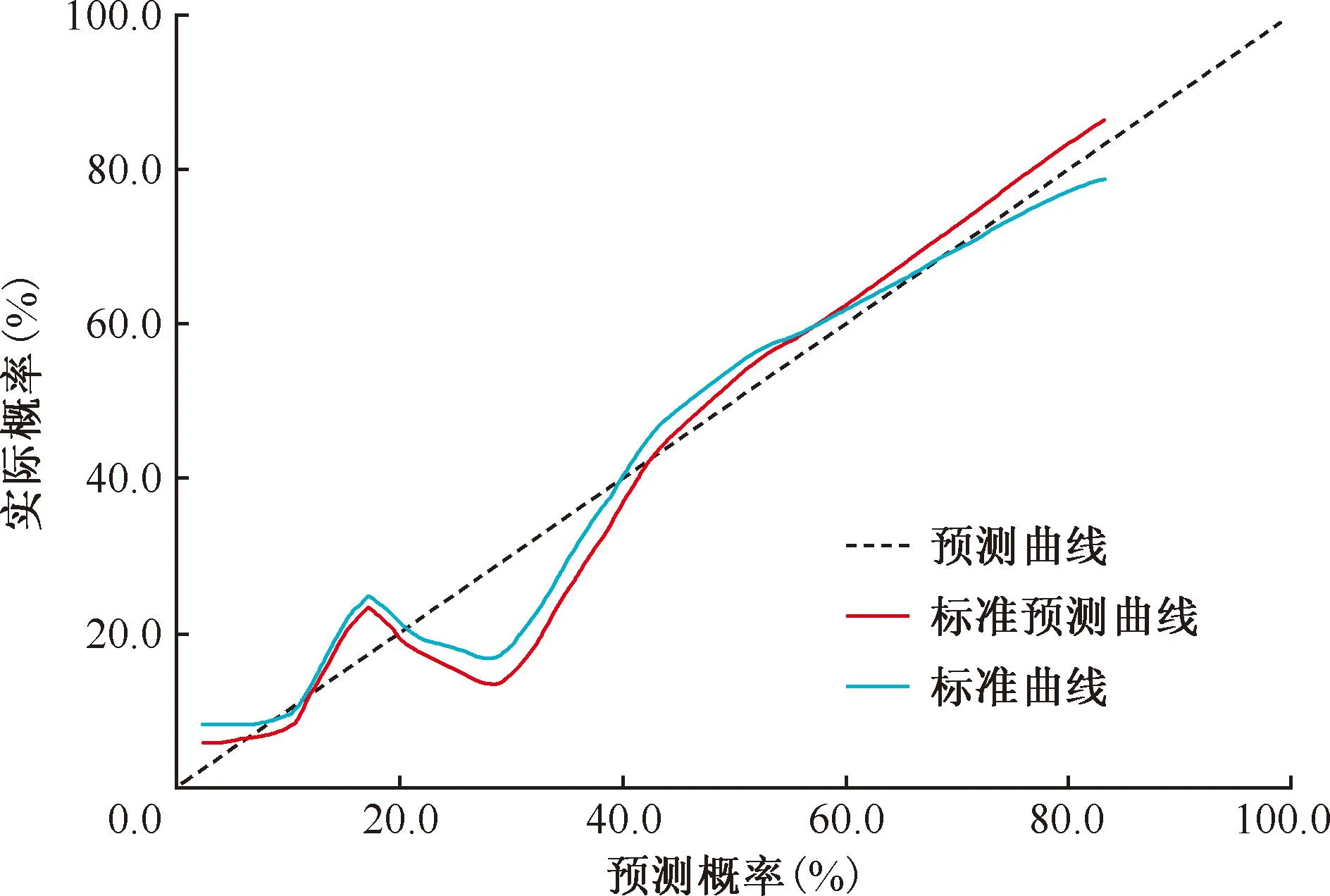
圖8 測試集校準曲線
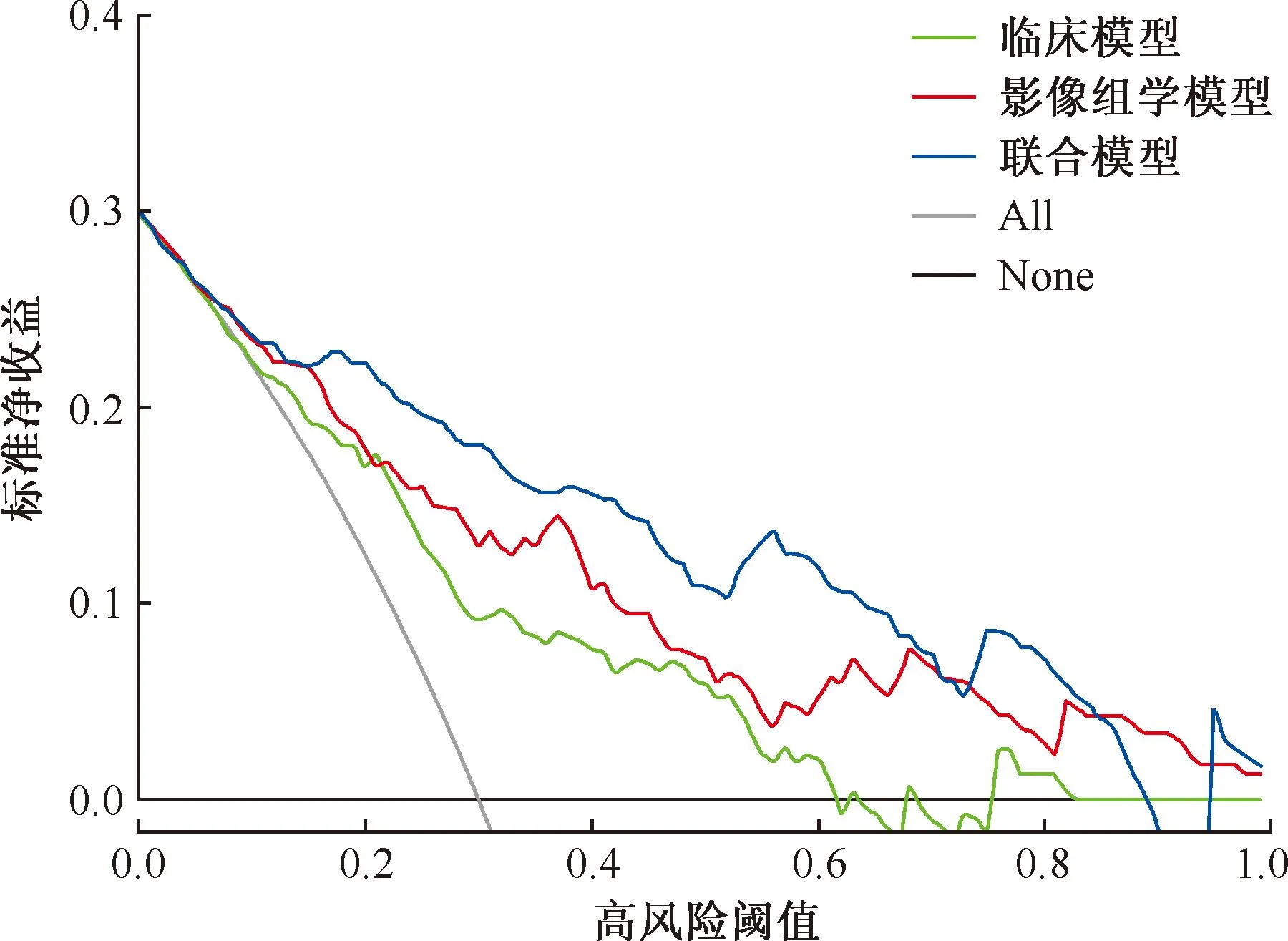
圖9 訓練集決策曲線
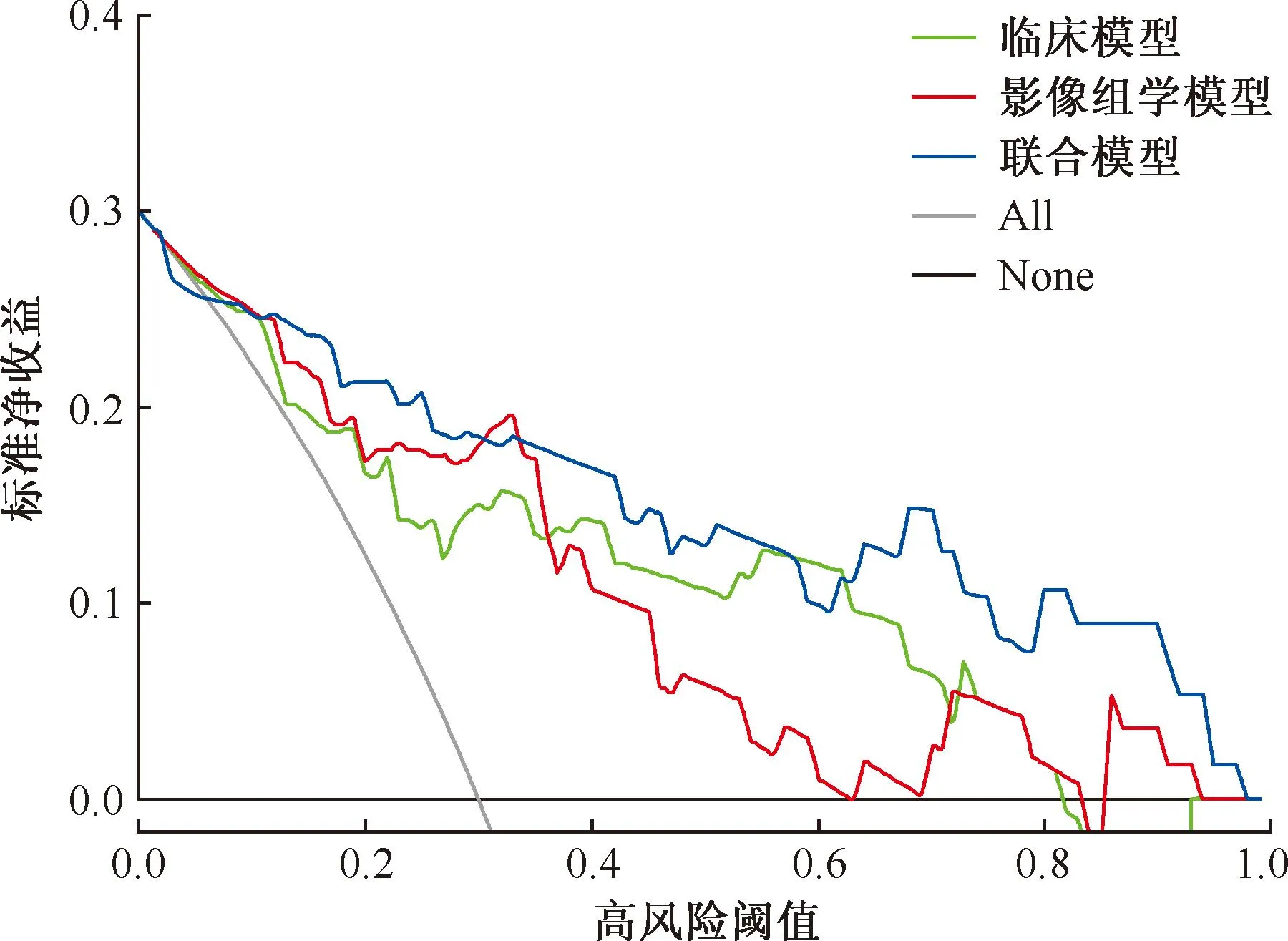
圖10 測試集決策曲線
討 論
耐藥肺結核的治療是我國結核病防治的一項重要工作,耐藥肺結核如果得不到及時確診,不僅嚴重影響患者的治療效果,而且加重患者的家庭經濟負擔。確診耐藥肺結核需要進行痰涂片鏡檢和細菌培養,而這個過程非常耗時。近年新興的檢查技術GeneXpert MTB/RIF和GeneXpert MTB/RIF Ultra能夠對結核分枝桿菌耐藥基因進行檢測,具有較高的敏感度和特異度;但在痰涂片陰性、合并艾滋病及兒童和肺外結核患者中診斷的敏感度有所降低[9]。本研究基于CT影像組學方法,旨在通過對耐藥肺結核進行預測,為臨床決策提供一種便捷、快速且非侵入性的工具。相比傳統方法,本研究的CT影像組學方法具有更高的可行性和應用潛力,在提高診斷效率和減少患者負擔方面具有顯著優勢。本研究應用logistic回歸方法建立多個預測模型,以預測耐藥肺結核和藥物敏感肺結核患者,并在訓練集和測試集中成功地驗證其性能;其中,結合臨床特征與影像組學特征構建的聯合模型具有最高的鑒別診斷價值(訓練集AUC=0.878,測試集AUC=0.888)。
近年來,影像組學發展迅速,它可以將醫學圖像轉化為高維圖像,通過對高通量數據進行定量分析,為臨床提供額外的診斷信息,并能夠通過影像組學對患者進行疾病診斷、生存預測及療效評估,越來越廣泛地應用于臨床研究[6,10-11]。影像組學在肺部疾病的診斷和鑒別診斷中也起著非常重要的作用,如肺癌與肺結核、隱球菌肺炎等疾病的鑒別診斷[12-13],均表現出較好的結果。然而,影像組學關于肺結核耐藥性的相關性研究較少,可能與肺結核病灶的CT表現復雜多樣有關。本研究通過影像組學方法,對肺結核患者的耐藥性進行預測,所構建的模型取得較好的結果。Li等[14]基于CT影像組學構建機器學習模型預測空洞性肺結核耐藥性,其中聯合模型在訓練集和測試集的AUC值分別為0.881與0.834,與本研究中聯合模型在訓練集和測試集的AUC值分別為0.878和0.888的結果大致相仿。本研究納入的實變病灶中,部分病灶內可見不規則空洞及支氣管擴張,考慮到肺結核患者肺部CT征象的復雜性和病灶范圍廣泛。本研究勾畫感興趣區體積及提取的影像組學特征更具有普遍適用性,對臨床應用具有更重要的應用價值。
根據臨床特征分析顯示,發現既往有結核病治療史的患者更有可能對抗結核藥物耐藥,這與Pradipta 等[15]的研究結果一致。初診肺結核患者未經過利福平和異煙肼等藥物抗結核治療,患者體內結核分枝桿菌生物活性比較敏感;而復治肺結核患者經過長期抗結核治療,如果不能規律全程用藥,體內結核分枝桿菌對藥物產生耐藥的概率會增加,更容易導致耐藥的發生[16]。本研究在性別、年齡、BMI、吸煙史和飲酒史方面,兩組間差異均無統計學意義,表明這些臨床特征可能不是耐藥肺結核發展的危險因素。本研究中耐藥肺結核和藥物敏感肺結核患者的CT表現有很多相似點,兩組間結節及衛星灶、鈣化結節、實變、纖維條索及支氣管擴張之間的差異均無統計學意義。這與梁瑞云等[17]報道耐藥肺結核伴空洞與藥物敏感肺結核伴空洞患者的實變影、結節/團塊影、支氣管擴張之間的差異均無統計學意義的結果一致。進一步的研究可能需要考慮其他潛在的因素來解釋耐藥肺結核的發生和發展。樹芽征的病理依據是結核分枝桿菌的支氣管內播散[18],是活動性肺結核的重要CT征象;在非活動性肺結核CT圖像上也可長期存在,但病變輪廓更為清楚。患者CT征象分析顯示樹芽征在兩組間差異有統計學意義,盡管藥物敏感組的樹芽征患者比例高于耐藥組,但根據這一征象并不能區分兩者。筆者認為有必要利用定量分析來探索耐藥肺結核和藥物敏感肺結核之間的具體差異,而影像組學在這方面很有前景。
綜上所述,基于CT影像組學結合臨床特征構建的影像組學模型可以有效地識別耐藥肺結核和藥物敏感肺結核患者,這對耐藥肺結核患者的早期無創診斷和鑒別具有重要意義。
利益沖突所有作者均聲明不存在利益沖突
作者貢獻潘犇:醞釀和設計實驗、實施研究、采集數據、分析/解釋數據、起草文章、統計分析;梁長華、韓東明和崔俊偉:醞釀和設計實驗、對文章的知識性內容作批評性審閱、行政/技術/材料支持、指導;姚陽陽:醞釀和設計實驗、實施研究、采集數據、分析/解釋數據、統計分析;魏正琦、甄思雨、危涵羽和楊鑫淼:實施研究、采集數據、分析/解釋數據、統計分析

