塞普替尼合成路線綜述
陳 龍,胡 偉,黃 璐,范昭澤*
1. 武漢九州鈺民醫藥科技有限公司,湖北 武漢 430071;
2. 武漢工程大學化工與制藥學院,湖北 武漢 430205;
3. 武漢大學藥學院,湖北 武漢 430072
抗癌藥物不斷被發現,在腫瘤治療中發揮著越來越重要的作用[1]。腫瘤的靶向治療是一種針對特定靶向位點的細胞分子水平的治療方式[2]。2022 年7 月19 日,Eli Lilly 公司宣布,全球首個高選擇性的轉染重排(rearranged during transfection,RET)酪氨酸激酶抑制劑(RET 抑制劑)靶向藥物塞普替尼(selpercatinib,1)獲準在中國海南博鰲超級醫院用于臨床急需,該藥物為RET 融合陽性的非小細胞肺癌(non-small cell lung cancer,NSCLC)和甲狀腺癌(thyroid cancer)患者在“先行先試”的政策條件下提供了新的治療選擇[3]。
塞普替尼研發代號為LOXO-292、LY352772,英文化學名為6-(2-hydroxy-2-methylpropoxy)-4{6-[6-[(6-methoxypyridin-3-yl)methyl]-3,6-diazabicyclo [3.1.1] heptane-3-yl] pyridin-3-yl}pyrazolo[1,5-α]pyridine-3-carbonitrile,中文化學名為6-(2-羥基-2-甲基丙氧基-4{6-[6-[(6-甲氧基吡啶-3-基)甲基]-3,6-二氮雜雙環[3.1.1]庚烷-3-基)吡啶-3-基]吡啶-3-基}吡唑[1,5-α]吡啶-3-甲腈,中文別名為賽哌替尼、塞普替尼、塞帕替尼、色普替尼、色普卡替尼等,其原研為美國Array 生物制藥(Array BioPharma)公司。2013 年7 月,Loxo Oncology Eli Lilly 公司與Array 公司簽訂多項許可和合作協議,由Loxo 公司進行后續研究開發。2020 年5 月8 日,美國FDA 批準Eli Lilly 公司的口服塞普替尼膠囊(規格40 mg 和80 mg,商品名Retevmo)上市,用于治療:(1)轉移性RET 融合陽性的NSCLC 成人患者;(2)需要系統治療的晚期或轉移性RET 突變甲狀腺髓樣癌(medullary thyroid cancer,MTC)的成人和12 歲及以上兒童患者;(3)需要系統治療并且是放射性碘難治的晚期或轉移性RET 融合陽性甲狀腺癌的成人和12歲及以上兒童患者。塞普替尼是全球首個獲得批準上市的專門針對攜帶RET 基因突變的癌癥患者的療法[4-10]。2022 年9 月30 日,Eli Lilly 公司的塞普替尼膠囊獲得NMPA 批準在中國上市(規格為40 mg 和80 mg,商品名:睿妥)。
作者根據不同的起始物料和合成工藝綜述了塞普替尼的合成路線,匯總的合成路線圖見圖1。
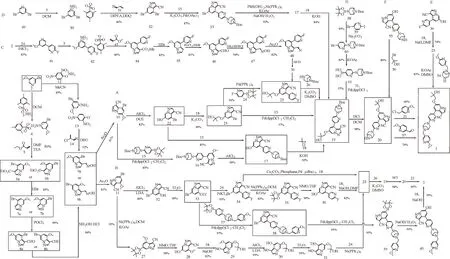
圖1 塞普替尼(1)的合成路線圖Fig.1 Graphical synthetic routes of selpercatinib(1)
1 方法A-C
此3 種方法均以3-溴-5-甲氧基吡啶(2)為起始物料。
1.1 方法A 和方法B
方法A 出自Array 公司提交的PCT 國際專利申請WO2018071454A1[11]中所述的合成路線和方法,MENDIOLA 等[12-17]分別對方法A 的部分或全部路線進行報道;方法B 出自Loxo 公司和Array公司提交的美國專利申請US20190106438A1[18]所述的合成路線和方法,此外David 等[19]對方法B的過程進行報道。
方法A 和方法B 分別以4-溴-6-甲氧基吡唑并[1,5-α]吡啶-3-甲腈(10)、6-溴-4-甲氧基吡唑并[1,5-α]吡啶-3-甲腈(11)作為關鍵中間體,依據多條合成路線制備目標化合物塞普替尼(1)。化合物10 和化合物11 的合成過程相同,都是以3-溴-5-甲氧基吡啶(2)為起始物料,通過兩條路徑合成而來。化合物10 與化合物11 為區域異構體,在合成此區域異構體時,反應條件及后續處理基本保持一致。
合成化合物10 和化合物11 的過程如下。
路徑一:以2 為起始物料,其與2,4,6-三甲基苯磺酰羥胺(3)發生氨基取代反應得到1-氨基-3-溴-5-甲氧基吡啶-1-鎓-2,4,6-三甲基苯磺酸鹽(4),所得產物4 直接與丙炔酸乙酯(5)發生環合反應分別得到4-溴-6-甲氧基吡唑并[1,5-α]吡啶-3-甲酸乙酯(6a)或6-溴-4-甲氧基吡唑并[1,5-α]吡啶-3-甲酸乙酯(6b),6a 或6b 在氫溴酸的作用下水解脫羧而得到4-溴-6-甲氧基吡唑并[1,5-α]吡啶(7a)或6-溴-4-甲氧基吡唑并[1,5-α]吡啶(7b),7a或7b 在三氯氧磷/DMF 條件下發生Vilsmeier-Haack甲酰化反應得到4-溴-6-甲氧基吡唑并[1,5-α]吡啶-3-甲醛(8a)或6-溴-4-甲氧基吡唑并[1,5-α]吡啶-3-甲醛(8b),8a 或8b 與鹽酸羥胺發生肟化反應得到4-溴-6-甲氧基吡唑并[1,5-α]吡啶-3-甲醛肟(9a)或6-溴-4-甲氧基吡唑并[1,5-α]吡啶-3-甲醛肟(9b),9a 或9b 經與醋酐反應后得到化合物10或化合物11。
路徑二:以2 為起始物料,與2,4-二硝基苯氧基胺(12)發生胺基取代反應得到中間態產物1-氨基-3-溴-5-甲氧基吡啶-1-鎓-2,4-二硝基苯酚鹽(13),13 直接與2-氯丙烯腈(14)發生環合反應得到化合物10 或化合物11。
1.1.1 方法A 化合物10 與3-(5-(4,4,5,5-四甲基-1,3,2-二氧戊環-2-基)吡啶-2-基)-3,6-二氮雜雙環[3.1.1]庚烷-6-羧酸叔丁酯(15)發生Suzuki 偶聯反應生成3-(5-(3-氰基-6-甲氧基吡唑并[1,5-α]吡啶-4-基)吡啶-2-基)-3,6-二氮雜雙環[3.1.1]庚烷-6-羧酸叔丁酯(16),16 在無水AlCl3的作用下脫去甲氧基中甲基而生成3-(5-(3-氰基-6-羥基吡唑并[1,5-α]吡啶-4-基)吡啶-2-基)-3,6-二氮雜雙環[3.1.1]庚烷-6-羧酸叔丁酯(17),17 與1-氯-2-甲基-2-丙醇(18)在氫氧化鉀的作用下進行乙氧基化反應得到關鍵中間體3-(5-(3-氰基-6-(2-羥基-2-甲基丙氧基)吡唑并[1,5-α]吡啶-4-基)吡啶-2-基)-3,6-二氮雜雙環[3.1.1]庚烷-6-羧酸叔丁酯(19),19在鹽酸的作用下脫Boc 得到4-(6-(3,6-二氮雜雙環[3.1.1]庚烷-3-基)吡啶-3-基)-6-(2-羥基-2-甲基丙氧基)吡唑并[1,5-α]吡啶- 3-腈(20),20 與5-(氯甲基)-2-甲氧基吡啶(21)發生N-烷基化反應得到1。
化合物10 也可在無水AlCl3作用下脫去甲氧基中甲基成4-溴-6-羥基吡唑并[1,5-α]吡啶-3-甲腈(22)。通過22 有3 種路徑可以制備化合物19。
路徑一:22 與18 發生乙氧基化反應生成4-溴-6-(2-羥基-2-甲基丙氧基)吡唑并[1,5-α]吡啶-3-甲腈(23),23 與2-氟-5-(4,4,5,5-四甲基-1,3,2-二氧硼雜環戊烷-2-基)吡啶(24)發生Suzuki偶聯反應得到4-(6-氟吡啶-3-基)-6-(2-羥基-2-甲基丙氧基)吡唑并[1,5-α]吡啶-3-甲腈(25),25 與3,6-二氮雜雙環[3.1.1]庚烷-6-羧酸叔丁酯(26)發生N-烷基化反應得到19。
路徑二:22 與18 發生乙氧基化反應生成23后,23 可與15 發生Suzuki偶聯反應得到19。
路徑三:22 與15 發生Suzuki 偶聯反應得到17,17 與18 在氫氧化鉀的作用下進行乙氧基化反應得到19,19 之后的反應與上述制備1 的反應過程一致。
1.1.2 方法B 化合物11 可通過4 種路徑制備目標化合物1。其中有3 種合成路線需要合成至相同的關鍵中間體25,再按照方法A 中所述內容來制備目標化合物1。
合成化合物25 的方法如下。
路徑一:化合物11 在鈀催化劑作用下發生Miyaura 硼化反應得到4-甲氧基-6-(4,4,5,5-四甲基-1,3,2-二氧硼雜環戊烷-2-基)吡唑并[1,5-α]吡啶-3-甲腈(27),27 在N-甲基嗎啉氮氧化物(NMO)作用下被氧化成6-羥基-4-甲氧基吡唑并[1,5-α]吡啶-3-甲腈(28),28 與18 發生乙氧基化反應得到6-(2-羥基-2-甲基丙氧基)-4-甲氧基吡唑并[1,5-α]吡啶-3-甲腈(29),29 在無水AlCl3作用下脫去甲氧基中甲基成4-羥基-6-(2-羥基-2-甲基丙氧基)吡唑并[1,5-α]吡啶-3-甲腈(30),30 在三氟甲磺酸酯化試劑的作用下生成3-氰基-6-(2-羥基-2-甲基丙氧基)吡唑并[1,5-α]吡啶-4-基三氟甲磺酸酯(31),31 與24 發生Suzuki偶聯反應得到25。
路徑二:化合物11 在無水AlCl3的作用下脫去甲氧基中甲基而生成6-溴-4-羥基吡唑并[1,5-α]吡啶-3-甲腈(32),32 在三氟甲磺酸酯化試劑的作用下生成6-溴-3-氰基吡唑并[1,5-α]吡啶-4-基三氟甲磺酸酯(33),33 與24 發生Suzuki 偶聯反應得到6-溴-4-(6-氟吡啶-3-基)吡唑并[1,5-α]吡啶-3-甲腈(35),35 在鈀催化劑作用下發生Miyaura 硼化反應而生成4-(6-氟吡啶-3-基)-6-(4,4,5,5-四甲基-1,3,2-二氧硼雜環戊烷-2-基)吡唑并[1,5-α]吡啶-3-甲腈(36),36 與18 在強堿的作用下發生乙氧基化反應得到25。
路徑三:如同路徑二中方法,化合物11 合成至化合物34,34 在鈀催化及弱堿環境下與磷雜環丙烷類化合物及18 一鍋法合成25。
方法B 中第4 種合成化合物1 的過程是化合物11 按照上述路徑二中合成過程制備33 后,33 與6-[(6-甲氧基吡啶-3-基)甲基]-3-[5-(4,4,5,5-四甲基-1,3,2-二氧硼雜環戊烷-2-基)吡啶-2-基]-3,6-二氮雜雙環[3.1.1]庚烷(37)發生Suzuki 偶聯反應得到6-溴-4-{6-[6-[(6-甲氧基吡啶-3-基)甲基]-3,6-二氮雜雙環[3.1.1]庚烷-3-基]吡啶-3-基}吡唑并[1 ,5-α]吡啶-3-甲腈(38),38 在鈀催化劑作用下發生Miyaura 硼化反應得到4-{6-[6-[(6-甲氧基吡啶-3-基)甲基]-3,6-二氮雜雙環[3.1.1]庚烷-3-基]吡啶-3-基}-6-(4,4,5,5-四甲基-1,3,2-二氧硼雜環戊烷-2-基)吡唑[1,5-α]吡啶-3-甲腈(39),39在氫氧化鈉和過氧化氫的作用下被氧化成6-羥基-4-{6-[6-[(6-甲氧基吡啶-3-基)甲基]-3,6-二氮雜雙環[3.1.1]庚烷-3-基]吡啶-3-基}吡唑并[1,5-α]吡啶-3-腈(40),40 在強堿條件下與18 發生乙氧基化反應得到1。
方法A 和方法B 都具有兩條合成路徑制備關鍵中間體10 或11,其中一條合成路徑需要進行6步反應才能制備關鍵中間體,過于繁瑣,反應得到6a 和6b[n(6a)∶n(6b)=1.6∶1],收率為46%~48%,其他反應收率在80%~95%,總收率<20%,不適合工業化的需求;另一條合成路線只需3 步反應,大大優化了反應過程,提高了反應收率。合成關鍵中間體10 或11 之后,方法A 和方法B 可通過多種路徑合成目標化合物1,合成路線具有可選擇性,可以根據車間生產設備和生產成本進行路線選擇,更加適合車間規模生產需求,能較為快速地完成生產前準備匹配市場需要。
方法A 的每一種路徑,都使用了昂貴的鈀試劑作為催化劑,可通過重復利用催化劑和溶劑套用的手段去降低反應的物料成本,但是產品需要進行重金屬殘留的處理,增加了質量研究難度,并且方法A 中有高溫、高壓的封管反應,危險性高,對反應設備和操作人員的技術要求高。與方法A相比,方法B 具有反應步驟少、反應收率高等優點。盡管方法B 中所有路線都使用鈀試劑,且少數步驟更是使用到過氧化氫,這使得反應的成本以及反應過程的危險性都有所增加,但是通過對鈀試劑和溶劑的重復套用可以大大減少成本并且站在工藝安全化的考慮,方法B 更容易工業化。
1.2 方法C
方法C 來源于江蘇慧聚藥業有限公司的中國專利申請CN202110688238.8[20]所公開的合成路線和方法。該方法是以2 為起始物料,經多步反應得到4-(6-氟吡啶-3-基)-6-甲氧基吡唑并[1,5-α]吡啶-3-甲腈(48),48 可用于制備塞普替尼(1)關鍵的中間體25。
該路線具體過程如下:2 與24 在鈀試劑作為催化劑的條件下發生Suzuki 偶聯反應生成6'-氟-5-甲氧基-3,3'-聯吡啶(41),41 與3 反應制備1-氨基-6'-氟-5-烷氧基-[3,3'-聯吡啶]-1-鎓-2,4,6-三甲基苯磺酸鹽(42),42 與丙炔酸甲酯(43)發生環合反應得到4-(6-氟吡啶-3-基)-6-甲氧基吡唑并[1,5-α]吡啶-3-羧酸甲酯(44),44 在氫溴酸的作用下水解脫羧得到4-(6-氟吡啶-3-基)-6-甲氧基吡唑并[1,5-α]吡啶(45),45 在三氯氧磷/DMF 條件下發生Vilsmeier-Haack 甲酰化反應得到4-(6-氟吡啶-3-基)-6-甲氧基吡唑并[1,5-α]吡啶-3-甲醛(46),46 與鹽酸羥胺發生肟化反應得到4-(6-氟吡啶-3-基)-6-甲氧基吡唑并[1,5-α]吡啶-3-甲醛肟(47),47 與醋酐反應得到48。用48 制備25 的過程為,48 在無水AlCl3作用下脫去甲氧基中甲基成36,36 與18 在堿性條件下發生乙氧基化反應得到關鍵中間體25。
該方法主要提供了一種制備化合物48 的合成方法,48 是制備關鍵中間體25 的重要化合物。方法C 與方法A 及方法B 相同之處在于所用起始物料都為2;不同之處在于方法C 規避了原研發公司的化合物合成專利路線,創造性地設計一種合成25 的新工藝路線,但其過程中采用鈀試劑作為催化劑,使用了不易處理的鈀催化劑、極性與產物近似的丙炔酸甲酯和高腐蝕性的三氯氧磷和易揮發性的氫溴酸,且反應后需要多次使用柱層析來純化產物,增加該方法的操作難度和生產成本,導致該方法難應用于大規模生產中。
2 方法D
方法D 也來源于Loxo 公司和Array 公司提交的美國專利申請US20190106438A1[18]所述的合成路線和方法,David 等對方法F 的合成方法進行了后續報道[19]。
該方法是以3,5-二溴吡啶(49)為起始物料,經7 步反應制備化合物1。具體的過程如下:49 與3 反應生成1-氨基-3,5-二溴吡啶-1-鎓-2,4,6-三甲基苯磺酸鹽(50),50 與丙烯腈(51)發生環合反應生成4,6-二溴吡唑并[1,5-α]吡啶-3-甲腈(52),52與15 在鈀催化劑和弱堿的作用下發生Suzuki偶聯反應生成3-[5-(6-溴-3- 氰基吡唑并[1,5-α]吡啶-4-基)吡啶-2-基]-3,6-二氮雜雙環[3.1.1]庚烷-6-羧酸叔丁酯(53),53 在鈀催化劑作用下發生Miyaura 硼化反應及在氫氧化鈉和過氧化氫的作用下被氧化成17,17 的后續反應按照方法A 中所述過程開展。
該方法是原研公司開發的另一種合成路線,其使用了不同的起始物料,進一步豐富了原研公司關于化合物1 的合成方法,與方法A 相比該方法具有路徑短、收率較高等優點。與方法A 制備關鍵中間體17 過程相比較,方法D 同樣使用到昂貴的金屬催化劑和復雜的純化過程,但可通過重復套用及技術改進等優化手段,可以降低方法D 的成本問題,并且方法D 的反應條件相對溫和,使其更適合于工業化生產。
3 方法E
方法E 是武漢九州鈺民醫藥科技有限公司的中國專利CN201911346875.6[21]所述的合成路線和方法(該專利已獲得授權)。該方法是以4-(6-氟吡啶-3-基)-6-羥基吡唑并[1,5-α]吡啶-3-甲腈(36)為起始物料,與18 在氫化鈉的作用下發生乙氧基化反應生成25,25 與6-[(6-甲氧基吡啶-3-基)甲基]-3,6-二氮雜雙環[3.1.1]庚烷(54)發生N-烷基化反應生成1。
該方法使用化合物36 作為起始物料,經二步反應制備化合物1,極大縮短了反應的歷程,提高反應的收率;該方法使用強堿NaH 替代原研工藝的弱堿作為乙氧基化反應的催化劑,避免了高溫、高壓的危險反應過程,但需注意大量使用氫化鈉時燃燒爆炸的危險。該方法具有路線短、總收率高和目前生產成本較高的特點,生產企業需要綜合性地考慮物料成本和時間成本之間的利弊。
4 方法F
方法F 是武漢九州鈺民醫藥科技有限公司的中國專利CN201911348328.1[22]所述的合成路線和方法(該專利已獲得授權)。該方法是以4-[6-(3,6-二氮雜雙環[3.1.1]庚烷-3-基)吡啶-3-基]-6-羥基吡唑并[1,5-α]吡啶-3-腈(55)為起始物料,與1-溴-2-甲基-2-丙醇(56)在堿性試劑的作用下,進行醚化反應生成20,20 與5-甲酰基-2-甲氧基吡啶(57)在氰基硼氫化鈉的作用下發生還原氨化反應生成1。
該方法使用化合物55 作為起始物料,經二步反應制備化合物1,極大縮短了反應的歷程,提高反應的收率;該方法使用化合物56 替代原研路線中使用的化合物18,不僅規避了專利保護,也避免了高溫、高壓的危險反應。該方法具有路線短、總收率高、避免高危險性化學反應的優點,但同方法E 一樣,該方法生產成本較高。
5 方法G
方法G 是察略盛醫藥科技(上海)有限公司提交的PCT 國際專利申請WO2020177668A1[23]中所述的合成路線。該方法是以3-(4,4,5,5-四甲基-1,3,2-二氧硼雜環戊烷-2-基)-3,6-二氮雜雙環[3.1.1]庚烷-6-羧酸叔丁酯(58)為起始物料,與5-溴-2-碘吡啶(64)在鈀試劑和碳酸鉀的作用下發生N-烷基化反應生成3-(5-溴吡啶-2-基)-3,6-二氮雜雙環[3.1.1]庚烷-6-羧酸叔丁酯(59),59 在醋酸鉀及鈀試劑的作用下與聯硼酸頻那醇酯發生Miyaura 硼化反應生成{6-[6-(叔丁氧基羰基)-3,6-二氮雜雙環[3.1.1]庚烷-3-基]吡啶-3-基}硼酸(60),60 在鈀試劑和碳酸鈉的作用下,與31 發生Suzuki 偶聯反應生成19,后續反應按照方法A 中所述過程開展。
該方法的優點在于路線短和過程簡單,更加適合工業化生產的需求,缺點是多步反應中使用鈀試劑作為催化劑,且多步反應的后處理采用柱層析方式純化產物。綜上所述,該方法具有路線短、過程簡單、物料成本高和收率較低等特點,具有產業化的可能性。
6 結 論
本文綜述了采用5 種不同的起始物料、7 條不同的合成路線制備得到塞普替尼(1)的方法和過程。提出分別以3-溴-5-甲氧基吡啶(方法B)、3,5-二溴吡啶(方法D)和3-(4,4,5,5-四甲基-1,3,2-二氧硼雜環戊烷-2-基)-3,6-二氮雜雙環[3.1.1]庚烷-6-羧酸叔丁酯(方法G)為起始原料的3 條合成路線更具有工業化生產前景,與其他合成路線相比,該3 條合成路線的工藝原料易得,操作簡單,收率高,成本低。

