銅死亡相關(guān)miRNAs 在乳腺癌中的預(yù)后價(jià)值及與免疫微環(huán)境的關(guān)系
王藝馨,符德元
(1.揚(yáng)州大學(xué)醫(yī)學(xué)院,江蘇 揚(yáng)州 225000;2.蘇北人民醫(yī)院甲狀腺乳腺外科,江蘇 揚(yáng)州 225000)
乳腺癌(breast cancer,BC)仍是目前全球女性死亡的主要原因。隨著乳腺癌篩查和新治療策略的普及,患者5 年生存率已高達(dá)90%,然而其發(fā)病率及死亡率仍呈增長(zhǎng)趨勢(shì)[1,2]。并且由于乳腺癌的高度異質(zhì)性,具有相同亞型和TNM 分期也可出現(xiàn)截然不同的預(yù)后[3]。因而,急需尋找有潛力為乳腺癌患者早期發(fā)現(xiàn)、診斷、治療以及預(yù)測(cè)預(yù)后的新型生物標(biāo)志物。銅(Cu)是生物體所必需的微量金屬元素,而金屬離子過(guò)多或過(guò)少都會(huì)導(dǎo)致細(xì)胞死亡[4]。Tsvetkov P等[5]在研究攜帶銅離子的細(xì)胞死亡過(guò)程中發(fā)現(xiàn)了一種新的細(xì)胞死亡模式,涉及胞內(nèi)銅離子,并受其調(diào)節(jié),稱(chēng)為銅死亡(cuproptosis)。銅死亡是通過(guò)銅與三羧酸循環(huán)的脂酰化成分直接結(jié)合發(fā)生的,引起脂酰化蛋白質(zhì)聚集和隨后的鐵硫簇蛋白丟失,最終導(dǎo)致蛋白質(zhì)毒性應(yīng)激致細(xì)胞死亡。MicroRNAs(miRNAs)是一類(lèi)小的非編碼RNA 分子,通過(guò)降解mRNA 或抑制mRNA 翻譯成蛋白質(zhì)來(lái)調(diào)控廣泛的生物過(guò)程[6]。另外,研究發(fā)現(xiàn)miRNAs 可通過(guò)調(diào)節(jié)缺氧、鐵死亡等途徑參與癌癥的進(jìn)展、轉(zhuǎn)移和免疫治療反應(yīng)[7,8]。然而目前缺乏對(duì)乳腺癌中miRNAs 在銅死亡過(guò)程中的功能作用的研究,以及在預(yù)測(cè)乳腺癌患者預(yù)后中的作用。本研究構(gòu)建了銅死亡相關(guān)miRNAs 的預(yù)后模型,以評(píng)估其與乳腺癌患者預(yù)后關(guān)系,旨在為乳腺癌的早期診斷以及治療提供新的方向。
1 資料與方法
1.1 數(shù)據(jù)的獲取與處理 從TCGA-GDC 數(shù)據(jù)庫(kù)(https://portal.gdc.cancer.gov/)下載獲得乳腺癌患者完整的miRNA 數(shù)據(jù)和RNA-seq 數(shù)據(jù)以及臨床信息數(shù)據(jù),并通過(guò)Perl 軟件進(jìn)行數(shù)據(jù)整理。TCGA 數(shù)據(jù)庫(kù)向公眾免費(fèi)開(kāi)放,因此不需要額外的倫理證明。
1.2 銅死亡相關(guān)基因與miRNA 的篩選 通過(guò)R 軟件limma 包對(duì)銅死亡相關(guān)基因與miRNA 進(jìn)行Pearson相關(guān)性評(píng)估。若|r2|>0.3;P<0.001,則被認(rèn)為顯著相關(guān)。edgeR 包用于比較篩選腫瘤樣本和正常樣本之間的差異的mRNA 和銅死亡相關(guān)的差異的miRNA,過(guò)濾標(biāo)準(zhǔn)為FDR<0.05 和|log2FC|>1。
1.3 預(yù)后基因篩選及模型構(gòu)建 收集患者臨床資料,通過(guò)R 軟件survival 包對(duì)銅死亡相關(guān)差異表達(dá)基因行單因素Cox 分析得到預(yù)后相關(guān)基因(P<0.05),再行多因素Cox 分析。最終確定11 個(gè)用于模型構(gòu)建的對(duì)BC 預(yù)后有價(jià)值的銅死亡相關(guān)miRNAs(cuproptosis-related MicroRNAs,CRMs)。根據(jù)表達(dá)值及相應(yīng)系數(shù)計(jì)算風(fēng)險(xiǎn)評(píng)分。公式為:Risk score=coef(miRNA1)×expr(miRNA1)+(coefmiRNA2)×expr(miRNA2)+…+coef(miRNAn)×expr(miRNAn)。
1.4 預(yù)后風(fēng)險(xiǎn)模型評(píng)估及臨床價(jià)值分析 根據(jù)上述公式計(jì)算樣本風(fēng)險(xiǎn)值,以中位值為界將患者分為高風(fēng)險(xiǎn)組和低風(fēng)險(xiǎn)組并進(jìn)行生存差異分析,繪制K-M生存曲線(xiàn),1、3、5 年的受試者工作特征(receiver operating characteristic,ROC)曲線(xiàn),以及風(fēng)險(xiǎn)打分等評(píng)估該模型預(yù)后預(yù)測(cè)效能。利用單因素和多因素Cox分析評(píng)價(jià)風(fēng)險(xiǎn)評(píng)分能否作為預(yù)后因子。
1.5 靶基因預(yù)測(cè)及潛在功能分析 使用TargetScan[9]、miRDB[10]和miRTarBase[11]進(jìn)行miRNA 靶基因預(yù)測(cè)。為了探索CRMs 是否可能參與BC 的進(jìn)展,使用Perl 語(yǔ)言預(yù)測(cè)miRNA 的靶基因,將同時(shí)存在于兩個(gè)及以上數(shù)據(jù)庫(kù)中的基因定義為miRNA 的靶基因。將這些靶基因與差異表達(dá)基因取交集,采用KEGG 與GO 富集分析來(lái)揭示這些交集基因的潛在機(jī)制功能,P<0.05 認(rèn)為差異有統(tǒng)計(jì)學(xué)意義。
1.6 免疫微環(huán)境浸潤(rùn)相關(guān)分析 CIBERSORT 算法評(píng)估每個(gè)樣本中22 種免疫細(xì)胞在腫瘤微環(huán)境(Tumor microenvironment,TME)中的比例,P<0.05 過(guò)濾樣本。利用ssGSEA 算法對(duì)高低風(fēng)險(xiǎn)組每個(gè)樣本進(jìn)行免疫細(xì)胞、免疫功能和免疫檢查點(diǎn)的差異分析。
1.7 統(tǒng)計(jì)學(xué)方法 統(tǒng)計(jì)分析以及圖片可視化均由R軟件(4.1.2 版)進(jìn)行。統(tǒng)計(jì)顯著性定義為P<0.05,且所有P值均為雙尾。
2 結(jié)果
2.1 銅死亡相關(guān)基因與miRNAs 的篩選 通過(guò)R 軟件limma 包對(duì)19 個(gè)銅死亡基因與乳腺癌miRNA(腫瘤樣本1091 例,正常樣本103 例)進(jìn)行篩選,共得4242 個(gè)CRMs。隨后基于edgeR 包篩選出121 個(gè)銅死亡相關(guān)的差異表達(dá)miRNAs,同樣通過(guò)edgeR包對(duì)乳腺癌mRNA(腫瘤樣本1100 例,正常樣本112 例)進(jìn)行分析得到5882 個(gè)差異表達(dá)的mRNA。過(guò)濾標(biāo)準(zhǔn)為FDR<0.05 和|log2FC|>1。
2.2 預(yù)后基因的篩選及模型的構(gòu)建 經(jīng)單因素以及多因素Cox 分析(P<0.05),最終得到11 個(gè)有預(yù)后價(jià)值的CRMs 并以森林圖形式展示,見(jiàn)圖1。風(fēng)險(xiǎn)評(píng)分公 式:Risk score=(0.003935704×hsa-mir-592)+(0.021151117×hsa-mir-4501)+(0.13583739×hsamir -7974)+(0.291802054 ×hsa -mir -549a)+(0.061157431×hsa-mir-4675)+(-0.224946382×hsamir -4658)+(-0.062466584 ×hsa -mir -618)+(0.068830528×hsa-mir-1293)+(0.167058581×hsamir -466)+(0.01933156 ×hsa -mir -4533)+(0.019609619×hsa-mir-3923)。

圖1 個(gè)銅死亡相關(guān)miRNAs 的多因素Cox 分析森林
2.3 預(yù)后風(fēng)險(xiǎn)模型預(yù)測(cè)效能評(píng)估 對(duì)高、低風(fēng)險(xiǎn)組進(jìn)行生存差異分析,根據(jù)K-M 生存曲線(xiàn)、風(fēng)險(xiǎn)評(píng)分圖、生存狀態(tài)圖和風(fēng)險(xiǎn)熱圖的結(jié)果可知隨著風(fēng)險(xiǎn)評(píng)分增加,患者死亡率逐漸升高,高風(fēng)險(xiǎn)組患者OS 明顯低于低風(fēng)險(xiǎn)組,兩組存在顯著生存差異(P<0.001),風(fēng)險(xiǎn)評(píng)分對(duì)BC 患者預(yù)后有顯著影響,見(jiàn)圖2A~圖2D。并 且1、3、5 年生存結(jié)果AUC值分別為0.723、0.688、0.686,見(jiàn)圖2E,表明該模型具有良好的預(yù)測(cè)生存能力。對(duì)臨床特征與風(fēng)險(xiǎn)評(píng)分進(jìn)行單因素和多因素Cox 分析顯示年齡與風(fēng)險(xiǎn)評(píng)分是BC 患者的獨(dú)立預(yù)后因子,見(jiàn)圖2F、圖2G。最后將風(fēng)險(xiǎn)評(píng)分納入構(gòu)建生存列線(xiàn)圖,校準(zhǔn)曲線(xiàn)顯示預(yù)測(cè)概率與實(shí)際概率基本一致,見(jiàn)圖2H、圖2I。

圖2 乳腺癌銅死亡相關(guān)miRNAs 預(yù)后模型的構(gòu)建
2.4 功能分析 將預(yù)測(cè)的4625 個(gè)靶基因與5882 個(gè)差異表達(dá)mRNA 取交集獲得1264 個(gè)交集基因,對(duì)乳腺癌潛在功能進(jìn)行分析。KEGG 富集分析顯示,在癌癥中蛋白聚糖、Wnt 信號(hào)通路、癌癥中MicroRNAs、病毒致癌等多個(gè)癌癥相關(guān)通路富集,見(jiàn)圖3A。GO 富集分析,BP 提示基因在細(xì)胞生長(zhǎng)、細(xì)胞形態(tài)發(fā)生調(diào)節(jié)、細(xì)胞周期負(fù)調(diào)控、Wnt 信號(hào)通路等富集;CC提示基因在粘著斑、細(xì)胞基質(zhì)連接等過(guò)程富集,見(jiàn)圖3B;MF 提示基因調(diào)控特異性RNA 聚合酶IIDNA 結(jié)合轉(zhuǎn)錄因子結(jié)合、DNA 結(jié)合轉(zhuǎn)錄因子結(jié)合,見(jiàn)圖3C,表明大多數(shù)目標(biāo)靶基因都參與了癌癥相關(guān)通路,揭示CRMs 可能在BC 進(jìn)展中發(fā)揮重要作用。

圖3 乳腺癌相關(guān)靶基因的功能富集分析
2.5 免疫微環(huán)境浸潤(rùn)相關(guān)分析 進(jìn)一步探索與抗腫瘤免疫之間的關(guān)系,見(jiàn)圖4A、圖4B,兩組免疫細(xì)胞浸潤(rùn)存在差異,在低風(fēng)險(xiǎn)組中腫瘤浸潤(rùn)性CD8+T 細(xì)胞、幼稚B 細(xì)胞、漿細(xì)胞、靜息肥大細(xì)胞比例高于高風(fēng)險(xiǎn)組,而高風(fēng)險(xiǎn)組中M2 巨噬細(xì)胞、M0 巨噬細(xì)胞比例高于低風(fēng)險(xiǎn)組。另外,在免疫細(xì)胞評(píng)分中B 細(xì)胞、CD8+T 細(xì)胞、肥大細(xì)胞、NK 細(xì)胞、pDCs、Tfh、Th2 細(xì)胞、TIL 在低風(fēng)險(xiǎn)組中較高,見(jiàn)圖4C。在免疫功能評(píng)分中趨化因子受體、免疫檢查點(diǎn)、溶細(xì)胞活性、副炎癥、T 細(xì)胞共刺激以及Ⅰ型干擾素反應(yīng)、Ⅱ型干擾素反應(yīng)在高低風(fēng)險(xiǎn)組之間存在差異,見(jiàn)圖4D。并進(jìn)一步探討了高、低風(fēng)險(xiǎn)組免疫檢查點(diǎn)分子表達(dá)差異,共21 個(gè)差異表達(dá)的免疫檢查點(diǎn),常見(jiàn)的如PDCD1(PD-1)、CD274(PD-L1)、CD40、CD40LG和CD27 在低風(fēng)險(xiǎn)組中表達(dá)水平高于高風(fēng)險(xiǎn)組,見(jiàn)圖4E,這表明低風(fēng)險(xiǎn)組乳腺癌患者可能是免疫治療的候選者。
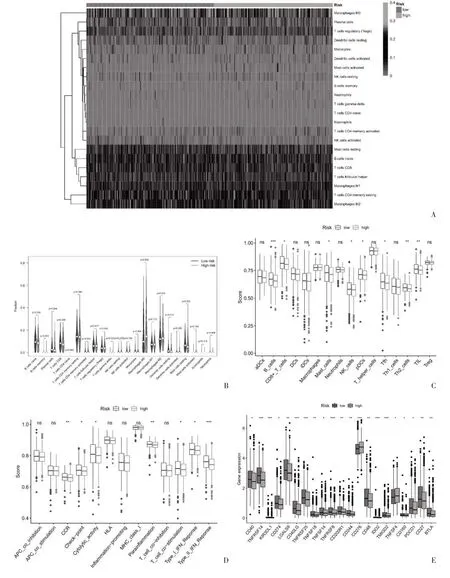
圖4 乳腺癌銅死亡相關(guān)miRNAs 免疫相關(guān)分析
3 討論
銅穩(wěn)態(tài)失衡會(huì)影響腫瘤細(xì)胞的生長(zhǎng)并誘導(dǎo)其死亡[12]。當(dāng)胞內(nèi)銅離子異常升高時(shí),離子載體將其轉(zhuǎn)運(yùn)到線(xiàn)粒體,直接與三羧酸循環(huán)的脂酰化成分結(jié)合致脂酰化蛋白積累和鐵硫簇蛋白丟失,導(dǎo)致蛋白毒性應(yīng)激致細(xì)胞死亡[5,13]。乳腺癌和卵巢癌組織中銅死亡關(guān)鍵基因FDX1 與酰化蛋白表達(dá)高度相關(guān),因而有希望利用靶向治療具有銅死亡這種代謝特征的腫瘤。
研究發(fā)現(xiàn)[14],銅死亡相關(guān)LncRNA 在預(yù)測(cè)乳腺癌預(yù)后和腫瘤免疫浸潤(rùn)等方面具有良好表現(xiàn)。本研究發(fā)現(xiàn)的11 個(gè)CRMs 中,大部分miRNAs 已有報(bào)道可作為腫瘤抑制因子或癌基因,其表達(dá)異常與乳腺癌等腫瘤的進(jìn)展密切相關(guān),影響患者生存預(yù)后。如hsa-miR-549a 可預(yù)測(cè)膠質(zhì)細(xì)胞瘤患者的預(yù)后[15]。而hsa-miR-446、hsa-miR-618 作為重要的腫瘤抑制因子,在抑制腫瘤細(xì)胞增殖、轉(zhuǎn)移、侵襲并誘導(dǎo)細(xì)胞凋亡方面發(fā)揮作用[16,17]。研究發(fā)現(xiàn)[18],hsa-miR-592 可靶向TGF-β 抑制乳腺癌細(xì)胞增殖、遷移和侵襲,但其在BC 組織和細(xì)胞系中表達(dá)顯著低于正常組織,與晚期臨床分期、遠(yuǎn)處轉(zhuǎn)移和淋巴結(jié)轉(zhuǎn)移有關(guān)。此外,hsa-miR-3923 可作為預(yù)測(cè)乳腺癌淋巴轉(zhuǎn)移的標(biāo)志物[19]。Takagawa Y 等[20]在小鼠模型中發(fā)現(xiàn)hsamiR-1293 能抑制腫瘤細(xì)胞生長(zhǎng),并揭示其與DNA損傷劑或放射療法的聯(lián)合使用可能對(duì)癌癥治療有效。hsa-miR-4501 可能參與結(jié)膜黑色素瘤的轉(zhuǎn)移擴(kuò)散[21]。因此,用于模型構(gòu)建的miRNAs 參與調(diào)控腫瘤的生長(zhǎng)、侵襲與轉(zhuǎn)移等。通過(guò)對(duì)KEGG 分析發(fā)現(xiàn)主要富集在癌癥中的蛋白聚糖、PI3K-AkT 信號(hào)通路等通路。蛋白聚糖是構(gòu)成乳腺微環(huán)境主要信號(hào)傳導(dǎo)和結(jié)構(gòu)成分的功能性蛋白質(zhì),在腫瘤進(jìn)展和轉(zhuǎn)移中發(fā)揮重要作用[22]。Guo J 等[23]研究發(fā)現(xiàn),銅激活PI3K-AKT 信號(hào)通路促進(jìn)乳腺腫瘤發(fā)生。使用TTM等銅螯合劑可有效抑制AKT 激酶活性,對(duì)抗過(guò)度活躍的AKT 驅(qū)動(dòng)的腫瘤,減弱致癌功能。因此,用于構(gòu)建模型的CRMs 參與調(diào)控腫瘤相關(guān)信號(hào)通路,為模型的臨床應(yīng)用提供了生物學(xué)的證據(jù)。
隨著免疫檢查點(diǎn)阻斷(ICB)療法的深入研究,抗PD-1/PD-L1 在乳腺癌治療中顯示出良好的臨床效果。ICB 的療效與TME 密切相關(guān),在具有較少浸潤(rùn)性細(xì)胞毒性T 細(xì)胞和較低PD-L1 表達(dá)的免疫“冷”腫瘤中較差[24]。而乳腺癌大多表現(xiàn)為免疫“冷”腫瘤[25]。若將免疫“冷”腫瘤轉(zhuǎn)化為免疫“熱”腫瘤可能會(huì)增強(qiáng)乳腺癌對(duì)ICB 治療的反應(yīng)。在本研究中,高風(fēng)險(xiǎn)組浸潤(rùn)的腫瘤殺傷免疫細(xì)胞CD8+T 細(xì)胞較少,而促進(jìn)腫瘤增殖和轉(zhuǎn)移的免疫細(xì)胞M2 巨噬細(xì)胞增加;并且高風(fēng)險(xiǎn)組在CD8+T 細(xì)胞、NK 細(xì)胞、pDCs、B 細(xì)胞、肥大細(xì)胞、Th2 細(xì)胞、濾泡輔助T 細(xì)胞等具有抗腫瘤免疫效應(yīng)的免疫細(xì)胞評(píng)分低于低風(fēng)險(xiǎn)組,與既往研究一致[26-28]。此外,低風(fēng)險(xiǎn)組患者中免疫檢查點(diǎn)PDCD1(PD-1)、CD274(PD-L1)、CD40、CD40LG 和CD27 表達(dá)水平較高。因而推測(cè)相較于BC 高風(fēng)險(xiǎn)組患者而言,低風(fēng)險(xiǎn)組患者表現(xiàn)出更強(qiáng)的抗腫瘤免疫效應(yīng),傾向于免疫“熱”,更可能受益于免疫檢查點(diǎn)抑制劑。這些發(fā)現(xiàn)表明CRMs 與TME 相關(guān),可用于靶向免疫治療。近來(lái)研究發(fā)現(xiàn)銅可調(diào)節(jié)癌細(xì)胞中PD-L1 表達(dá)發(fā)揮抗腫瘤免疫作用。Voli F 等[29]研究發(fā)現(xiàn),銅螯合劑TEPA 通過(guò)下調(diào)神經(jīng)母細(xì)胞瘤腫瘤中的PD-L1 來(lái)增強(qiáng)免疫細(xì)胞的腫瘤浸潤(rùn)并提高小鼠存活率。此外,研究還發(fā)現(xiàn)miRNA 可以調(diào)節(jié)免疫檢查點(diǎn),用于免疫治療。如hsa-miR-4759 可抑制PD-L1 表達(dá)并增加腫瘤組織中CD8+T 細(xì)胞浸潤(rùn),促進(jìn)BC 抗腫瘤免疫[30]。總之,據(jù)以往研究及本研究可推測(cè)CRMs 在免疫浸潤(rùn)方面發(fā)揮重要作用,可影響乳腺癌免疫狀態(tài),進(jìn)而影響腫瘤的進(jìn)展。為探索潛在的腫瘤靶向療法提供新思路。
綜上所述,CRMs 可能與乳腺癌發(fā)展有關(guān),并定義了一種新型預(yù)后模型,為乳腺癌預(yù)后預(yù)測(cè)及免疫學(xué)領(lǐng)域特征提供了見(jiàn)解。然而,本研究還存在一些不足。首先,本研究分析是對(duì)公共數(shù)據(jù)庫(kù)數(shù)據(jù)的二次分析,數(shù)據(jù)來(lái)源單一,且存在選擇偏倚,影響結(jié)果準(zhǔn)確性;其次,本研究對(duì)乳腺癌CRMs 的作用機(jī)制及與腫瘤免疫之間的潛在機(jī)制還需進(jìn)一步實(shí)驗(yàn)驗(yàn)證。

