我國中藥成方制劑與加拿大天然健康產品GMP 比較
林 林,朱詩宇,譚 勇,溫 博,魏嘉茵,馮小玉,夏玉文,王湘鵬,譚佳妮,楊龍會*
(1.中國中醫科學院中醫臨床基礎醫學研究所,北京 100700; 2.北京中醫藥大學管理學院,北京 100029;3.北京中醫藥大學中藥學院,北京 100029; 4.湘潭大學文學與新聞學院,湖南 湘潭 411105)
自21 世紀以來,中醫藥逐漸走出國門,并在國際上取得了一定影響力。加拿大作為積極引進針灸、中藥等中醫藥技術和產品的國家,將中藥納入天然健康產品的范疇中,使得中藥在當地發揮治療與保健的作用[1]。然而,因中藥存在藥味數量多、炮制復雜、成分多樣等特點[2],使得中藥在生產、加工及應用等流程都應當有專門的規定,以保證中藥的質量和療效。基于此,我國與加拿大均對中藥在生產、加工及應用方面制定了相應的規定,具體規定分別是我國的《藥品生產質量管理規范(2010 年修訂) 》 中藥制劑附錄(以下簡稱《附錄》 )[3]和加拿大《天然健康產品GMP (Good Manufacturing Practice) 指導文件》[4]。本文將以上2 份規定從中藥管理規范、框架和具體內容進行比較分析,以各部分的異同點來顯示兩國GMP 中對中藥管理的特點,以期能對我國中藥GMP 管理體系提供參考與建議。
1 兩國中藥產品管理法規概況
目前我國《附錄》 是由原國家食品藥品監督管理局于2011 年3 月1 日頒布施行。在文件中,中藥制劑附錄將中成藥與普通藥品進行區分,對中藥材、中藥提取物以及中成藥的生產質量管理做出了細致要求,在滿足GMP 主體文件的條件下進一步強調按照中藥材及中成藥的特點對產品進行約束,能夠有效地進行中成藥質量控制[5]。
加拿大衛生部則將中藥及相關制劑納入天然健康產品范圍進行管理。該范疇主要包括2020 年9 月28 日最新修訂的 《天然健康產品規范》 (Natural Health Product Regulation) 第三部分,同時衛生部還發布了這部分對應的解讀文件《天然健康產品GMP 指導文件》 (以下簡稱《指導文件》 )[6],由這2 份文件共同對天然健康產品的質量進行規范管理。由于加拿大當地對天然健康產品進行了專門的定義,并規定其管理貼近非處方藥但是不作為藥物來對待,因此對于中藥產品的生產質量管理方面與普通藥品的GMP 作出了區分[7]。
2 兩國中藥產品管理結構比較
我國《附錄》 共計十四個章節三百一十三條法規,包括范圍、原則、機構與人員等部分,主要特點是劃分中藥產品的類型,如中藥原材、中藥提取以及中藥制劑,針對不同類型的中藥產品規定了從該類型產品生產過程中的各組成要素出發,分析這些要素在生產階段的重要程度以及所發揮的作用[8],進而得出該類型中藥產品在生產全階段中應當注意的環節和可能存在的問題。
加拿大《指導文件》 全文包括概述、天然健康產品GMP 規范條例及其意圖與要求、參考文獻、術語表與附錄,同時《指導文件》 有較多介紹說明條目,提出要求詳細明確,部分以具體參數與限制條件作為證據示例,對于生產企業來說具有很強的參考性。《指導文件》 核心內容是第二部分,它對一般天然健康產品GMP 規范條例,包括場所、人員、過程、產品4 個章節,與我國《附錄》 相比邏輯與結構不協調。此外,《指導文件》 附錄1 對由多種有毒原料構成的順勢療法藥物GMP 進行補充,規定順勢療法藥物除了滿足第二部分GMP 的要求以外,還需要滿足附錄1 中的規定[9]。
3 兩國GMP 內容的比較
3.1 機構和人員的比較 在機構和人員方面,我國GMP在總體層面上要求生產企業應當建立與藥品生產相適應的管理機構并有相應的組織機構圖,企業可以根據自身需要設立不同的質量管理部門,一般包括質量保證和質量控制部門[10]。在具體人員職責設立上,各部門都應當配備相應資質和數量的管理和操作人員,同時明確規定各部門和各崗位的職責,文件中具體將生產活動中的關鍵人員分為企業負責人、生產管理負責人、質量管理負責人和質量受權人,各類人員具體的資質要求與重要職責見表1[11]。

表1 我國企業藥品生產關鍵人員的職責與資質要求
在滿足以上人員要求的基礎上,《附錄》 中還針對中藥材和中藥飲片的質量管理人員提出要求[12],首先要求企業的質量管理部門有專人來負責中藥材和中藥飲片的質量管理,具體的人員職責與資質要求見表2。

表2 我國企業中藥材和中藥飲片質量管理人員的職責與資質要求
加拿大《指導文件》 對機構沒有提出要求,人員設定與我國有區別,僅劃分為工作人員(生產、包裝、貼標、儲存) 與質量保證人員,突出了質量控制與保證在生產質量管理中的重要作用[13]。其中文件規定各崗位的工作人員要有滿足崗位的教育、培訓和經驗等條件,應當提供符合崗位描述的個人履歷或學歷、員工培訓計劃或出勤情況、完工證書等材料來證明。質量保證人員與我國GMP 中所提到的質量受權人相似,即把控各階段產品質量以及批準產品放行、撤回或轉售的重要質量控制人員,主要職責包括建立各項流程應當遵守的規范書面程序,同時確保每項程序都符合規范要求后再放行[14]。
比較發現,我國與加拿大均強調了對人員資質和工作職責的規定,對各類人員的工作職責與應具備的專業技能都做出了要求,但我國《附錄》 在中藥相關專業人員資質方面明確說明了相應的學歷與工作經驗要求,加拿大《指導文件》 則未明確說明。在對生產過程進行質量控制的方面,我國對于與中藥有關的生產質量管理人員的分類比加拿大更加具體且詳細,同時還有針對中藥材和中藥飲片方面的專業人才的要求,對中藥產品的生產、質量管理以及質量控制都要求有專門的工作人員來完成。
3.2 原材料與產品的比較 我國GMP 根據產品加工進度將原材料或產品分為原輔料、中間產品和待包裝產品、包裝材料、成品及特殊管理的原材料和產品等多個方面,并對其作出貯存、標識、后續操作等具體的要求。對于不合格的產品有明確規定,要求置放在固定且有明確標志的隔離區,且有相關質量管理人員批準處理的記錄[15]。同時我國在中藥材的種植、采集、炮制等方面有豐富的經驗,規定中有詳細的說明,如我國《附錄》 中第五章“物料” 對中藥材、中藥飲片以及中藥提取物的接收、儲存、養護、運輸都有嚴格的要求[16-17]。
加拿大《指導文件》 中沒有對中藥材提出特殊要求,但同樣根據加工進度將生產對象分為樣品、成品以及待包裝或待貼包括標的半成品,均在《指導文件》 GMP 內容的第四章“產品” 中闡述。可以看出《指導文件》 對這一章節的描述更偏向于對產品質量控制上的規定,文件中提到產品穩定性、純度檢測等產品質量控制檢測規范應當參考《天然健康產品質量指南》 來進行,確保企業有準確的測量規范體系來確保產品合格[18]。
對比發現,我國對中藥材管理涵蓋的內容全面,包括中藥原材料、中藥飲片以及中藥提取物,并且對每種類型的中藥都制定了相應的管理流程; 加拿大《指導文件》 中還未有像我國這樣明確劃分中藥的類型,而僅是將中藥作為一種天然健康產品從而制定了產品在不同階段相應的質量管理規范。
3.3 文件管理及內容的比較 我國《附錄》 將文件管理的內容放在文中的第六章進行統一闡述,要求在產品生產質量的控制過程中,要對生產工藝規程及相關標準、生產過程及質量管理情況都有相關的記錄文件。
加拿大《指導文件》 中也有關于文件記錄的相關要求,但是并沒有同我國《附錄》 中以獨立章節單獨列出,而是在場所、人員、過程、產品每個部分的規范或者規范解讀指南中相應提出。例如在對場所的GMP 要求證據示例中,“通風過濾器更換記錄” “每日溫度、相對濕度和光照(根據需要) 控制記錄” “與房屋維護相關的相關標準操作程序(SOPs) 和相關空白記錄模板” 等都是對文件管理的具體體現[19-20]。
比較發現,我國《附錄》 強調了中藥產品在生產過程中核對生產標準,并要對生產過程中的操作資料進行記錄,避免出現因生產失誤而導致的藥品安全問題,而加拿大《指導文件》 中除了對生產操作、產品記錄有所要求,有關場所、設備的條件約束也在規范或要求證據示例中有所闡述。
3.4 生產與衛生管理的比較 我國GMP 對于生產過程及衛生的管理體現在多個方面,分章節對人員衛生的要求、對廠房的清潔以及對設備的調試維護等進行闡述,均以最大限度地避免污染的原則做出了相應的規范,除了在我國GMP 正文中提出的對生產操作過程及工藝的控制以外[21],我國《附錄》 根據中藥材的特點在第七章“生產管理” 中提出了細致的要求,包括中藥材的揀選、整理、炮制等,同時要求中藥制劑在生產過程中要采取一系列措施來防止微生物的污染[22],具體內容見表3。
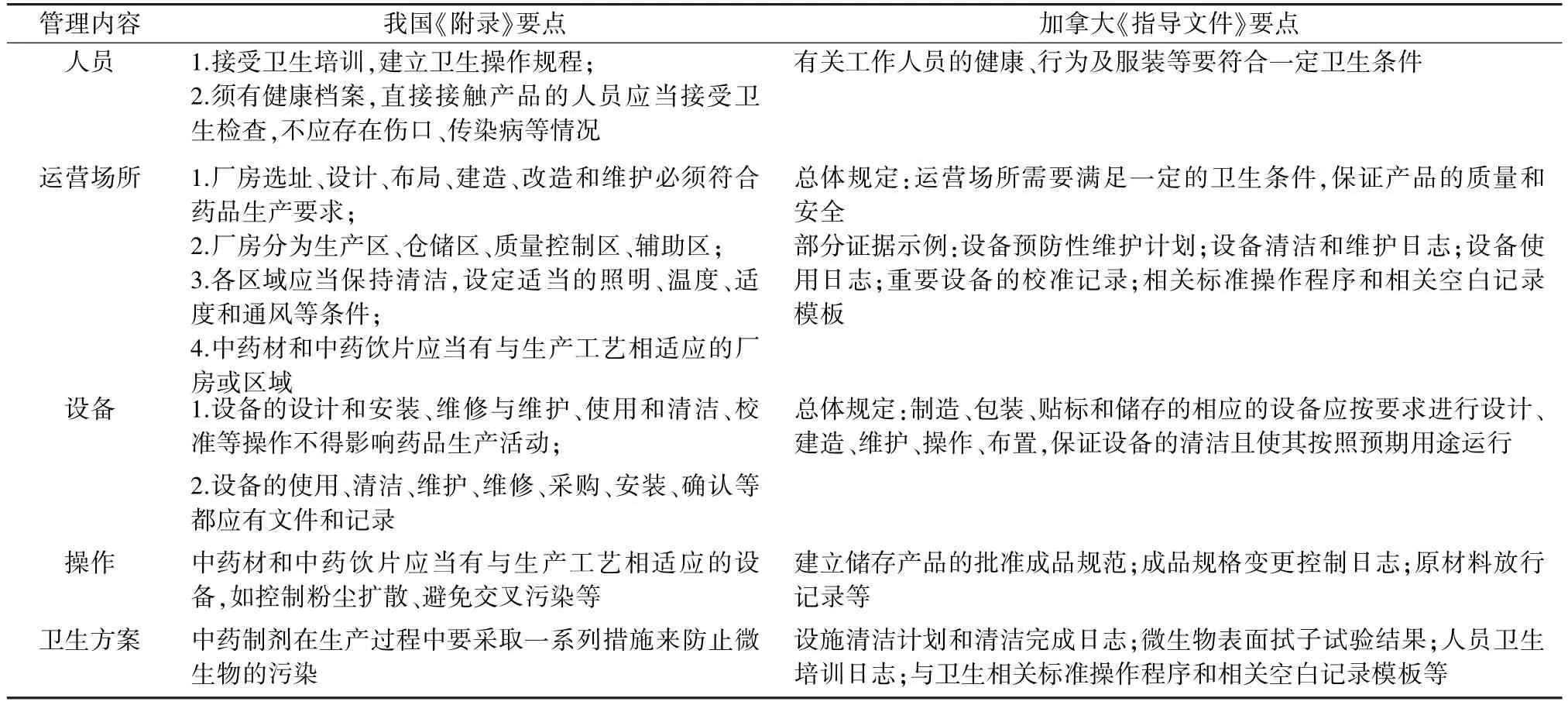
表3 我國與加拿大GMP 相關文件對生產與衛生要求對比
加拿大《指導文件》 中GMP 部分第一章對生產場所及設備提出要求,第三章從“過程” 衛生操作的角度集中對衛生方案與操作提出了要求,并建立可供問題產品迅速且完全地召回的控制系統,見表3。
兩者比較發現,我國GMP 及《附錄》 對中成藥產品的生產及衛生要求可以落實到生產的各個方面,從生產要素作為分類依據對人員、廠房、設備分別提出操作過程與衛生方面的要求,加拿大《指導文件》 則是將衛生方案單獨作為一個部分詳細說明,同時《指導文件》 更加強調對程序或記錄的標準化,反復提及某步驟或程序需要相應的空白記錄模板或運行計劃,一定程度上可以對生產進行事前控制,確保產品的質量與安全。
3.5 兩國風險管理內容的比較 對于中藥產品的風險管理,我國《附錄》 提出“應當根據科學知識及經驗對質量風險進行評估,以保證產品質量” “管理過程所采用的方法、措施、形式及形成的文件應當與存在風險的級別相適應”[23],此外并未有更多詳細介紹。加拿大《指導文件》作了分類概述,見圖1。

圖1 加拿大GMP 觀察風險分類概述
該文件以具體的風險管理分類協助產品的質量管理工作,通過風險等級直觀顯示產品生產質量合規程度,可作為產品場地許可證評估檢查或審計的依據,也能夠為企業提供參考。《指導文件》 涉及的場地、人員、過程、產品會影響產品質量風險分類,見圖2,按照偏離GMP 要求的性質以及偏離發生的次數與程度將風險分為三等。同時根據風險等級對產品的場地許可作出合規性評級,進而決定這一產品是否取得場地許可證。

圖2 加拿大GMP 風險管理評估流程
3.6 質量保證內容比較 我國《附錄》 在第二章對質量保證提出2 條規定,明確質量保證是質量管理體系的一部分,要求企業必須建立質量保證系統。質量保證系統規定藥品的設計與研發當體現我國GMP 要求,從原材料的采購和使用的原輔料以及包裝材料均需正確無誤。中間產品質量需要有效控制,生產管理和質量控制活動符合我國GMP 的要求,嚴格按照規程進行生產、檢查、檢驗和復核。生產出的每批產品需經質量受權人批準后方可放行; 最后按照自檢操作規程,定期檢查評估質量保證系統的有效性和適用性。加拿大GMP 文件中第51 節規定了質量保證人員的要求和責任。該文件要求制造商、包裝商、貼標商、進口商和經銷商應有質量保證人員,且需建立書面程序,以確保產品符合規范和法規要求。
對比發現,我國政策是對企業總體提出質量保證人員要求,側重點為藥品生產質量檢測合格與否,而加拿大要求每個制造商、包裝商和貼標商等都需要具備質量保證人員,即從藥品的生產到上市,到銷售均需要具備質量保證人員,并且由質量保證人員建立書面程序。加拿大在質量控制上比我國要求更嚴格,各個環節的分工更細致。
4 總結與展望
我國《附錄》 文件整體上對企業指導性不強,僅從宏觀層面闡述各階段要求,而加拿大《指導文件》 基于各項管理條例所列出的具體要求或參數、預計的證據示例等都細分到生產管理過程,可為企業提供自檢自查參考。
4.1 應提高我國GMP 規范的可參考性 目前我國暫無解讀GMP 的文件,企業沒有參考依據,因此出現違反GMP規定的現象。因此提升我國GMP 文件嘗試提供類似加拿大《指導文件》 中證據示例的參考列表,供企業進行自檢自查,能夠提前對可能存在的問題及時糾正,提升監管效率。
4.2 應幫助國外完善中藥制劑有關的GMP 規范 我國對于中藥制劑生產質量管理是從中成藥的特點出發,對中藥材、中藥提取物或中藥飲片的獲得、加工、儲存、生產等過程都有專業規定。而國際上大部分國家對中藥一系列規定都偏向于當做一般藥品的質量控制,未能根據中藥特殊性來制定針對性的質量控制舉措,難以保證中藥在當地的安全性與有效性。因此建議國家有關部門推動且幫助其他國家完善當地中藥制劑相關的GMP 規范,用符合中藥特色的方式衡量中藥產品的安全性和有效性,確保中成藥獲得國際認可。
4.3 形成標準化原則以管理藥品生產質量 加拿大《指導文件》 提出了較多類風險管理體系、產品召回控制系統以及各環節的標準操作程序,如果將這種標準化方式引入我國中藥生產質量管理工作中,就能使各環節管理工作形成一定的監管機制與標準程序。如此,一方面企業的生產質量管理工作可以規范開展,互相可以借鑒優秀經驗,實現行業內積極聯動; 另一方面也為相關部門的監管工作提供便利,標準化流程使得藥品工作環節中存在的問題更容易暴露,并且能及時與標準流程進行對照,便于監管主體對管理規范進行修改與完善。

