基于腸道菌群調控膽汁酸代謝途徑探討二氫楊梅素對肥胖小鼠的改善作用
李昀珊,李 景,夏世金,劉夢冉,冷清陽,李文毅,張宏利,李曉華?
(1.上海中醫藥大學附屬第七人民醫院內分泌科,上海 200137; 2.復旦大學附屬華東醫院上海市老年醫學研究所,上海 200040; 3.上海交通大學醫學院附屬同仁醫院內分泌科,上海 200336)
由于久坐的生活方式和高熱量飲食的攝入,肥胖已成為人類的主要健康問題[1]。預計2030 年全球超重和肥胖人數將達到10 億[2],因此預防和治療肥胖成為了全球亟待解決的公共衛生問題之一。民族特色藥材藤茶的原植物是顯齒蛇葡萄Ampelopsisgrossedentata(Hand.-Mazz.) W.T.Wang,二氫楊梅素是從藤茶中提取的活性最高的黃酮類化合物,課題組前期研究發現其能夠通過促進飲食誘導肥胖(diet-induced obesity,DIO) 小鼠的白色脂肪棕色化改善肥胖[3],但具體機制尚不清楚。
腸道微生物群和肥胖之間存在密切關聯[4-5]。有研究表明腸道菌群對宿主新陳代謝的調節是通過影響下游的活性代謝物實現的,其中膽汁酸為腸道菌群下游重要活性代謝物,其穩態由腸道菌群通過復雜的相互作用維持[6]。膽汁酸與腸道菌群通過腸肝循環相聯系,不僅參與脂質的消化和吸收,同時作為信號分子能夠激活下游信號通路參與宿主靶器官的調控。膽汁酸對能量穩態的調控主要是由法尼醇X 受體(farnesoid x receptor,FXR) 和G 蛋白偶聯受體5 (G protein-coupled receptor 5,TGR5) 介導[7]。
本研究通過16S rDNA 測序和膽汁酸靶向分析對DIO 小鼠腸道菌群組成和膽汁酸譜分別進行分析,并觀察二氫楊梅素干預后表型的變化,以期為二氫楊梅素改善肥胖提供實驗依據。
1 材料
1.1 動物 5 周齡無特定病原體(SPF) 的C57BL/6J 雄性小鼠購自上海斯萊克實驗動物有限責任公司[實驗動物生產許可證號SCXK (滬) 2022-0004],飼養于上海斯萊克實驗動物有限責任公司動物房 [實驗動物使用許可證號SCXK (滬) 2022-0001],飼養條件維持在室溫 (20±2)℃,相對濕度(50±10)%,標準12 h 黑暗和12 h 光照循環,自由進食、飲水。該動物研究由中國科學院上海實驗動物中心機構動物護理和使用委員會(IACUC) 審查和批準(倫理號20220215018)。
1.2 試劑與藥物 二氫楊梅素(純度98%,南京廣潤生物制品有限公司,批號GR-138-352418),使用0.5% 羧甲基纖維素鈉配制二氫楊梅素溶液。羧甲基纖維素鈉(上海生工生物工程技術服務有限公司,批號9004-32-4); UCP-1抗體(英國Abcam 公司,批號ab234430); TRIzol (美國Ambion 公司,批號15596026); 逆轉錄試劑盒、SYBR Green Realtime PCR Master Mix (日本ToYoBo 公司,批號031500、067600); 60%高脂飼料(美國Research Diets 公司,批號D12492); Omega Mag-bind soil DNA kit (美國Omega 公司,批號M5636-02); Quant-iT PicoGreen dsDNA Assay Kit (美國Invitrogen 公司,批號P7589); NovaSeq 6000 SP Reagent Kit (美國Illumina 公司,批號20040326)。甲醇、乙腈、甲酸(美國Thermo Fisher Scientific 公司,批號67-56-1、75-05-8、A456-4)。
1.3 儀器 BMJ-IB 型包埋機(天津天利航空機電有限公司); MRZ16F050 型高速冷凍離心機 (美國Beckman 公司); NC2000 型Nanodrop (美國Thermo Fisher Scientific 公司); A33186 型QuantStudioTM5 熒光定量PCR 儀、PCR 儀(美國ABI 公司); Eclipse Ci-L 型正置光學顯微鏡、DS-Fi2型成像系統(日本Nikon 公司); KF-PRO-120 型全景掃描儀(寧波江豐生物信息技術有限公司); 基因測序儀(美國Illumina 公司); FLX800T 型酶標儀 (美國BioTek 公司); EXion LC 型液相色譜儀(上海愛博才思分析儀器貿易有限公司); AB6500+型質譜儀(上海愛博才思分析儀器貿易有限公司)。
2 方法
2.1 肥胖小鼠模型構建 18 只小鼠在適應性喂養7 d 后,其中12 只小鼠按照課題組前期研究方法[3],采用60%高脂飼料(60.0%脂肪、19.4%蛋白質、20.6%碳水化合物,熱量5.0 kcal/g) 喂養小鼠11 周構建飲食誘導肥胖小鼠模型,即為造模組。
2.2 模型驗證 使用6 只普通飼料喂養的小鼠作為對照組。喂養11 周后,稱定小鼠體質量,高脂飼料喂養小鼠較普通飼料喂養小鼠體質量平均值增加20% 以上[8-9],判斷為模型構建成功。
2.3 藥物處理 將造模組小鼠隨機分為模型組和二氫楊梅素組,每組6 只,模型組灌胃給予0.5%羧甲基纖維素鈉溶液,二氫楊梅素組灌胃給予100 mg/kg 二氫楊梅素溶液,對照組灌胃給予純水,每天1 次,連續28 d,期間持續給予高脂飲食。
2.4 取材 給藥結束后,留取小鼠血清和糞便; 取腹股溝皮下脂肪(inguinal white adipose tissue,iWAT)、附睪脂肪(epididymal white adipose tissue,eWAT)、棕色脂肪(Brown adipose tissue,BAT) 并記錄質量,將少量iWAT 和BAT 置于4%多聚甲醛溶液中固定; 取少量肝臟和回腸組織,置于凍存管中凍存。
2.5 小鼠體質量、進食量、脂肪質量檢測 每周稱量小鼠體質量,計算體質量增加量,記錄進食量。給藥結束后,稱量iWAT、eWAT、BAT 質量。
2.6 免疫組化染色檢測脂肪組織UCP1 表達 脂肪組織石蠟切片60 ℃烤片1 h,后進行脫蠟水化,加入100 μL 過氧化氫處理,并在室溫下孵育10 min; 將切片放入熱抗原修復液中煮沸,室溫冷卻后加入100 μL 5%BSA 封閉液,在濕盒中孵育20 min; 去除血清,在組化筆劃定區域中加入50 μL 稀釋過的一抗,在濕盒中4 ℃孵育過夜; 次日清洗后加入50 μL 標記的二抗,37 ℃孵育30 min; 經DAB 顯色、復染、脫水、透化、固定后用中性樹脂封片,于顯微鏡下觀察。
2.7 16S rDNA 測序 微生物組總DNA 提取后,進行目標片段PCR 擴增,將PCR 擴增回收產物進行熒光定量,采用Illumina 公司的TruSeq Nano DNA LT Library Prep Kit 制備測序文庫,并對文庫進行質檢,最后采用Illumina MiSeq/NovaSeq 平臺進行雙端(Paired-end) 測序。測序的下機原始數據按照QIIME2 dada2 分析流程進行序列去噪然后對其進行聚類和后續的分析。
2.8 膽汁酸靶向分析 取出于-80 ℃超低溫冰箱保存的糞便和血清,隨后配制膽汁酸標準品,提取代謝物,上機進行色譜質譜檢測,對所有樣品進行定量分析。
2.9 RT-qPCR 法檢測肝臟和回腸組織膽汁酸代謝相關基因mRNA 表達 取出于-80 ℃超低溫冰箱保存的肝臟和回腸組織,分別稱取50 mg 組織加入1 mL TRIzol 進行組織勻漿,然后加入200 μL 氯仿,提取總RNA,使用逆轉錄試劑盒逆轉錄為cDNA,以cDNA 為模板進行熒光定量PCR 擴增。以β-actin為內參,采用2-ΔΔCT法計算相關基因mRNA表達。引物由上海尚亞生物科技有限公司合成,引物序列見表1。

表1 引物序列
2.10 統計學分析 通過GraphPad Prism 9.0 軟件進行處理,數據以(x±SE) 表示,兩組之間比較采用獨立樣本t檢驗,不符合正態分布使用U檢驗,方差不齊時使用校正t檢驗。P<0.05 表示差異有統計學意義。微生物相關分析使用QIIME2 (2019.4) 軟件進行。
3 結果
3.1 肥胖小鼠模型評價 如圖1 所示,60%高脂飼料喂養第二周開始,造模組小鼠體質量較對照組增加(P<0.01);喂養11 周后,造模組小鼠體質量高于對照組平均值20%以上,表明肥胖造模成功,造模結束時肥胖小鼠體質量為(40.2±0.86) g。

圖1 飲食誘導肥胖小鼠體質量情況(x±SE,n=6~12)
3.2 二氫楊梅素對肥胖小鼠體質量、進食量、脂肪質量和脂肪組織產熱的影響 藥物干預期間,二氫楊梅素組比模型組小鼠體質量增加緩慢,在干預結束的第28 天時,與模型組比較,二氫楊梅素組小鼠體質量增加量減少 (P<0.01),而小鼠食物攝入量無明顯變化(P>0.05),提示二氫楊梅素組小鼠體質量降低與攝食量無關,見圖2A ~2B。與模型組比較,二氫楊梅素組小鼠iWAT 和eWAT 質量減輕(P<0.05,P<0.01),BAT 質量無明顯變化(P>0.05),見圖2C。與模型組比較,二氫楊梅素組iWAT 和BAT 中的UCP1 表達增加,提示可能通過促進產熱脂肪活化減輕小鼠體質量,見圖2D。
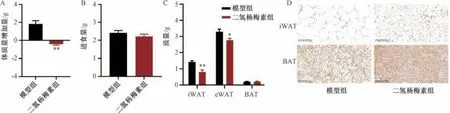
圖2 二氫楊梅素對肥胖小鼠體質量、進食量、脂肪質量和脂肪組織產熱的影響(x ±SE,n=6)
3.3 二氫楊梅素對肥胖小鼠腸道菌群的影響 通過Alpha多樣性分析,發現二氫楊梅素并沒有改變腸道菌群Alpha多樣性(P>0.05),見圖3A。群落的Beta 多樣性分析常用方法主坐標分析(PCoA) 結果可見,二氫楊梅素組和模型組分為2 個不同的簇,通過調用置換多元方差分析( permutational multivariate analysis of variance,PERM ANOVA) 法檢驗兩組之間的差異,發現差異有統計學意義(P<0.05),提示2 組小鼠腸道菌群結構有差異,見圖3B、表2。門水平物種分布前20 種見圖3C,屬水平物種分布前20 種見圖3D,在門分類水平上,厚壁菌門(Firmicutes) 與擬桿菌門(Bacteroidetes) (F/B) 比值降低被認為是腸道微生物區系的正常狀態,與模型組比較,二氫楊梅素處理后F/B 比值有下降趨勢,但無統計學差異(P>0.05); 在屬分類水平上,與模型組比較,二氫楊梅素組Adlercreutzia、Rikenella、Roseburia、Coprococcus相對豐度升高(P<0.01),Akkermansia相對豐度無明顯變化(P>0.05),見圖3E ~3F。為了進一步篩選差異物種,進行LefSe 分析,發現在二氫楊梅素組中能夠影響膽汁酸代謝的腸道菌群Streptococcus和Bacteroides顯著富集; 在模型組中,能夠影響膽汁酸代謝的腸道菌群Blautia顯著富集,見圖3G。

圖3 2 組小鼠腸道菌群分析(x ±SE,n=6)

表2 PERMANOVA 結果
3.4 二氫楊梅素對肥胖小鼠糞便膽汁酸譜的影響 與模型組比較,二氫楊梅素處理后糞便總膽汁酸水平呈升高趨勢,見圖4A。對不同類型膽汁酸進行統計后可見,與模型組比較,二氫楊梅素處理后結合型膽汁酸水平升高(P<0.01),見圖4B。對單一成分膽汁酸進行分析可見,與模型組比較,二氫楊梅素處理后牛磺-alpha-鼠膽酸 (Tauro-alphamuricholic acid sodium salt,T-alpha-MCA) 和牛磺-beta-鼠膽酸 (Tauro-beta-muricholic acid sodium salt,T-beta-MCA)(P<0.05,P<0.01) 水平升高,見圖4C。

圖4 2 組小鼠糞便膽汁酸水平分析(x±SE,n=5)
3.5 二氫楊梅素對肥胖小鼠血清膽汁酸譜的影響 與模型組比較,二氫楊梅素處理后血清總膽汁酸水平升高,見圖5A。對不同類型膽汁酸進行統計后發現,與模型組比較,二氫楊梅素組血清次級膽汁酸水平降低(P<0.05),初級膽汁酸和結合型膽汁酸有升高趨勢,但差異無統計學意義(P>0.05),見圖5B。對單一成分膽汁酸進行分析發現,與模型組比較,二氫楊梅素處理后TGR5 的內源性激動劑膽酸(cholic acid,CA)、鵝去氧膽酸(chenodeoxycholic acid,CDCA)、牛磺鵝去氧膽酸 (taurochenodeoxycholic acid,TCDCA)、牛磺膽酸(taurocholic acid Sodium Salt,TCA) 水平有升高趨勢,但差異無統計學意義(P>0.05),見圖5C。
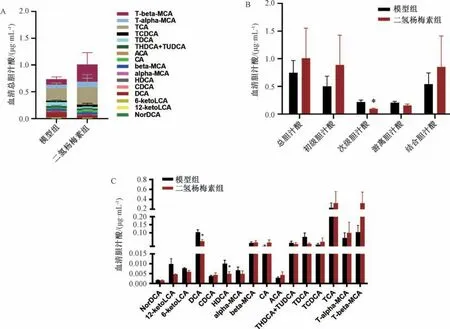
圖5 2 組小鼠血清膽汁酸水平分析(x ±SE,n=5)
3.6 二氫楊梅素對肥胖小鼠膽汁酸合成通路的影響 與模型組比較,二氫楊梅素處理后肝臟Cyp7a1 mRNA 表達上調(P<0.05),Fgfr4 mRNA 表達無明顯變化(P>0.05),回腸組織Fxr和Fgf15 mRNA 表達均下調(P<0.05),結果表明二氫楊梅素處理后FXR-FGF15 通路被抑制,見圖6。上文可見糞便膽汁酸中FXR 的抑制劑T-alpha-MCA 和T-beta-MCA 水平升高,提示二氫楊梅素干預后糞便膽汁酸中Talpha-MCA 和T-beta-MCA 水平的升高,進而抑制腸FXRFGF15 通路導致膽汁酸合成過程中重要的限速酶Cyp7a1 表達升高,促進血清膽汁酸水平的提高。

圖6 2 組小鼠Fxr、Fgf15、Fgfr4、Cyp7a1 mRNA 表達分析(x ±SE,n=5)
4 討論
本實驗發現二氫楊梅素能夠減少DIO 小鼠體質量增加,減輕脂肪質量,在治療肥胖中具有潛在價值。二氫楊梅素作為中藥活性成分具有口服生物利用度低且難以吸收入血的特點,進入腸道進行代謝后以糞便形式排出,導致其對體內靶標的直接激活不足,而是與腸道菌群接觸發生相互作用[10-11],所以腸道可能是其首先作用的器官。童慶[12]通過使用腸道菌群剔除和腸道菌群移植方式驗證二氫楊梅素對大鼠腸道菌群的調節作用是其防治肥胖的有效途徑。
腸道微生物區系是一個復雜的生態系統,肥胖和腸道微生物群之間具有密切而動態的聯系[13]。腸腔中的微生物種類繁多,其中Firmicute 和Bacteroidetes 占總數80% ~90%。Turnbaugh 等[5]發現,肥胖個體的腸道中Firmicutes與Bacteriodete 的比例增加。F/B 低比例被認為是腸道微生物區系的正常狀態,本研究發現二氫楊梅素干預后F/B 比值有下降趨勢。通過分析16S rDNA 測序結果,二氫楊梅素干預改變了部分與宿主代謝能力相關的微生物群豐度,增加了Adlercreutzia、Bacteroides相對豐度。Adlercreutzia被發現在糖脂代謝中發揮作用[14]; 有研究表明糖脂代謝紊亂小鼠中Adlercreutzia含量較低[15]。Bacteroides、Akkermansia相對豐度被報道與體脂量呈負相關[16-17]。近年來,Akkermansia被認為是治療代謝性疾病的益生菌,能夠發揮改善肥胖的作用[18]。然而本研究發現二氫楊梅素對Akkermansia相對豐度沒有明顯影響,這提示二氫楊梅素的減肥作用可能與Akkermansia無關,這也與文獻報道結果一致[19]。
腸道菌群被認為是人體不可或缺的“內分泌” 器官,能夠通過產生活性代謝物調節宿主新陳代謝,腸道菌群通過腸肝循環與膽汁酸聯系密切[20-21]。膽汁酸為膽汁的最主要成分,其在肝臟中由膽固醇為原料合成,與牛磺酸或甘氨酸結合后儲存在膽囊中,當受到食物刺激,初級結合型膽汁酸流進腸腔,腸道內菌群能發揮膽鹽水解酶(bile salt hydrolase,BSH) 的作用,使結合型膽汁酸變成游離型膽汁酸,隨后,腸道菌群對其進行脫羥基和脫氫等過程,促進向次級膽汁酸轉變,次級膽汁酸在回腸末端通過主被動運輸的方式經門靜脈系統重回肝臟完成腸肝循環[20]。由腸肝循環可見,腸道菌群的變化可導致膽汁酸譜的改變,其中腸道菌群對膽汁酸的修飾作用的第一步就是發揮BSH 的功能[22]。Bifidobacterium、Clostridium、Lactobacillus、Streptococcus、Bacteroide、Blautia具有BSH 功能[23]。本研究發現,二氫楊梅素組中Streptococcus(LDA score>2)、Bacteroides(LDA score>2) 顯著富集,模型組中Blautia(LDA score>4) 顯著富集,由于腸道菌群BSH 酶的活性并不取決于單一菌種而是與菌群總體BSH 活性有關[24]。根據Lefse 分析可見,模型組中Blautia的LDA score 大于4,二氫楊梅素組中Streptococcus、Bacteroide的LDA score 僅大于2,LDA score 反映不同組間差異物種的影響程度,其數值越大對應的菌群影響力越大。據此推斷,二氫楊梅素組中的BSH 活性可能低于模型組。并且由糞便膽汁酸靶向分析可見,二氫楊梅素干預后結合型膽汁酸水平升高,這可能與BSH 減少有關。
升高的結合型膽汁酸中T-alpha-MCA、T-beta-MCA 增加幅度較大,且二者為FXR 拮抗劑[21]。腸FXR-FGF15 通路是存在于腸肝循環中的一條負反饋途徑,能夠影響膽汁酸的合成,其發揮作用的途徑是在遠端回腸中,FXR 能夠誘導FGF15 表達,通過腸肝循環,使FGF15 進入肝臟; 在肝臟中,激活成纖維細胞生長因子受體4 (fibroblast growth factor receptor 4,FGFR4) 及其輔助受體B-klotho,形成FGFR4/B-klotho 復合物,隨后觸發JNK1/2、ERK1/2 信號聯級反應,抑制CYP7A1 的表達[7,20]。CYP7A1 為膽汁酸合成過程中重要限速酶,其表達下調能夠減少膽汁酸的合成。本研究發現二氫楊梅素干預后腸道Fxr、Fgf15 表達下調,CYP7a1 表達上調,促進膽汁酸的合成。
膽汁酸通過2 個主要的受體參與糖脂代謝調節,其中激活TGR5 受體能夠促進UCP1 的表達促進產熱改善肥胖,TGR5 在維持機體能量穩態中起到至關重要的作用[7],其促進UCP1 產生的機制主要是激活BAT 和促進iWAT 的棕色化。本研究發現二氫楊梅素能夠促進iWAT 和BAT 中UCP1的表達改善DIO 小鼠肥胖。文獻報道,某些游離型膽汁酸及其牛磺酸結合形式的膽汁酸(tauro Bile acids,TBAs) 能夠激活TGR5,且TBAs 對TGR5 激活效力更強[25-26]。CA、CDCA、TCA、TCDCA 被認為是TGR5 的內源性激動劑[7]。本研究發現,二氫楊梅素干預后 CA、CDCA、TCA、TCDCA 水平有升高趨勢。因此推測升高的膽汁酸可能通過門靜脈系統作為信號分子激活TGR5 進而促進棕色脂肪組織和腹股溝皮下脂肪組織UCP1 的產生。
綜上所述,本研究初步證明藤茶的活性單體二氫楊梅素能夠通過重塑腸道微生物區系使產生BSH 相關菌群的相對豐度降低,導致對膽汁酸的水解作用減弱,使糞便中牛磺酸結合型膽汁酸T-alpha-MCA 和T-beta-MCA 水平增加,抑制了回腸FXR-FGF15 信號通路,并上調肝臟CYP7A1 的表達促進膽汁酸合成進而改善肥胖。

