長波紫外線對人黑素瘤細胞中視蛋白3的表達及細胞增殖的影響*
張玉蕾, 曾雯, 張偉, 董仙, 馮江龍, 靳姝琦, 羅歡歡, 劉婷,陸洪光***
(1.貴州醫科大學 臨床醫學院 皮膚病與性病學教研室, 貴州 貴陽 550004; 2.貴州醫科大學附屬醫院 皮膚科, 貴州 貴陽 550004; 3.貴州醫科大學附屬醫院 病理科, 貴州 貴陽 550004)
惡性黑色素瘤是一種具有高度侵襲性的皮膚腫瘤[1],也是致死率最高的皮膚惡性腫瘤[1]。從2008—2018年全球惡性黑素瘤發病率增加了44%,死亡率上升了32%[2-3],2018年全球共有60 712人死于惡性黑素瘤[2]。目前認為惡性黑素瘤來源于失控的黑色素細胞增殖[1]。既往研究已證實,遺傳易感基因與環境暴露因素的相互作用是導致惡性黑素瘤發生、發展的關鍵因素,其中長期的紫外線暴露是誘發惡性黑素瘤的最重要原因[4]。目前認為,60%~70%的惡性黑色素瘤是由紫外線照射所致[4],長波紫外線(ultraviolet A, UVA)和短波紫外線(ultraviolet B, UVB)在惡性黑素瘤的發生中發揮了重要的作用[5],但到達地球表面的紫外線中UVA和UVB分別占90%~95%和5%~10%,紫外線誘發惡性黑素瘤主要通過直接和間接的脫氧核糖核酸(DNA)損傷所致[5-6]。UVA是否誘導間接DNA損傷發生的關鍵在于細胞能否感受UVA并及時轉換為熱能[4],真黑素可以將吸收的99.9%UVA轉化為熱能,從而避免DNA損傷發生[5],而UVA必須首先與內源性光敏劑(如卟啉、黑色素)反應,進而產生羥自由基和游離氧[7]。然而,這些光敏感分子的UVA吸收光譜是不同的[7],因此在UVA誘導惡性黑素瘤的發病過程中,感受UVA的細胞光敏感分子和蛋白發揮了關鍵的作用。細胞增殖是惡性黑素瘤的一個主要風險因素[8],在惡性黑素瘤的發生、發展及侵襲過程中發揮了關鍵的作用。UVA通過誘導癌基因包括B-Raf原癌基因,絲氨酸/蘇氨酸激酶(B-Raf proto-oncogene, serine/threonine kinase,BRAF)、神經母細胞瘤病毒癌基因 RAS 同系物(neuroblastoma RAS viral oncogene homolog, NRAS)、細胞周期蛋白依賴性激酶抑制因子 2A(cyclin dependent kinase inhibitor 2A,CDKN2A)等的突變、活性氧(ROS)產生及光老化相關基質金屬蛋白酶(MMP)的表達[9-10],促進細胞轉錄、翻譯和細胞分裂[8],從而促進黑素瘤細胞的增殖和侵襲。細胞如何感受UVA,啟動黑素瘤細胞的增殖,目前還有待進一步的研究。視蛋白3(opsin 3, OPN3)是人成纖維細胞感應UVA的光敏蛋白[11],參與肝癌細胞的耐藥[12],介導藍光誘導的結腸癌細胞自噬[13];既往研究報道證實,OPN3的表達與皮膚黑色素瘤及其他腫瘤發生和臨床預后之間存在一定關聯[14-15]。然而,OPN3是否介導UVA誘導的黑素瘤細胞增殖作用,迄今仍不清楚,本文擬檢測長波紫外線誘導OPN3在人黑素瘤細胞系(A375細胞和MV3細胞)的表達和對細胞增殖的影響,探討OPN3調控人黑素瘤細胞增殖的分子機制。
1 材料與方法
1.1 實驗材料
1.1.1細胞株 人黑素瘤細胞系A375(貨號BNCC352140)及人黑素瘤細胞系MV3細胞系(貨號BNCC339913)購自北京北納創聯生物技術研究院,經短串聯重復序列測序分析鑒定,A375及MV3 細胞不存在交叉污染,均為單一細胞系。

1.1.3主要試劑 抗體:兔抗人OPN3(貨號DF4877,中國affinity公司),兔抗人Hippo信號通路相關大腫瘤抑制激酶 1(large tumor suppressor 1,LATS1;貨號C66B5,美國Cell Signaling Technology公司),兔抗人磷酸化Yes相關蛋白(phospho-yes-associated protein, p-YAP;貨號D9W2I,美國Cell Signaling Technology公司),兔抗人ras 同系物家族成員 A(ras homolog family member A,RhoA;貨號67B9,美國Cell Signaling Technology公司),鼠抗人Yes相關蛋白(yes-associated protein, YAP;貨號sc-101199,美國Santa Cruz Biotechnology公司),鼠抗人GAPDH(貨號60004-1-Ig,中國武漢三鷹生物技術有限公司),辣根過氧化物酶(horseradish peroxidase, HRP)標記的山羊抗鼠單克隆二抗(貨號ab6789,英國Abcam公司)以及 HRP標記的山羊抗兔單克隆二抗(貨號ab6721,英國Abcam公司)。主要試劑盒:TRIzol(貨號15596026,美國Invitrogen公司),FastKing 一步法除基因組 cDNA 第一鏈合成預混試劑(貨號KR118,中國天根生化科技有限公司)、Talent熒光定量檢測試劑盒(貨號FP209,中國天根生化科技有限公司,);BeyoClickTM5-乙炔基-2′脫氧尿嘧啶核苷(5-ethynyl-2′-deoxyuridine,EdU)-594細胞增殖檢測試劑盒(貨號C0078S,中國上海碧云天生物技術有限公司),細胞增殖與活性檢測試劑(cell counting kit-8,CCK-8)試劑盒(貨號GK10001,中國GLPBIO公司),PierceTMECL Western Blotting Substrate(貨號32106,美國賽默飛公司)。其他試劑:高糖杜氏改良Eagle培養基(dulbecco's modified eagle medium,DMEM;美國 gibco公司,貨號C11995500BT)、胎牛血清(貨號10099141C,美國 Gibco 公司);青鏈霉素混合液(100×;貨號P1400,北京索萊寶有限公司)、苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)(100 mmol/L;貨號P0100,北京索萊寶有限公司)、高效放射免疫沉淀法緩沖液(radioimmunoprecipitation assay buffer,RIPA;貨號P0010,北京索萊寶公司)、免疫印跡法一抗稀釋液(貨號P0023A-100 mL,上海碧云天公司)、免疫印跡法二抗稀釋液(貨號P0023D-100 mL,上海碧云天公司);OPN1、OPN2、OPN3、OPN4、OPN5、GAPDH引物(上海生工生物工程股份有限公司)序列見表1。

表1 實時熒光定量PCR(real time quantitative PCR,RT-qPCR)序列Tab.1 RT-qPCR sequences
1.2 研究方法
1.2.1細胞培養 使用含10%胎牛血清及1%青鏈霉素的高糖DMEM培養基在37 ℃,5%CO2培養箱中培養A375、MV3細胞,隔日換液,細胞培養至80%~90%密度時使用含0.25%胰酶及0.01% EDTA的D-Hanks緩沖液消化傳代,取對數生長期細胞進行實驗。
1.2.2日光模擬器模擬UVA照射 將處于對數生長期的A375、MV3細胞使用胰酶消化鋪板,待細胞貼壁后進行日光模擬器模擬UVA進行照射,將細胞培養皿或培養板中的完全DMEM吸丟后換入預熱磷酸鹽緩沖液(PBS),使用光功率計測量照射強度,根據所需照射劑量計算照射時間(min)=[照射劑量(J/m2)]/(600×照射強度)。根據照射劑量將細胞分為Control組(0 J/m2)、UVA照射組(包括0.75×104、1.5×104、3×104、6×104及9×104J/m2)照射距離10 cm,電壓220 V,電流40 A。
1.2.3實時熒光定量 PCR(RT-qPCR)檢測 A375、MV3細胞OPN1、OPN2、OPN3、OPN4、OPN5 mRNA表達水平 TRIzol 法提取各組細胞總RNA,根據逆轉錄試劑盒說明書以42 ℃ 15 min,95℃ 3 min逆轉錄成cDNA,以cDNA 為模板進行RT-qPCR實驗。反應體系:SYBR Green Select Master Mix 6.25 μL,正反向引物各 0.4 μL,cDNA 1 μL,雙蒸水 4.45 μL。熒光定量PCR程序:95 ℃ 3 min;95 ℃ 5 s,55 ℃ 15 s,共40個循壞;繪制擴增曲線及溶解曲線。mRNA相對表達水平=2-ΔCT,以GAPDH為內參計算基因相對表達水平。
1.2.4EdU實驗檢測A375、MV3細胞增殖情況 將A375、MV3細胞按3×103個細胞/孔接種于96孔板,24 h待細胞貼壁后吸去培養基換磷酸鹽緩沖液(PBS),然后根據照射強度分組分別給予細胞0.75×104、1.5×104、3×104、6×104及9×104J/m2UVA輻照,輻照后將PBS更換為完全DMEM培養基繼續培養48 h后,每孔加入20 μmol/L EdU工作液,然后繼續培養2 h后,吸去培養基,PBS沖洗2次后用4%多聚甲醛固定細胞,去除固定液,每孔用100 μL含3% 牛血清白蛋白的PBS洗滌液洗滌細胞3次,每次5 min,去除洗滌液,每孔用100 μL含0.3% Triton-X 100的PBS室溫孵育15 min,去除通透液,每孔用洗滌液洗滌細胞3次,每次5 min,每孔加入Click反應液50 μL室溫避光孵育30 min,每孔用100 μL洗滌液洗滌細胞3次,每次5 min,Hoechst 33342 按1∶1 000稀釋,每孔50 μL,室溫避光孵育10 min,每孔用100 μL洗滌液洗滌細胞3次,每次5 min,后于熒光顯微鏡594 nm激發光下觀察及拍照,使用Image J軟件計算陽性細胞率。將過表達及沉默OPN3的A375、MV3細胞按6×103個細胞/孔接種于24孔板,待24 h細胞貼壁后吸去培養基換PBS沖洗2次,用4%多聚甲醛固定細胞,按上述方法進行后續操作。Merge圖像為紅色EdU陽性細胞及藍色Hoechst 33342染色細胞融合形成。計算細胞增殖率:紅色為EdU陽性細胞,藍色為Hoechst 33342染色細胞,增殖率為EdU陽性細胞與Hoechst 33342染色細胞的比率。
1.2.5CCK-8法檢測A375、MV3細胞增殖情況 將A375、MV3細胞按5×103個細胞/孔接種于96孔板,待24 h后細胞貼壁吸去培養基換PBS,然后進行細胞UVA輻照,劑量分別為0.75×104、1.5×104、3×104、6×104及9×104J/m2,輻照后將PBS更換為完全DMEM培養基繼續培養48 h后,每孔加入10 μL CCK-8 溶液,37 ℃ 5%CO2培養箱繼續培養2 h后,將樣本置入酶標儀中測量 450 nm 處的吸光度。將過表達及沉默OPN3的A375、MV3細胞按5×103個細胞/孔接種于96孔板,接種后0、24、48及72 h分別進行CCK-8法檢測,按上述方法進行后續操作。計算細胞存活率(%)= [(實驗孔吸光度-空白孔吸光度)/(對照孔吸光度-空白孔吸光度)]×100。
1.2.6免疫印跡法(Western blot )檢測LATS1、p-YAP、YAP、RhoA蛋白表達 用含 1 mmol/L PMSF 的RIPA裂解液冰上裂解細胞,在旋渦振蕩器上反復充分振蕩,冰上裂解30 min,4 ℃ 12 000 r/min離心15 min分離上清液至1.5 mL EP管中,于NanoDropTM2000/2000c分光光度計測蛋白濃度后,將30 μg蛋白樣品加入5×變性上樣緩沖液于100 ℃變性10 min。將蛋白樣品進行10%濃縮膠、 8%分離膠 SDS-PAGE 凝膠電泳并轉移到 PVDF 膜上,5%脫脂奶粉TBST緩沖液室溫封閉1 h后用一抗工作液(OPN3、LATS1、p-YAP、YAP、RhoA為1∶1 000稀釋,GAPDH為1∶10 000稀釋)4 ℃搖床慢搖孵育過夜,TBST洗膜4次,每次5 min,然后用相應的兔鼠二抗工作液室溫下搖床孵育 1 h,TBST洗膜6次,每次5 min。在PVDF膜上孵育發光底物,在bio-rad曝光成像系統檢測目的條帶,通過image J軟件分析各目的蛋白灰度值進行統計分析。目的蛋白相對表達水平=目的蛋白分析灰度值/GAPDH分析灰度值。
1.2.7小干擾RNA( small interfering RNA,siRNA) 轉染 特異性siRNA為上海權陽生物科技有限公司合成,siRNA-OPN3序列為5′-GUCACCUUUACCUUCGUGUTT-3′,對照序列為5′-UUCUCCGAACGUGUCA CGUTT-3′。SiRNA細胞轉染:將處于對數生長期的A375、MV3細胞以 3×104細胞/孔接種在 6 孔板中,次日當細胞貼壁并處于對數生長期時,使用 Lipofectamine 2000 轉染試劑協助siRNA轉染細胞,使用siRNA-NC和siRNA-OPN3(終濃度為30 nmol/L)將細胞分為si-NC組和si-OPN3組,其中si-NC組為使用siRNA-NC轉染的對照組,si-OPN3組為使用siRNA-OPN3的沉默OPN3組。在無血清的Opti-MEM 培養基中進行轉染后 6 h,將細胞培養基更改為含血清的培養基繼續培養 48 h,收取細胞進行Western Blot驗證OPN3是否成功沉默。
1.2.8慢病毒感染 OPN3特異性沉默慢病毒hU6-MCS-CBh-gcGFP-IRES-puromycin及過表達慢病毒Ubi-MCS-3FLAG-SV40-EGFP-IRES-puromycin由上海吉凱基因醫學科技股份有限公司合成。將MV3細胞按3×105個細胞/孔接種于12孔板內,12~16 h細胞進入對數生長期后進行分別加入過表達及沉默OPN3病毒液,根據MOI=10,計算加入病毒病毒體積(μL)=MOI×細胞數/病毒滴度×1 000,LV-NC、LV-RNAi-NC作為對照,過表達及沉默OPN3組分別為LV-OPN3組和LV-RNAi-OPN3組。轉染48 h后加入10 mg/ L嘌呤霉素繼續培養篩選穩定過表達及沉默黑素瘤細胞,于熒光顯微鏡下90%細胞可見綠色熒光后收取細胞進行Western Blot檢測OPN3的表達變化。
1.2.9篩選關鍵通路 構建過表達及沉默OPN3的MV3細胞系,通過qRT-PCR驗證后將樣本進行RNA-seq檢測,將過表達及沉默OPN3的交集差異基因的檢測結果進入David網站[DAVID Functional Annotation Bioinformatics Microarray Analysis (ncifcrf.gov)]進行KEGG數據庫分析,篩選P-adjust<0.05富集出相關信號通路進行后續驗證。
1.3 統計學分析
所有數據采用GraphPad Prism 9.3軟件進行統計分析,所有數據以均數表示,每組組間比較采用單因素方差分析,組間兩兩比較采用LSD-t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 UVA可誘導黑素瘤細胞發生增殖
將MV3、A375細胞暴露于0.75×104、1.5×104、3×104、6×104及9×104J/m2UVA輻射下48 h進行EdU實驗,結果如圖1所示。MV3細胞在1.5 ×104J/m2和3×104J/m2UVA輻照下細胞增殖率高于Control組,在6 ×104J/m2和9 ×104J/m2UVA輻照下細胞增殖率低于Control組,差異有統計學意義(P<0.05);在0.75×104J/m2UVA輻照下,細胞增殖率與Control組比較,差異無統計學意義(P>0.05)。A375細胞在0.75×104、1.5×104及3×104J/m2UVA輻照下,細胞增殖率高于對照,在9×104J/m2UVA輻照下細胞增殖率低于Control組,差異有統計學意義(P<0.05);在6×104J/m2UVA輻照下細胞增殖率與Control組比較,差異無統計學意義(P>0.05)。CCK-8法結果顯示,MV3細胞在1.5×104J/m2和3×104J/m2UVA照射后細胞存活率高于Control組,差異有統計學意義(P<0.05);A375細胞在1.5×104J/m2UVA照射后細胞存活率高于Control組,差異有統計學意義(P<0.05)。見圖1。提示黑素瘤細胞在適當UVA劑量照射后可發生增殖。

注:A、B分別為EdU檢測下不同劑量UVA照射后的細胞增殖情況和各組細胞增殖率統計,圖中紅色為EdU陽性細胞,藍色為Hoechst 33342染色細胞;C、D分別為CCK-8測定法檢測下不同UVA劑量照射后48 h的細胞存活率統計。(1)與Control組比較,P<0.05。
2.2 UVA促進黑素瘤細胞中OPN3的表達
qRT-PCR檢測結果(圖2)發現,在A375、MV3細胞系中OPN3 mRNA表達水平明顯高于其他OPN,差異有統計學意義(P<0. 05);MV3細胞在3×104J/m2照射劑量下OPN3表達增多(P<0.05),A375細胞在1.5×104J/m2和3×104J/m2UVA照射劑量下OPN3表達也增多,差異有統計學意義(P<0.05)。提提示OPN3在黑素瘤細胞中可能起重要作用,可能作為紫外線引起的黑素瘤細胞增殖的光感受器。
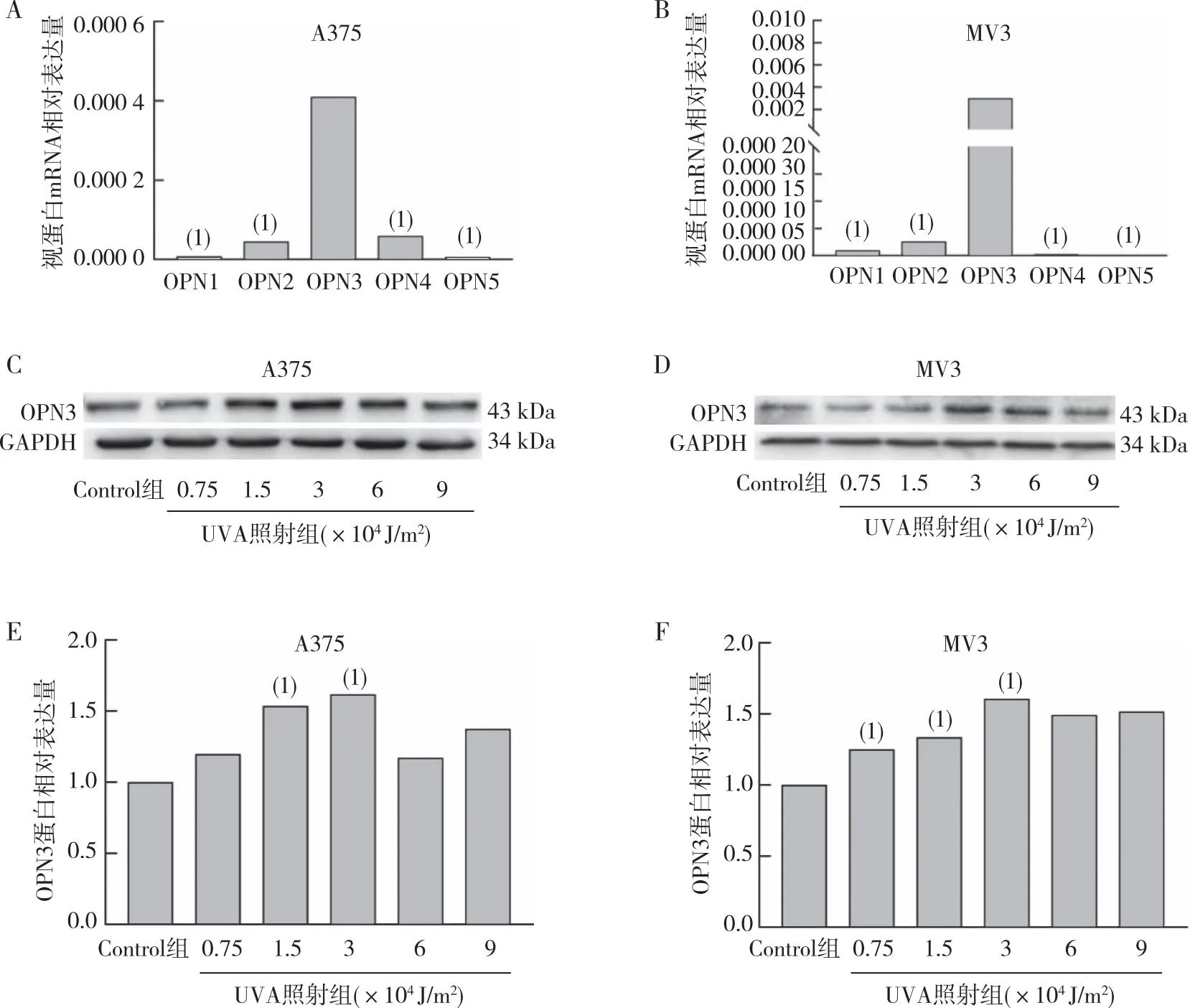
注:A、B分別為A375、MV3細胞中OPN1、OPN2、OPN3、OPN4及OPN5 mRNA相對表達量統計,(1)與OPN3相比,P<0.05;C、D分別為不同劑量UVA照射后細胞中OPN3蛋白的表達情況;E、F不同劑量UVA照射后細胞中OPN3蛋白的表達統計,(1)與Control組相比,P<0.05。
2.3 OPN3影響黑素瘤細胞的增殖功能
使用慢病毒感染構建過表達及沉默OPN3的穩轉MV3、A375細胞系,過表達及沉默OPN3后進行qRT-PCR及Western blot實驗,結果顯示如圖3所示,OPN3 mRNA和蛋白表達水平 與Control組比較有明顯差異,差異有統計學意義(P<0.05);提示成功過表達及沉默OPN3。過表達及沉默OPN3的穩轉株分別采用EdU實驗及CCK-8法檢測細胞的增殖率,可發現在EdU及CCK-8實驗中過表達OPN3的細胞株增殖率高于Control組,沉默OPN3的細胞株增殖率低于Control組,差異有統計學意義(P<0.05),見圖3。提示OPN3過表達及沉默可影響黑素瘤細胞的增殖功能。

注:A為通過RT-qPCR檢測OPN3 mRNA表達的過表達和沉默,B、C、D為蛋白質印跡法檢測OPN3蛋白表達的過表達和沉默;E、F為CCK-8測定法檢測過表達和沉默OPN3 后24、48及72 h的OD值;G、H分別為EdU實驗檢測下OPN3過表達和沉默后的增殖情況及對應增殖率統計;(1) 與LV-NC組比較,P<0.05;(2)與Si-NC組比較,P<0.05。
2.4 UVA通過OPN3引起細胞增殖
將成功沉默OPN3的A375、MV3細胞予3×104J/m2UVA照射后通過Western blot 檢測OPN3蛋白表達水平,發現在MV3細胞中LV-RNAi-OPN3組在UVA照射后OPN3蛋白表達水平增高,差異有統計學意義(P<0.05)。進行EdU實驗及CCK-8法檢測細胞的增殖率及存活率,發現A375、MV3細胞中LV-RNAi-OPN3組增殖率及存活率低于LV-RNAi-NC組細胞,差異有統計學意義(P<0.05);與LV-RNAi-NC組比較,LV-RNAi-NC+UVA 3×104J/m2組細胞增殖率及存活率增高,差異有統計學意義(P<0.05);與LV-RNAi-OPN3組比較,LV-RNAi-OPN3+UVA 3×104J/m2組細胞增殖率及存活率增高,差異有統計學意義(P<0.05),LV-RNAi-OPN3+UVA 3×104J/m2組增殖率及存活率低于LV-RNAi-NC+UVA 3×104J/m2組,差異有統計學意義(P<0.05)。見圖4。提示UVA通過OPN3引起細胞增殖。
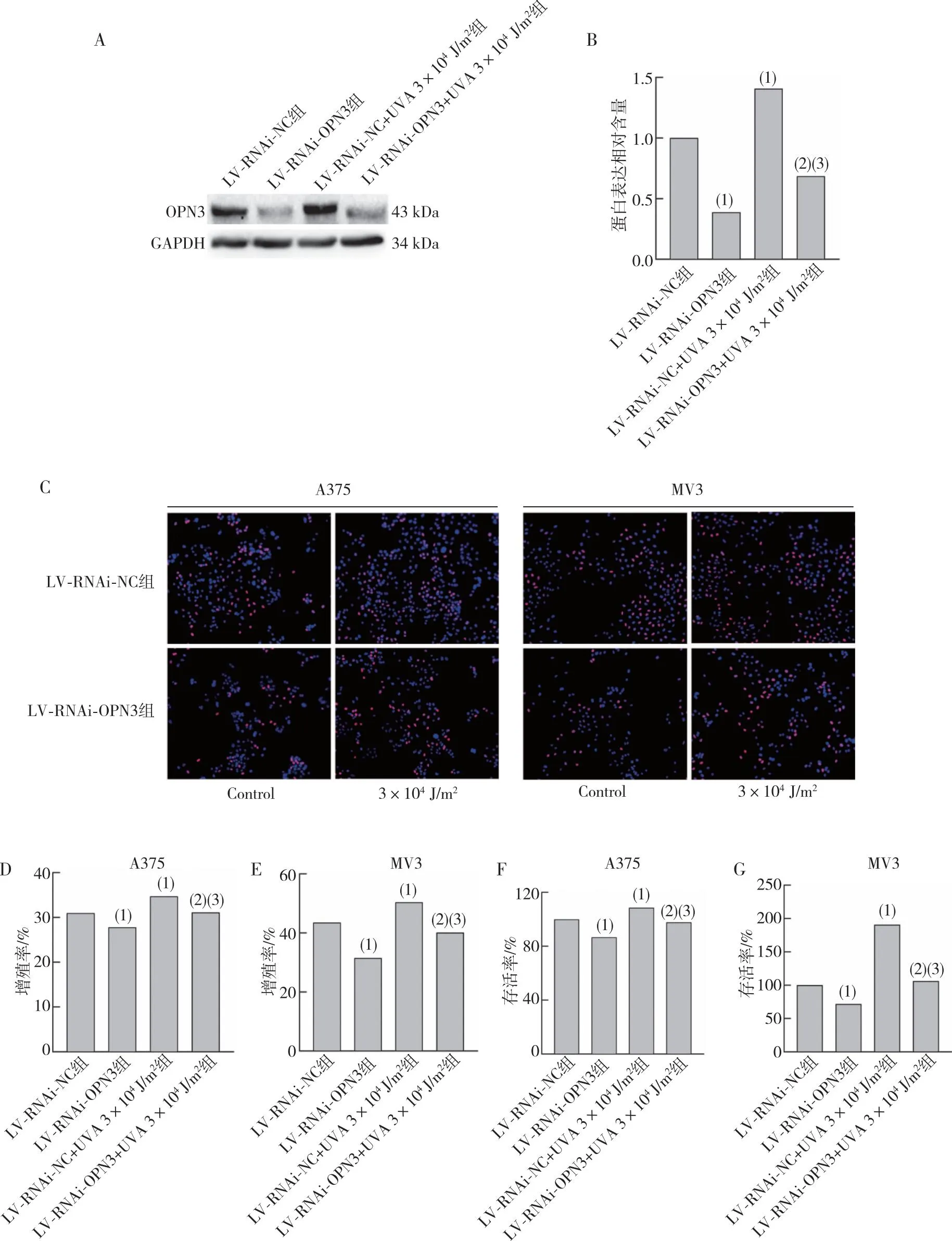
注:A、B為沉默OPN3的MV3細胞經過3×104 J/m2 UVA照射后OPN3蛋白表達水平及統計結果,C、D、E為A375、MV3細胞通過EdU實驗檢測沉默OPN3組細胞在經過3×104 J/m2 UVA照射后照射后的細胞增殖率及統計結果,F、G為使用CCK-8法檢測沉默OPN3組細胞在經過3×104 J/m2 UVA照射后的細胞存活率;(1) 與LV-RNAi-NC組比較,P<0.05;(2)與LV-RNAi-OPN3組比較,P<0.05;(3)與LV-RNAi-NC+UVA 3×104 J/m2組比較,P<0.05。
2.5 OPN3可影響Hippo通路調控細胞增殖
將MV3細胞分別過表達及沉默OPN3后進行RNA-seq測序,將數據進行交集分析可得到141個差異基因,將差異基因進入David網站進行KEGG分析,篩選P-adjust<0.05可以發現過表達及沉默差異基因富集出9條信號通路,其中-Log10(FDR)值最高的為Hippo信號通路,提示OPN3可能通過Hippo信號通路發揮作用。隨后分別在MV3、A375兩株細胞系中使用siRNA沉默OPN3,通過 Western blot 檢測了Hippo信號通路相關蛋白LATS1、p-YAP、YAP、RhoA的蛋白表達水平,與si-NC組相比,Si-OPN3 組中LATS1表達水平增高,p-YAP、RhoA表達水平降低,差異有統計學意義(P<0.05)。見圖5。
3 討論
既往研究表明紫外線輻射對黑色素瘤的發生、發展有著重要作用[16-17]。盡管長期以來人們都知道暴露于紫外線輻射是導致黑素瘤發生的最常見的原因,但紫外線輻射在黑素瘤進展中的確切作用仍然知之甚少,在分子、細胞及微環境水平上的研究還不夠[18]。既往研究證實,UVA主要通過細胞黏附喪失[19-21]、細胞外基質降解[23]以及皮膚微環境改變[16]等方式促進黑色素瘤的進展。OPNs是G蛋白偶聯受體超家族中的一員,最早在眼睛中被發現,其在視覺過程中的光轉導中發揮關鍵作用[24]。已經發現 OPN3 與皮膚黑色素瘤、肺癌、肝細胞癌的腫瘤發生和臨床預后之間密切相關[12-15]。近年研究也發現,OPN3可作為光感受器感受UVA誘導的人真皮成纖維細胞光老化[11],并且UVA可誘導黑素瘤細胞及結腸癌細胞在適當劑量下發生增殖[22],在本研究中也觀察到紫外線可誘導黑素瘤細胞發生增殖,但感受UVA引起細胞增殖的光感受器尚未報道。
黑素瘤轉移的兩個重要特征是增殖和侵襲[23]。Pastila等[21]表明,單次8 J/cm2UVA可照射誘導小鼠黑色素瘤細胞鈣黏蛋白E向鈣黏蛋白N轉換,導致其轉移能力增強[21]。Kamenisch等[23]證實,UVA照射通過增加乳酸鹽的生成直接上調黑素瘤細胞中的基質金屬蛋白酶,從而增強黑素瘤的侵襲。Bald等[16]證明,紫外線照射損傷的角質形成細胞,從而激活中性粒細胞釋放HMGB1,刺激黑色素瘤細胞向內皮細胞遷移和向血管浸潤。本研究結果闡明OPN3 的轉錄表達水平和蛋白質表達水平均明顯高于其他OPN,提示OPN3可能起重要作用。隨后參考上述報道的UVA輻照劑量,在本實驗中設置劑量梯度檢測不同劑量下黑素瘤的增殖情況,發現在A375、MV3細胞中進行1.5及3 cm/J2的UVA輻照劑量后細胞出現增殖,并且OPN3表達明顯增高,提示OPN3可能在UVA誘導的細胞增殖中起一定作用。
那么OPN3是否作為UVA光感受器直接參與黑素瘤細胞增殖過程有待進一步研究。既往研究證明,沉默OPN3的表達可影響人成纖維細胞、人血管內皮細胞的增殖功能[25-26];OPN3 的高表達與肢端雀斑樣黑色素瘤的轉移表型和預后不良有關,在此研究中來自同一患者的七個配對樣本顯示,OPN3表達隨著從原發性到腹股溝淋巴結轉移肢端雀斑黑色素瘤的進展而增加[14]。本研究通過過表達及沉默OPN3后可影響黑素瘤細胞的增殖能力,并且沉默OPN3后UVA引起細胞增殖的能力減弱。為進一步探討OPN3調控黑素瘤細胞增殖的具體機制,通過過表達及沉默MV3細胞進行RNA-seq測序結果篩選出141個差異基因, KEGG分析篩選差異基因富集信號通路9條,其中最主要的是Hippo信號通路。既往研究表明,G蛋白偶聯受體可以介導多種信號來調節Hippo 通路的活性[27]。本研究通過免疫印跡法檢測沉默OPN3后Hippo信號通路相關蛋白的變化,發現RhoA降低、LATS1增加、磷酸化蛋白p-YAP降低、YAP降低。既往研究表明,G蛋白偶聯受體可通過RhoA調節LATS激酶,從而調控YAP表達水平,YAP是Hippo通路下游關鍵的蛋白[28]。在小鼠中YAP的激活也會導致多種組織的過度增殖[29];YAP可促進黑色素瘤細胞侵襲和自發轉移,是體外黑色素瘤細胞侵襲的必要條件和充分條件[30]。總而言之,本次研究發現,抑制OPN3可調控RhoA誘導LATS1表達增加從而導致YAP減少,然而OPN3具體如何調節RhoA、LATS1以及影響YAP激活還值得進一步研究。
綜上所述,本研究提示在UVA照射A375和MV3細胞后OPN3蛋白表達水平明顯升高,細胞增殖能力明顯增強,而OPN3通過影響Hippo信號通路進而調節黑素瘤細胞的增殖功能, OPN3可能為黑素瘤的預防及治療提供新的生物靶點和臨床見解。

