骨質疏松癥影響股骨轉子間骨折PFNA術后髖關節恢復的研究
徐旭東 周永進 魏愛淳
股骨轉子間骨折是常見的髖部骨折類型,隨著老齡化加劇,其發病率呈逐漸增加趨勢[1]。一項前瞻性研究顯示,股骨轉子間骨折后半年和1年內患者的死亡率分別為7.6%和13.9%,盡早恢復患者下肢功能則可顯著降低死亡率[2]。骨質疏松癥是髖部骨折的重要危險因素,骨密度下降一個標準差,髖部骨折的風險增加1.5 ~2.5 倍[3]。對于骨質疏松癥是否會影響骨折臨床愈合尚無定論。但是Meta 分析發現,口服改善骨質疏松藥物及骨質疏松癥本身并不會影響骨折愈合的進程[4]。而動物研究則證實骨質疏松癥可延遲骨折的臨床愈合[5]。單純研究骨折愈合與骨質疏松癥的相關性臨床研究價值有限,因為抗骨質疏松藥物無論是對骨折或是骨質疏松癥的治療,終極目標均是恢復患者的肢體功能。但是,無論是臨床或實驗研究,均對骨質疏松癥影響骨折的研究較少涉及。因此,本研究以股骨轉子間骨折PFNA 術后患者為研究對象,分析骨質疏松癥能否對骨折愈合乃至骨折后肢體功能恢復產生影響,現報道如下。
1 資料與方法
1.1 一般資料
選取2021年1月1日—2022年9月1日在海安市中醫院骨傷科診斷為股骨轉子間骨折行股骨近端防旋髓內釘(proximal femoral nail antirotation,PFNA)手術并符合相關標準的115 例患者納入研究。納入標準:(1)符合《老年股骨轉子間骨折診療指南》[6]中單側股骨粗隆間骨折診斷標準,并能經過Evans-Jensen 準確分型且分型為ⅡA 及以上者。(2)采用股骨近端防旋髓內釘治療骨折。(3)年齡,男性≥50 歲,女性≥45 歲。(4)骨質疏松癥組患者術前經過雙能X 線吸收檢測法(dual energy X-ray absorptiometry,DXA)或定量超聲檢查明確為骨質疏松癥,即T 值<-2.5 或定量超聲顯示為骨質疏松癥。(5)根據醫囑及研究需求完成治療及隨訪者。(6)患者能夠自主獨立表達自身意愿并簽署書面知情同意書。排除標準:(1)車禍、墜落等外傷性骨折。(2)腎性骨病等病理因素導致的骨質疏松癥和骨質疏松性骨折者。(3)嚴重膝骨性關節炎等疾病影響下肢功能恢復者。(4)術中發生麻醉等手術意外事件者。(5)未能完成隨訪者。(6)其他不宜納入的情況。根據是否患有骨質疏松癥,分為對照組49 例與骨質疏松癥組66 例,2 組性別、年齡、身體質量指數(body mass index,BMI)、患髖、Evans-Jensen 分型、手術時間比較,差異無統計學意義(P>0.05),具有可比性。見表1。本研究經醫院倫理委員會批準。
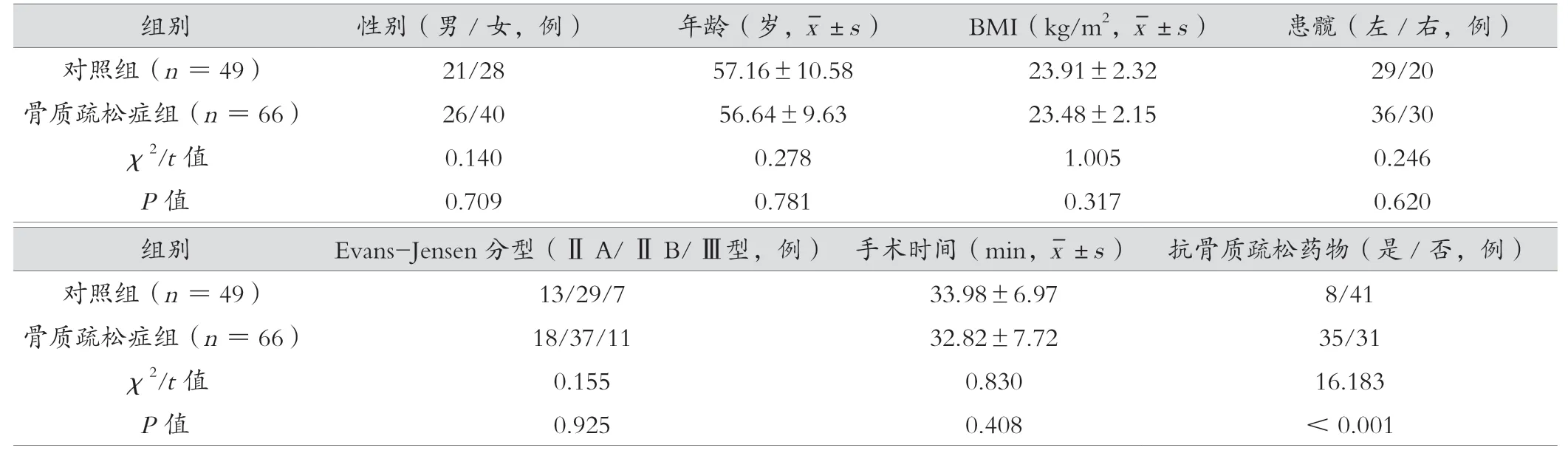
表1 骨質疏松癥組與對照組一般資料比較
1.2 方法
對照組和骨質疏松癥組患者均行PFNA 手術治療,手術方式及內固定材料均無差別。術后即指導患者行下肢功能鍛煉,具體包括:(1)術后1 d:股四頭肌等長收縮練習踝關節屈伸,每次30 次,早中晚各1 次。(2)術后2 d:患者躺臥位或坐在床邊行小腿及股四頭肌交替收縮主動直腿抬高和屈伸膝關節,每日練習30 min。(3)術后3 d 及出院后:借助步行器或扶墻開展步行鍛煉,爭取無支撐站立3 min 或無輔助雙下肢步行30 步。
1.3 觀察指標
通過電話隨訪和患者及家屬主動告知的形式記錄術后患者達到下肢骨折臨床愈合標準的時間。根據《中醫骨傷科學》[7]制定下肢骨折臨床愈合標準:無支撐站立3 min 且無輔助雙下肢步行至少30 步。術前記錄患者的性別、年齡、BMI 等一般資料;根據X 線及CT 檢查結果判斷并記錄患者的Evans-Jensen 分型;患者口服抗骨質疏松類藥物的標準為術前連續口服3 個月且期間中斷不超過1 周,該類患者可認定為是口服抗骨質疏松藥物,否則為否。查閱手術記錄記錄患者的手術時間。應用統計學計算患者下肢功能恢復的中位時間和95%可信區間(confidence interval,CI)并比較2 組下肢功能恢復時間差異;分析影響術后患者下肢功能恢復速度的因素。
1.4 統計學處理
采用SPSS 23.0 統計學軟件進行數據分析。計量資料以(±s)表示,組間比較采用獨立樣本均數t檢驗;計數資料以n(%)表示,采用χ2檢驗。以Kaplan-Meier 法計算術后患者下肢功能恢復的中位時間和95%CI,采用Breslow 和Log-Rank 法比較2 組下肢功能恢復時間差異;以術后下肢行走功能恢復為陽性事件,采用Cox 回歸分析影響術后患者下肢功能恢復速度的因素。多因素Cox回歸的數據處理包括:(1)年齡、BMI、手術時間作為數值型變量直接納入方程。(2)性別(男/女)、Evans-Jensen 分型(ⅡA、ⅡB、Ⅲ)、抗骨質疏松藥物則按照二分類或多分類變量以設置對照或啞變量的形式納入方程。檢驗水準α=0.05。
2 結果
術后對照組失訪2 例、骨質疏松癥組失訪1 例。以上數據作為刪失數據納入研究進行統計分析。
2.1 2 組髖關節功能恢復時間比較
對照組髖關節功能恢復中位時間為13.84 d,95%CI12.91 ~14.78 d;骨質疏松癥組髖關節功能恢復中位時間為16.94 d,95%CI15.99 ~17.89 d;差異有統計學意義(Breslow,χ2=18.52,P<0.001;Log-Rank,χ2=18.81,P<0.001)。見圖1。
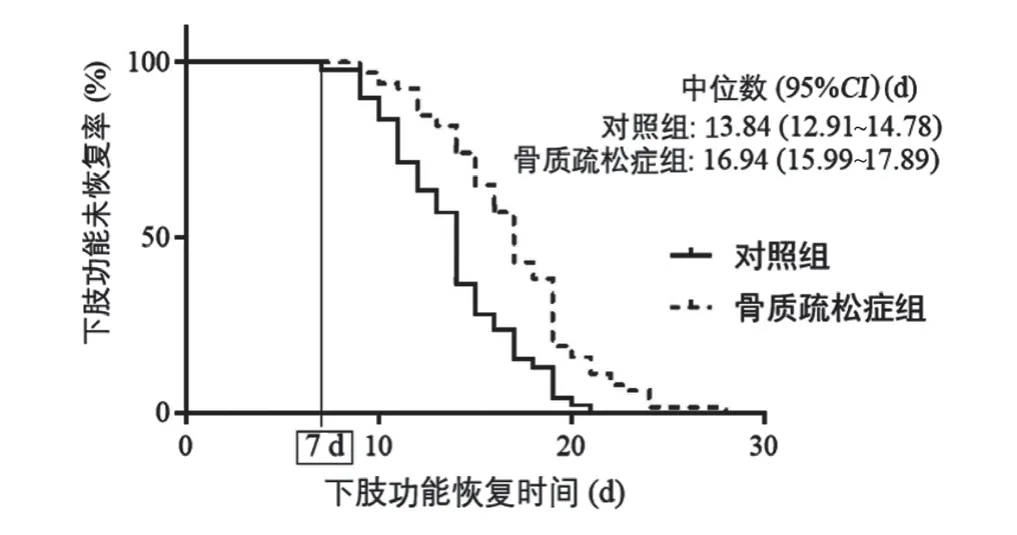
圖1 骨質疏松癥組與對照組下肢功能恢復時間比較
2.2 應用 Cox 回歸進行包括骨質疏松癥等影響股骨轉子間骨折 PFNA 術后患者髖關節功能恢復的因素分析
多因素Cox 比例風險模型發現手術時間對術后下肢功能恢復時間有影響(HR=0.072,95%CI0.034 ~0.151,P<0.001)。 相較于Evans-JensenⅡA 型骨折, ⅡB 型有影響(HR=0.195,95%CI0.166 ~0.326,P<0.001);Ⅲ型有影響(HR=0.073,95%CI0.033 ~0.152,P<0.001)。 骨質疏松癥對術后下肢功能恢復時間有影響(HR=0.265,95%CI0.172 ~0.410,P<0.001)。見表2。
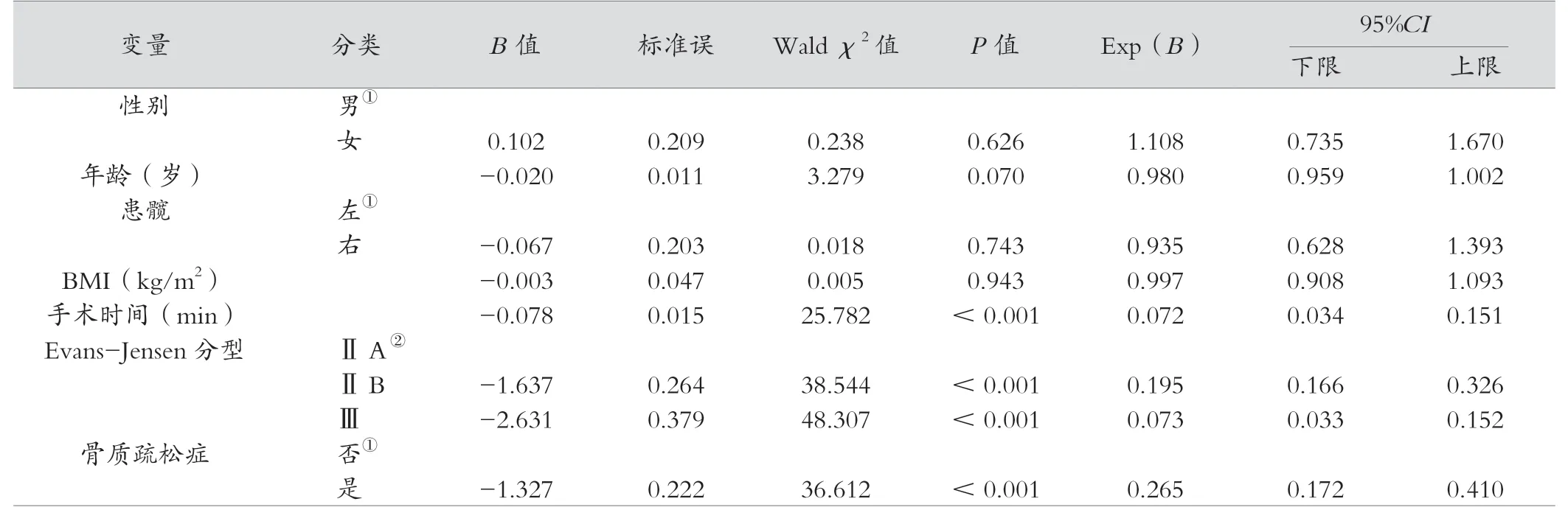
表2 應用Cox 回歸進行包括骨質疏松癥等影響股骨轉子間骨折PFNA 術后患者髖關節功能恢復的因素分析
2.3 口服抗骨質疏松藥物不影響股骨轉子間骨折PFNA術后患者髖關節功能的恢復
多因素Cox 比例風險模型發現手術時間對術后下肢功能恢復時間有影響(HR=0.072,95%CI0.034 ~0.151,P<0.001)。 相較于Evans-JensenⅡA 型骨折, ⅡB 型有影響(HR=0.279,95%CI0.170 ~0.457,P<0.001);Ⅲ型有影響(HR=0.121,95%CI0.060 ~0.243)。見表3。

表3 應用Cox 回歸進行包括口服抗骨質疏松藥物等影響股骨轉子間骨折PFNA 術后患者髖關節功能恢復的因素分析
3 討論
骨質疏松癥可顯著影響股骨轉子間骨折PFNA 術后患者髖關節功能的恢復時間,而口服抗骨質疏松類藥物則無影響。此外,手術時間、Evans-Jensen 分型均可影響術后下肢功能恢復。
骨質疏松癥主要分為原發性骨質疏松癥和繼發性骨質疏松癥,男性衰老退變和女性雌激素分泌降低主要導致原發性骨質疏松癥[8]。成骨細胞和破骨細胞“耦聯機制”動態失衡是骨質疏松癥發生的病理機制,促使骨代謝處于持續負平衡狀態[9]。組織生物力學研究發現骨質疏松癥的長管狀骨可發生輕微彎折和軸向扭轉,彎折和扭轉可進一步促進骨質疏松癥,形成骨質疏松-力學失衡-骨質疏松的惡性循環[10]。股骨粗隆作為髖關節力學傳導中樞,內固定術后功能鍛煉時受到的扭轉和剪切應力較大,骨質疏松癥時骨折部位受到的剪切應力進一步放大,導致骨折延遲愈合[11]。王小輝等[12]研究發現,股骨粗隆間骨折在PFNA 中心固定治療后也可能因功能鍛煉誘發局部應力增大而發生內固定周圍再骨折,繼而導致手術失敗。
研究發現相較于骨質疏松癥,抗骨質疏松藥物并不會影響骨折的臨床愈合時間。這與目前的研究具有部分一致性[13]。不同的地方在于本研究發現骨質疏松癥可影響骨折術后患者關節功能恢復時間。與上述涉及的文獻中研究對象未采用內固定治療骨折、限制骨折患者早期活動、未考慮骨質疏松癥和抗骨質疏松藥物存在交互效應等原因有關。動物研究則存在抗骨質疏松藥物過度使用,無法分辨在骨折造模后促進骨折愈合的因素是已被治療糾正的骨質疏松癥(正常的骨量)還是抗骨質疏松藥物本身。以上因素均導致了抗骨質疏松藥物和骨質疏松癥本身對骨折愈合影響不確定結論的獲得。
衰老激活腎素血管緊張素系統可誘發骨的滋養動脈發生狹窄和塌,導致骨細胞壞死誘發骨質疏松癥[14]。骨折則是對血管結構的進一步破壞。充足的血供是骨骼愈合的重要條件,相較于Evans-Jensen ⅡA 型骨折,ⅡB 和Ⅲ型骨折血供破壞的嚴重程度逐漸加重,相應的延遲了該類患者術后下肢功能的恢復時間。手術時間則可能更多地通過術中失血量、麻醉劑量等因素影響骨折術后下肢功能恢復時間[15]。
目前針對骨質疏松癥影響骨折愈合的研究包括了手術方式不統一、指導功能鍛煉未標準化等較多的混雜因素,因此無法獲得可靠的結論[16]。一項嚴格實施的動物研究發現,相較于正常小鼠,去卵巢模型小鼠骨折的早期愈合速度和晚期愈合率均較低,支持了本研究的觀點[17]。本研究以股骨粗隆間骨折患者為研究對象,且以成熟、創傷較小的PFNA 手術為干預方式,盡力降低外源性混雜因素對結果的影響。其次將骨質疏松癥患者和口服骨質疏松類藥物的患者通過亞組的方式分別納入方程構建模型,進一步避免了中介因素的干擾、嚴格規范統計流程,最終獲得了較為真實、可靠的結論。
綜上所述,骨質疏松癥可延緩股骨粗隆間骨折的臨床愈合時間,而抗骨質疏松藥物可能并無影響。

