ATPR通過促進自噬緩解脂多糖誘導的小鼠急性肝損傷
束傳林,施曉蕊,朱如夢,周 青,汪 淵,王 怡,朱華慶
脂多糖(lipopolysaccharide,LPS)是革蘭陰性細菌細胞壁外壁的組成成分,是膿毒血癥的主要誘因。在臨床上膿毒血癥合并肝損傷是較常見的急危重癥之一,是膿毒血癥導致多器官功能障礙的一種表現形式[1]。自噬普遍發生于真核生物體內,是細胞通過溶酶體降解自身組分,以達到維持細胞內正常生理活動及穩態的一種細胞代謝過程。自噬小體是自噬形成的標志性物質,內容物為線粒體、內質網、糖原或其他細胞器及細胞質成分。細胞通過自噬將胞內的受損細胞器及異常大分子物質包裹并運輸至溶酶體進行降解,保護肝臟細胞免受損害,維持細胞內營養物質代謝平衡及能量供應[2]。此外,最近的研究[3]表明,自噬的變化是各種肝臟疾病的基礎,包括脂肪肝、脂肪變性、病毒性肝炎、藥物或缺血再灌注誘導的肝損傷等。
全反式維甲酸(all-trans retinoic acid, ATRA)是維生素A的天然代謝產物,作為一種新型抗炎藥物,在膿毒血癥治療中可以減少促炎細胞因子的產生[4]。4-氨基-2-三氟甲基苯基維甲酸酯(4-amino-2-trifluoromethyl-phenyl retinate, ATPR)是以ATRA為基礎設計合成的新型維甲酸衍生物,表現出比ATRA更好的溶解性[5]。該實驗以C57BL/6小鼠為研究對象,腹腔注射LPS造急性肝損傷模型,探究ATPR緩解小鼠急性肝損傷的機制。
1 材料與方法
1.1 材料
1.1.1實驗動物 15只6周齡的C57BL/6雄性小鼠購自江蘇集萃藥康生物科技股份有限公司,于安徽醫科大學實驗動物中心SPF級環境中飼養,環境溫度(20±2) ℃,濕度40%~70%,12 h光照12 h黑暗交替。所有實驗動物的飼養與操作均符合安徽省實驗動物中心管理飼養條例[實驗動物使用許可證編號:SYXK(皖)2020-001,生產許可證編號:SCXK(蘇)2018-0008,倫理批號:LLSC20210825]。
1.1.2實驗試劑 4%的戊巴比妥鈉由安徽醫科大學實驗動物中心提供;LPS購自美國Sigma公司;ATPR由安徽醫科大學藥學院合成;聚氧乙烯蓖麻油、2.5%戊二醛固定液(電鏡專用)購自上海源葉生物科技有限公司;多聚甲醛溶液、蛋白上樣緩沖液購自北京蘭杰柯科技有限公司;轉氨酶檢測試劑盒購自南京建成生物工程研究所;TRNzol Universal總RNA提取試劑購自北京天根生化科技有限公司;逆轉錄試劑盒、qPCR試劑盒購自上海新貝生物科技有限公司;RIPA裂解液、蛋白酶抑制劑購自上海碧云天生物技術有限公司;anti-LC3B、anti-P62、anti-Beclin1抗體、anti-FUNDC1抗體購自美國Cell Signaling Technology公司;anti-ATG5抗體、anti-OPA1抗體購自上海Abmart公司;anti-GAPDH抗體購自武漢三鷹生物技術有限公司;山羊抗兔IgG-HRP、山羊抗小鼠IgG-HRP購自美國Santa Cruz公司。
1.1.3實驗儀器 酶標儀、高速低溫離心機購自美國Thermo Fisher Scientific公司;正置生物顯微鏡購自德國Leica公司;透射電子顯微鏡Talos L120C G2、化學發光凝膠成像分析系統ChemiDocTMTouch Imaging System購自美國Bio-Rad公司;-80 ℃超低溫冰箱購自日本SANYO電器股份有限公司; pH儀購自上海雷磁儀器廠;磁力攪拌器購自北京中興偉業儀器有限公司;電泳儀、電泳槽購自北京六一儀器廠。
1.2 方法
1.2.1動物模型建立 15只C57BL/6雄性小鼠適應性飼養1周,體質量(22±2)g,隨機分成3組:正常組、模型組、ATPR組,每組5只。ATPR組腹腔注射ATPR 15 mg/(kg·d),正常組、模型組腹腔注射等體積的0.9% NaCl溶液(含25%聚氧乙烯蓖麻油),連續7 d進行以上操作,第8天模型組、ATPR組腹腔注射LPS 6 mg/kg,6 h后處死所有小鼠。
1.2.2動物樣本獲取及處理 使用4%的戊巴比妥鈉麻醉小鼠,眼球取血后處死小鼠,迅速取出肝臟組織,使用鋒利刀片切取長條狀,在2.5%戊二醛固定液里切成1 mm3以內小塊,與2.5%戊二醛固定液一起置于4 ℃冰箱中固定;余下組織用預冷PBS溶液漂洗干凈后分成兩部分,一部分液氮急速冷凍后置于-80 ℃冰箱保存待用,另一部分置于多聚甲醛中固定后進行石蠟包埋。取出的血液4 ℃靜置2 h后3 000 r/min離心10 min,收取血清置于-20 ℃冰箱待用。
1.2.3谷丙轉氨酶(alanine aminotransferase, ALT)和谷草轉氨酶(aspartate aminotransferase, AST)檢測 收取的血清嚴格按照試劑盒說明書步驟操作,酶標儀讀取吸光度,根據標準曲線計算轉氨酶含量。
1.2.4qPCR 稱取肝臟組織加入TRNzol進行研磨,參考RNA提取試劑說明書得到總RNA,使用分光光度計測量純度和含量。按照逆轉錄和qPCR試劑盒的說明書分別進行逆轉錄和qPCR,計算小鼠肝臟組織炎癥因子白細胞介素-6 (interleukin-6,IL-6)、腫瘤壞死因子(tumor necrosis factor-alpha,TNF-α)的相對表達水平。引物序列如下:IL-6(F: 5′-CTGCAAGAGACTTCCATCCAG-3′,R: 5′-AGTGGTA-TAGACAGGTCTGTTGG-3′);TNF-α(F: 5′-CCTGTA-GCCCACGTCGTAG-3′,R: 5′-GGGAGTAGACAAGG-TACAACCC-3′);GAPDH(F:5′-TGGCCTTCCGTGTTCCTAC-3′,R:5′- GAGTTGCTGTTGAAGTCGCA-3′)。
1.2.5蘇木精-伊紅(HE)染色 組織蠟塊切片脫蠟后,按常規方法進行HE染色,使用正置顯微鏡拍照并保存。
1.2.6透射電子顯微鏡(transmission electron microscope,TEM)觀察小鼠肝細胞超微結構 已固定的肝臟組織送往安徽醫科大學科研實驗中心,按照TEM生物樣品制備的基本步驟制樣,TEM下觀察肝細胞超微結構,選取合適視野拍照并保存。
1.2.7Western blot檢測蛋白表達 取出-80 ℃冰箱保存的肝臟組織,剪取一部分稱重后轉入研磨器中,每0.1 g 組織加入1 ml RIPA裂解液(含1 mmol/L蛋白酶抑制劑),置于冰上研磨并使之充分裂解后,14 000 r/min離心30 min取上清液,采用BCA法測定蛋白濃度,樣本加入蛋白上樣緩沖液后沸水中煮10 min使蛋白變性,冰上降溫后分裝并置于-80 ℃冰箱待用。配制12% SDS-PAGE膠,按照每個泳道蛋白總量為10 μg上樣,電泳完成后在轉移液中將凝膠上的蛋白轉移至PVDF膜上,含5%脫脂奶粉的TBST封閉PVDF膜2 h。使用TBST洗滌條帶3次,再使用TBS洗滌條帶1次后切膜,按照條帶位置置于Anti-LC3B(1 ∶1 000)、Anti-P62(1 ∶1 000)、Anti-Beclin1(1 ∶1 000)、Anti-ATG5(1 ∶1 000)、Anti-FUNDC1(1 ∶1 000)、Anti-OPA1(1 ∶1 000)、Anti-GAPDH(1 ∶2 000)抗體中,4 ℃冰箱孵育12~18 h。使用TBST洗滌條帶3次,再使用TBS洗滌條帶1次,室溫孵育二抗羊抗兔(1 ∶5 000)或羊抗鼠(1 ∶3 000)2 h。使用TBST洗滌條帶3次,再使用TBS洗滌條帶1次,使用ECL發光試劑顯影。使用ImageJ軟件計算各條帶灰度值,GAPDH為內參。

2 結果
2.1 ATPR對LPS損傷的小鼠血清ALT和AST的影響與正常組比較,模型組ALT和AST水平上升,差異有統計學意義(P<0.01);與模型組比較,ATPR組ALT和AST水平下降,差異有統計學意義(P<0.01)。見表1。
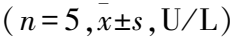
表1 ATPR對LPS損傷的小鼠血清ALT和AST的影響
2.2 ATPR對LPS損傷的小鼠肝臟組織炎癥因子IL-6和TNF-α mRNA相對表達水平的影響與正常組比較,模型組炎癥因子IL-6、TNF-α mRNA相對表達水平明顯上升,差異有統計學意義(P<0.01);與模型組比較,ATPR組IL-6、TNF-α mRNA相對表達水平明顯下降,差異有統計學意義(P<0.01)。見圖1。
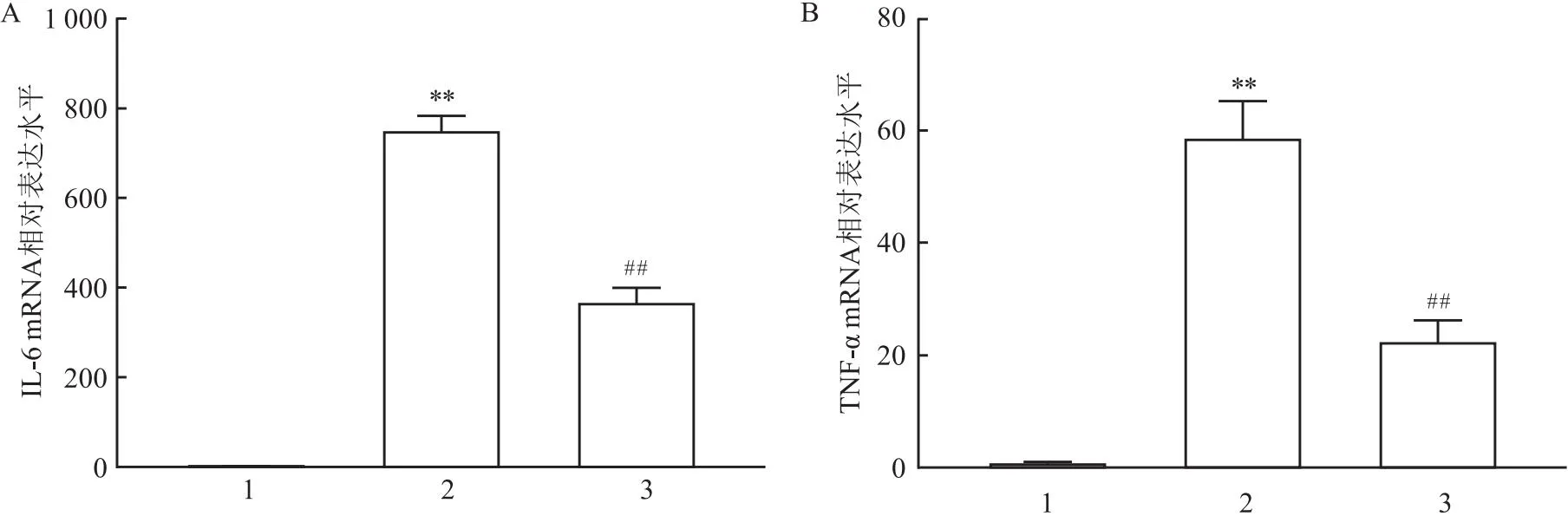
圖1 ATPR對LPS損傷小鼠肝臟組織炎癥因子IL-6(A)、TNF-α(B) mRNA相對水平的影響
2.3 HE染色結果正常組小鼠肝小葉結構正常,肝索呈放射狀排列,無充血和炎性細胞浸潤,肝細胞邊界清晰;模型組小鼠肝臟細胞間隙增大,肝索排列發生紊亂,出現炎性細胞浸潤;ATPR組肝臟細胞間隙、肝索結構有所恢復,炎性細胞浸潤較少。見圖2。
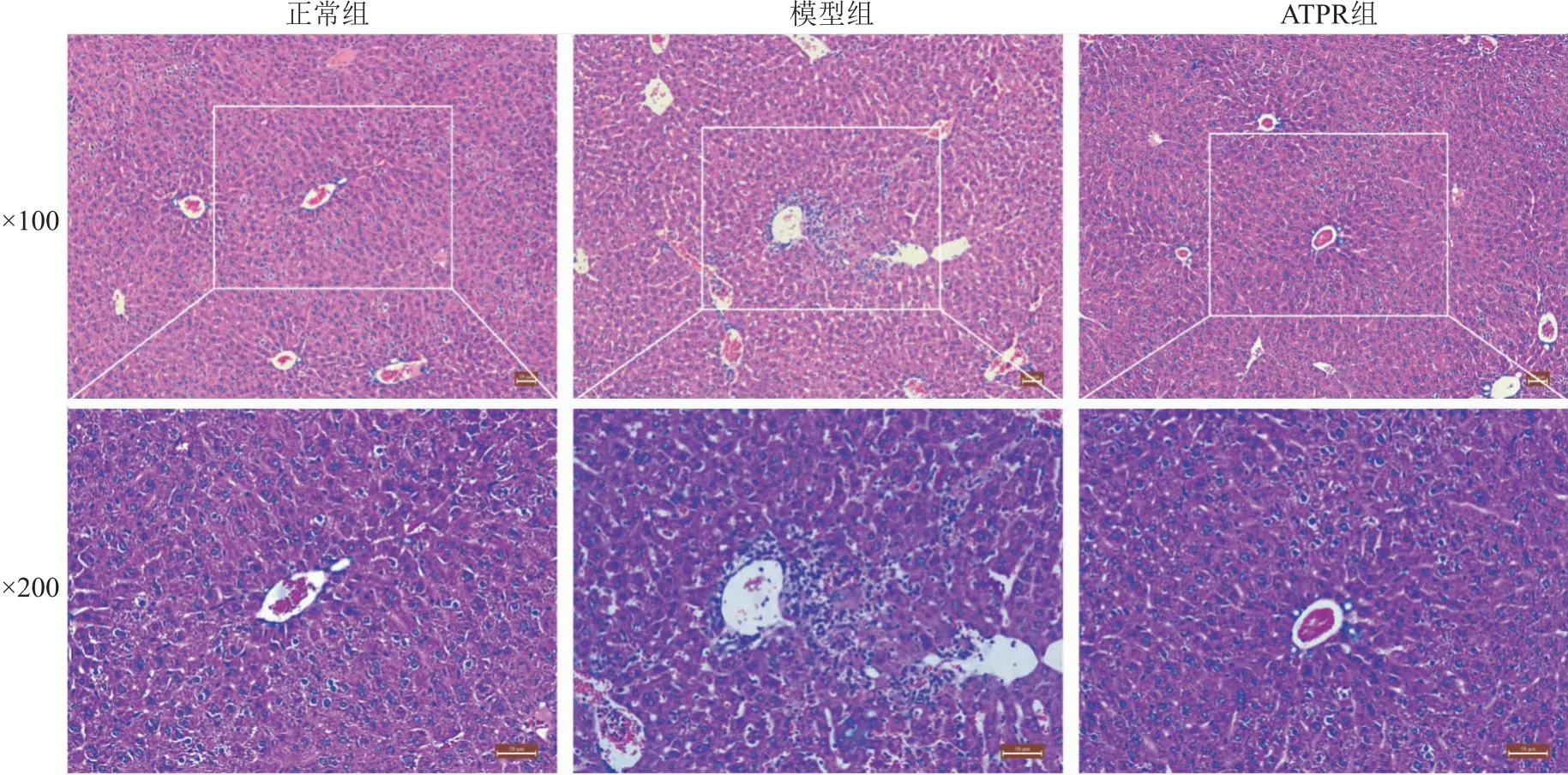
圖2 光學顯微鏡下小鼠肝臟HE染色結果
2.4 TEM觀察小鼠肝臟細胞超微結構與正常組比較,模型組小鼠肝細胞中線粒體出現嵴減少或消失和膜不完整的現象,受損線粒體數量明顯增多,脂滴數量增多;ATPR組小鼠肝細胞中線粒體形態和數量、脂滴數量趨于正常。見圖3。
圖3 TEM下小鼠肝臟細胞超微結構(圖中箭頭示自噬小體)
2.5 ATPR對LPS損傷小鼠肝臟線粒體損傷相關蛋白表達水平的影響Western blot結果顯示,與正常組比較,模型組小鼠肝臟組織FUNDC1蛋白表達增多(P<0.01),OPA1蛋白表達減少(P<0.01);與模型組比較,ATPR組小鼠肝臟組織FUNDC1蛋白表達減少(P<0.01),OPA1蛋白表達增多(P<0.01)。見圖4。
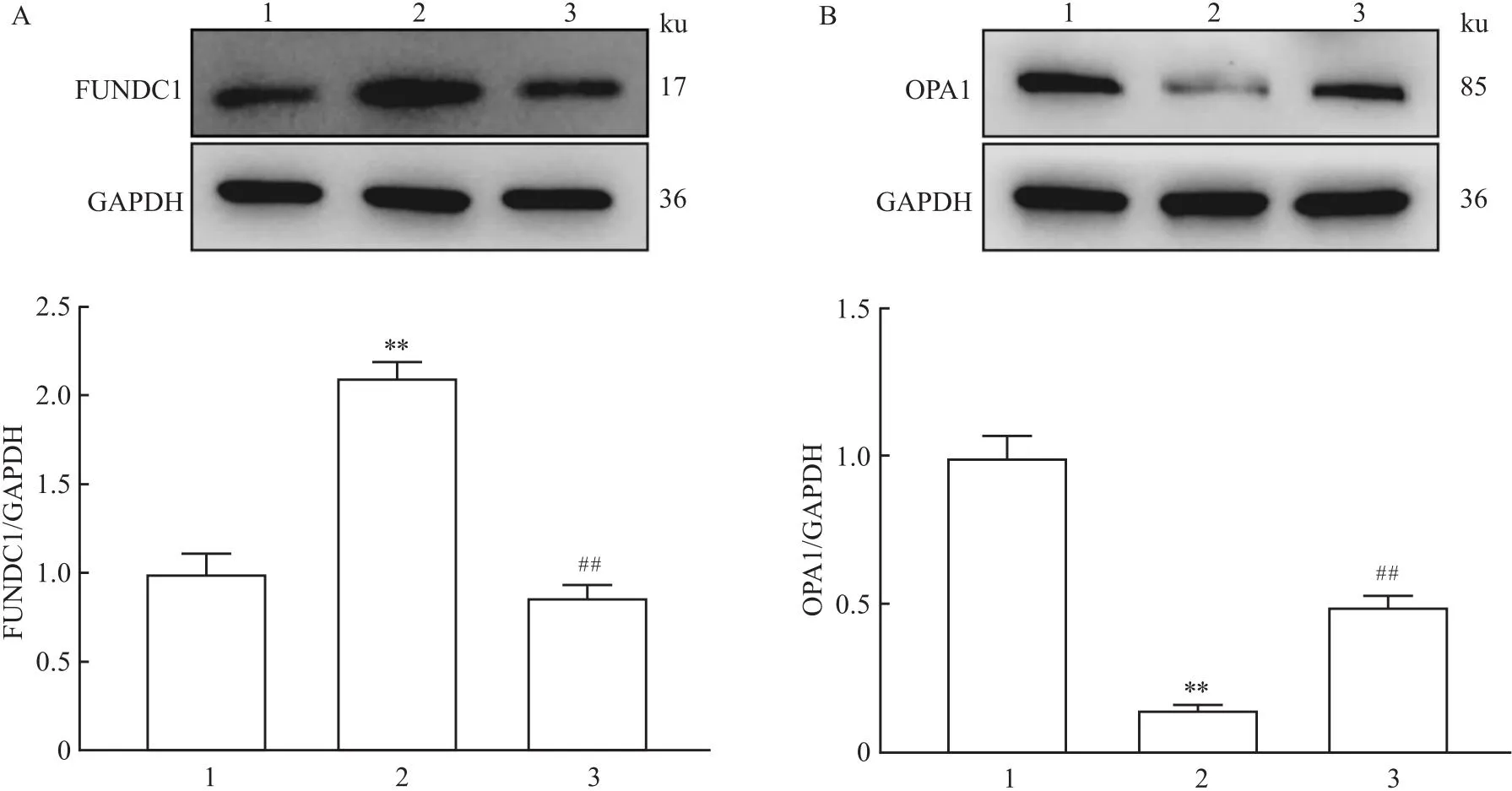
圖4 ATPR對LPS損傷小鼠肝臟線粒體損傷相關蛋白FUNDC1(A)、OPA1(B)表達水平的影響
2.6 ATPR對LPS損傷小鼠肝臟自噬相關蛋白表達水平的影響Western blot結果顯示,與正常組比較,模型組小鼠肝臟組織LC3BⅡ和LC3BⅠ的比值(LC3BⅡ/LC3BⅠ)減小(P<0.01),P62蛋白表達增多(P<0.01),Beclin1和ATG5蛋白表達減少(P<0.01);與模型組比較,ATPR組小鼠肝臟組織LC3BⅡ/LC3BⅠ增大(P<0.01),P62蛋白表達減少(P<0.01),Beclin1和ATG5蛋白表達增多(P<0.01)。見圖5。
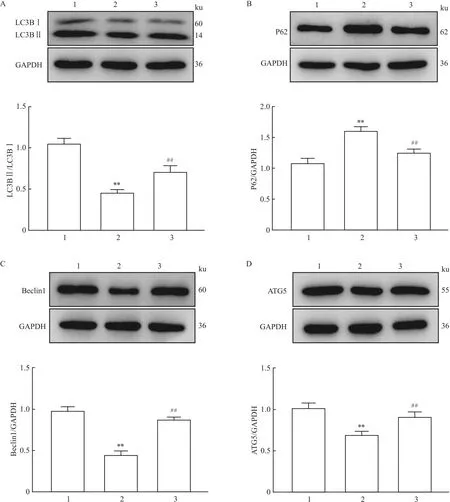
圖5 ATPR對LPS損傷小鼠肝臟組織自噬相關蛋白表達水平的影響
3 討論
ATRA是維生素A在體內的活性代謝產物,具有多種生物學功能,如降低關鍵炎癥信號蛋白磷酸化水平[4],轉錄調節一些參與介導人體典型抗氧化反應基因的表達水平[6]。ATRA在臨床上主要用于治療急性早幼粒細胞白血病,ATPR是以ATRA為基礎設計合成的衍生物,在多種腫瘤細胞中被證明具有優于ATRA的高效抗腫瘤活性[7]。本研究中,LPS刺激后,小鼠血清中ALT和AST水平上升,肝臟組織炎癥因子IL-6和TNF-α mRNA相對表達水平上升,肝臟細胞間隙增大,肝索排列發生紊亂,出現炎性細胞浸潤,ATPR可以緩解以上LPS造成的小鼠肝臟損傷。肝臟具有強大的代謝和解毒等功能,線粒體結構和功能的改變將導致肝臟損傷。FUNDC1是一種位于線粒體外膜的線粒體自噬受體,通過LIR基因序列招募LC3B,在哺乳動物細胞中啟動線粒體自噬。OPA1是一種定位于線粒體內膜和膜間隙的GTP酶,在線粒體內膜的融合和分裂中發揮重要作用,維持線粒體嵴結構[8]。本研究中,LPS刺激后,小鼠肝臟組織FUNDC1蛋白表達增多,OPA1蛋白表達減少,肝細胞內線粒體出現嵴減少或消失和膜不完整的現象,ATPR預處理后小鼠肝細胞中線粒體形態和結構趨于正常。有研究[9]顯示泛素特異性蛋白水解酶19通過自噬調控NLRP3功能抑制炎癥和促進M2樣巨噬細胞極化,本實驗以C57BL/6小鼠為實驗對象,ATPR預處理后腹腔注射LPS,探究ATPR是否通過影響自噬水平發揮治療作用。
自噬對細胞生長、存活和穩態是必不可少的,包括自噬的起始、隔離膜和自噬小體的形成、自噬溶酶體的形成、溶酶體降解內容物4個階段。自噬可分為巨自噬、微自噬以及分子伴侶介導的自噬,一般所說的自噬是指巨自噬,通過形成具有雙層膜結構的自噬小體包裹胞內物質,包括線粒體自噬、脂自噬、過氧化物酶體自噬及核糖體自噬等[10]。自噬發生過程中可以檢測3個關鍵蛋白,分別是LC3B、P62和Beclin1。LC3B蛋白合成后,C末端水解掉一段多肽,產生胞質分布的LC3BI;自噬過程中,LC3BI在一系列酶促作用下向LC3BII轉變,并結合在自噬小體膜上,LC3BII與LC3BI的比值大小可用來評估自噬水平的高低[11]。P62與泛素化蛋白結合,再與LC3BⅡ蛋白結合形成復合物,并最終在溶酶體內降解,在自噬過程中P62會不斷被消耗[12]。Beclin1與Ⅲ型磷脂酰肌醇三磷酸激酶結合后作為自噬的正向調節因子,在自噬的啟動階段發揮重要作用[13]。自噬的整個過程受到不同的自噬相關基因(autophagy-related gene,ATG)的調控, ATG5參與了自噬小體的擴張過程[14]。
有研究[15]發現,LPS降低AMPK的磷酸化,增加mTOR的磷酸化,導致自噬被抑制,同時自噬抑制會導致去極化線粒體的積聚。本研究中,LPS組小鼠肝細胞中脂滴數量增多,受損線粒體堆積,肝組織LC3BⅡ和LC3BⅠ的比值減小,P62蛋白表達增多,Beclin1和ATG5蛋白表達減少,這表明LPS所致小鼠肝損傷與肝組織自噬水平密切相關。ATPR預處理后小鼠肝組織FUNDC1蛋白表達減少,OPA1蛋白表達增多,肝細胞內線粒體形態和數量趨于正常,脂滴數量減少,且自噬小體數量增多,肝組織LC3BⅡ和LC3BⅠ的比值增大,P62蛋白表達減少,Beclin1和ATG5蛋白表達增多。以上結果表明ATPR可能是通過改善肝損傷小鼠的肝臟自噬水平起到保護肝臟的作用,但ATPR如何影響自噬水平的分子機制尚不清楚,還有待今后進一步研究。
綜上所述,ATPR對LPS誘導的小鼠急性肝損傷具有保護作用,其機制可能與促進細胞自噬有關,這些結果表明ATPR作為藥物對治療LPS造成的肝臟損傷有一定的潛力。

