生物信息學(xué)分析TOP2A在肝細(xì)胞癌中表達(dá)和預(yù)后機(jī)制及其對(duì)肝癌增殖、遷移的影響*
劉有浩 欒欣怡 楊 瑩 李浩然 李宏彬
山西醫(yī)科大學(xué)汾陽(yáng)學(xué)院,山西省汾陽(yáng)市 032200
肝癌(Hepatocellular carcinoma,HCC)是常見的惡性消化道腫瘤之一,發(fā)病率高,手術(shù)效果欠佳,預(yù)后極差[1]。大多數(shù)肝癌患者都是在后期確診的,很大程度上耽誤了最佳治療時(shí)間,因此了解與肝癌發(fā)病有關(guān)的分子機(jī)制,并找尋有價(jià)值的肝癌生物因素標(biāo)志供臨床參考診斷十分具有意義。
有研究表明拓?fù)洚悩?gòu)酶(DNA)Ⅱα[Topoisomerase (DNA) Ⅱ alpha,TOP2A]可以促進(jìn)癌細(xì)胞的增殖和遷移,如髓母細(xì)胞瘤[2]、肺癌細(xì)胞[3-4]、甲狀腺癌[5]及食管鱗狀細(xì)胞癌細(xì)胞[6-7],充分證實(shí)了TOP2A 作為生物標(biāo)志因素影響腫瘤的發(fā)生和發(fā)展,可以作為癌癥診斷和預(yù)后的重要指標(biāo)。本研究通過(guò)生物信息學(xué)方法探討TOP2A在肝癌中的表達(dá),并且降低肝癌細(xì)胞中TOP2A的表達(dá),觀察其對(duì)細(xì)胞增殖和遷移能力的影響,分析其在HCC發(fā)生發(fā)展中的作用機(jī)制,為患者的早期診斷提供新的思路和依據(jù)。
1 材料和方法
1.1 實(shí)驗(yàn)試劑及儀器 人肝癌細(xì)胞(HepG2細(xì)胞株)、TOP2A抑制劑(銳博生物)、DMEM培養(yǎng)基(Gibco)、青鏈霉素(美侖)、胎牛血清(ExCell Bio)、無(wú)菌PBS緩沖液(美侖)、0.25%EDTA胰酶(美侖)、T25培養(yǎng)瓶(NEST)、6孔板、96孔板(NEST)、CCK-8試劑盒(博士德)、引物(生工生物)、RNA提取試劑盒(聚合美)、RNA逆轉(zhuǎn)錄試劑盒(聚合美)、SYBR Green試劑盒(聚合美)、0.2mL 8聯(lián)管(NEST)。
1.2 TOP2A在腫瘤組織和細(xì)胞系的差異表達(dá) 通過(guò)TIMER 2.0在線數(shù)據(jù)庫(kù) (http://timer.cistrome.org)選擇 Exploration欄目下的Gene_De,輸入基因名TOP2A后點(diǎn)擊submit,分析比較TOP2A在33種腫瘤組織和癌旁組織中的表達(dá)情況,癌組織和癌旁組織中TOP2A的表達(dá)差異有統(tǒng)計(jì)學(xué)意義用灰色背景標(biāo)識(shí)。利用HPA數(shù)據(jù)庫(kù)(https://www.proteinatlas.org/),文字框中輸入基因名TOP2A,選擇cell line,得到TOP2A在不同腫瘤細(xì)胞系和TOP2A在不同肝癌細(xì)胞中的表達(dá)結(jié)果。
1.3 TOP2A在肝癌組織和癌旁組織中的表達(dá) 利用GEPIA2數(shù)據(jù)庫(kù)(http://gepia2.cancer-pku.cn/#index)選擇Expression DIY欄目,輸入基因名TOP2A,以log2FC<1且P<0.01為篩選條件,疾病類型選擇肝癌(LIHC),分析TOP2A在TCGA數(shù)據(jù)庫(kù)肝癌組織和癌旁組織的表達(dá)差異。GEO數(shù)據(jù)庫(kù)(http://gepia2.cancer-pku.cn/#index)中下載GSE56267和GSE121248數(shù)據(jù)集,運(yùn)用R軟件處理數(shù)據(jù),使用Graphpad軟件比較TOP2A在肝癌組織和癌旁組織中的表達(dá)差異。
1.4 TOP2A表達(dá)與肝癌患者預(yù)后之間的關(guān)系 利用GEPIA2數(shù)據(jù)庫(kù)(http://gepia2.cancer-pku.cn/#index)選擇Survival Analysis,輸入基因名TOP2A,疾病類型選擇肝癌(LIHC),分析TOP2A mRNA表達(dá)與患者的生存預(yù)后關(guān)系。
1.5 TOP2A基因共表達(dá)和GSEA富集分析 利用Linkedomics在線數(shù)據(jù)庫(kù)(http://www.linkedomics.org/login.php)設(shè)置參數(shù)疾病類型:肝癌,數(shù)據(jù)類型:TCGA-LIHC,基因名稱:TOP2A,統(tǒng)計(jì)方法: person 相關(guān)系數(shù),分析肝癌組織中TOP2A共表達(dá)的正負(fù)相關(guān)基因。選擇“LinkInterpreter”菜單,對(duì)該數(shù)據(jù)庫(kù)篩選出的相關(guān)基因進(jìn)行KEGG 通路富集分析。
1.6 細(xì)胞培養(yǎng)及分組 HepG2細(xì)胞接種于含 10%胎牛血清的 DMEM 培養(yǎng)液中, 37℃、5%CO2培養(yǎng)箱內(nèi)培養(yǎng),顯微鏡下觀察細(xì)胞融合達(dá)到80%~90%,吸出培養(yǎng)基,并PBS洗3次,胰酶消化,重懸細(xì)胞液,調(diào)整細(xì)胞濃度為1×105,接種于6孔板中,24h后加藥換液,參照銳博轉(zhuǎn)染試劑riboFECTTM說(shuō)明書進(jìn)行實(shí)驗(yàn)。分為兩組,陰性對(duì)照組(Control組)使用陰性對(duì)照siRNA進(jìn)行轉(zhuǎn)染,實(shí)驗(yàn)組使用TOP2A抑制劑(濃度為50nM)進(jìn)行轉(zhuǎn)染,繼續(xù)將細(xì)胞放置于培養(yǎng)箱中培養(yǎng),48h后提取RNA,使用QPCR檢測(cè)沉默效果。
1.7 細(xì)胞劃痕實(shí)驗(yàn) 對(duì)數(shù)生長(zhǎng)期細(xì)胞消化后重懸細(xì)胞懸液,顯微鏡下計(jì)數(shù),以1×104個(gè)/孔接種于6孔板,置于37℃、5%CO2培養(yǎng)箱中培養(yǎng)24h,待細(xì)胞融合至80%,進(jìn)行轉(zhuǎn)染,轉(zhuǎn)染24h后,用20μL槍頭比著直尺,垂直于培養(yǎng)板劃痕,吸出培養(yǎng)基,無(wú)菌PBS洗滌細(xì)胞,去除細(xì)胞碎片,置于細(xì)胞培養(yǎng)箱中培養(yǎng),分別于0h、24h使用倒置顯微鏡觀察結(jié)果并照相, Image J軟件測(cè)量劃痕面積。設(shè)立三組平行試驗(yàn),用Graphpad軟件統(tǒng)計(jì)分析實(shí)驗(yàn)結(jié)果。
1.8 CCK-8 法檢測(cè)細(xì)胞增殖能力 設(shè)置對(duì)照組和實(shí)驗(yàn)組(分組參考材料方法1.6),將HepG2以2×103個(gè)/孔接種于96孔板,每組5個(gè)復(fù)孔,細(xì)胞培養(yǎng)24h,待細(xì)胞貼壁良好后吸出培養(yǎng)基,進(jìn)行轉(zhuǎn)染,在培養(yǎng)箱中分別孵育0h、12h、24h三個(gè)時(shí)間點(diǎn),吸出培養(yǎng)基,預(yù)混CCK-8與培養(yǎng)基1∶9比例制成溶液,每孔加入100μL的混合液,將培養(yǎng)板放置于37℃、5%CO2的細(xì)胞培養(yǎng)箱中孵育1h,使用酶標(biāo)儀檢測(cè)各孔在450nm波長(zhǎng)處的OD值,實(shí)驗(yàn)至少重復(fù)3次。
1.9 統(tǒng)計(jì)學(xué)方法 運(yùn)用GraphPad 8.0 軟件進(jìn)行統(tǒng)計(jì)學(xué)分析和繪圖。實(shí)驗(yàn)均重復(fù)3次,所有數(shù)據(jù)以均數(shù)±標(biāo)準(zhǔn)差表示,組間數(shù)據(jù)比較使用獨(dú)立樣本t檢驗(yàn),以P<0.05表示差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
2.1 TOP2A在腫瘤組織和細(xì)胞系中的差異表達(dá) 利用TIMER2.0在線數(shù)據(jù)庫(kù),對(duì)TOP2A在正常組織與腫瘤組織中的表達(dá)進(jìn)行研究,結(jié)果表明與正常組織相比,腫瘤組織中TOP2A在膀胱移行細(xì)胞癌、乳腺浸潤(rùn)性癌、膽管癌、結(jié)腸癌、食管癌、頭頸部鱗狀細(xì)胞癌、腎嫌色細(xì)胞癌、腎透明細(xì)胞癌、腎乳頭狀細(xì)胞癌、肝臟肝細(xì)胞癌、肺腺癌、肺鱗狀細(xì)胞癌、前列腺腺癌、直腸腺癌、胃腺癌、甲狀腺癌、子宮內(nèi)膜癌中表達(dá)明顯上調(diào),具有統(tǒng)計(jì)學(xué)意義(P<0.05),見圖1a。HPA數(shù)據(jù)庫(kù)結(jié)果顯示,TOP2A在膽管癌、骨癌、宮頸癌、食管癌、肝癌、白血病、肺癌、淋巴癌、睪丸癌等細(xì)胞中均有表達(dá),見圖1b。通過(guò)進(jìn)一步的分析發(fā)現(xiàn)TOP2A在Hep-G2、Hep3B2.1-7、Huh-7、PLC/PRF/5等肝癌細(xì)胞系中表達(dá)上升,見圖1c,充分佐證了TOP2A可能參與肝癌的發(fā)生發(fā)展進(jìn)程。

圖1 TOP2A在腫瘤組織和細(xì)胞系中的差異表達(dá)
2.2 TOP2A在肝癌組織和癌旁組織中的表達(dá)及肝癌患者預(yù)后的關(guān)系 通過(guò)GEPIA數(shù)據(jù)庫(kù),研究關(guān)于TOP2A基因在160例正常組織和369例肝癌組織中的表達(dá)差異,結(jié)果顯示TOP2A在肝癌組織中的表達(dá)水平明顯高于正常組織,見圖2a。在GSE45267數(shù)據(jù)集和GSE121247數(shù)據(jù)集中對(duì)TOP2A在正常組織和肝癌組織的表達(dá)差異進(jìn)行進(jìn)一步的驗(yàn)證,結(jié)果表明,與正常組織相比,TOP2A在肝癌組織中顯著高表達(dá),見圖2b、c。通過(guò)此三組數(shù)據(jù)驗(yàn)證TOP2A在肝癌組織和正常組織的表達(dá)情況,結(jié)果一致表明TOP2A在肝癌組織中表達(dá)均顯著上升,差異有統(tǒng)計(jì)學(xué)意義(P<0.001)。利用生存分析探索TOP2A不同表達(dá)對(duì)HCC患者預(yù)后的影響,通過(guò)GEPIA2數(shù)據(jù)庫(kù)對(duì)182例TOP2A高表達(dá)組和182例TOP2A低表達(dá)組HCC患者預(yù)后的情況進(jìn)行分析,結(jié)果顯示TOP2A高表達(dá)組患者總生存周期明顯低于低表達(dá)組患者,差異具有統(tǒng)計(jì)學(xué)意義(P<0.05),見圖2d。

圖2 TOP2A在肝癌組織和癌旁組織中的表達(dá)及肝癌患者預(yù)后的關(guān)系
2.3 TOP2A基因共表達(dá)和GSEA富集分析 為了進(jìn)一步探究TOP2A在肝癌中的發(fā)展機(jī)制,通過(guò)LinkedOmics 數(shù)據(jù)庫(kù)尋找肝癌中與TOP2A共表達(dá)相關(guān)基因,結(jié)果表明,19 922個(gè)基因與TOP2A表達(dá)相關(guān),見圖3a,與TOP2A表達(dá)呈正相關(guān)的有13 571 個(gè)基因,相關(guān)性最強(qiáng)的前50個(gè)基因?yàn)镵IF18B、BUB1B等,見圖3b,6 351個(gè)基因與TOP2A表達(dá)呈負(fù)相關(guān),負(fù)相關(guān)性最強(qiáng)的前50的基因?yàn)镹DUFF1、CCL14等,見圖3c。相關(guān)基因GSEA富集分析后, KEEG 通路富集分析表明,TOP2A可能參與細(xì)胞周期、DNA復(fù)制、P53信號(hào)通路、氧化磷酸化等過(guò)程,見圖3d。
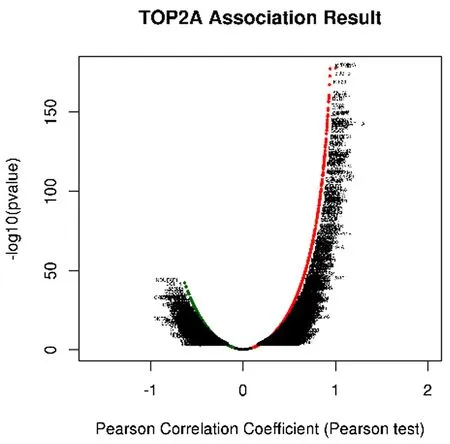
a
2.4 抑制TOP2A基因?qū)?xì)胞增殖和遷移的影響 HepG2細(xì)胞接種于含 10%胎牛血清的 DMEM 培養(yǎng)液中,在適宜條件下進(jìn)行培養(yǎng),待實(shí)驗(yàn)操作結(jié)束后分成對(duì)照組和實(shí)驗(yàn)組,采取不同的措施,對(duì)照組用siRNA進(jìn)行轉(zhuǎn)染,實(shí)驗(yàn)組加入TOP2A抑制劑,然后提取兩組的RNA,使用QPCR檢測(cè)沉默效果,發(fā)現(xiàn)抑制劑
a、b、c分別為TOP2A在GEPIA數(shù)據(jù)庫(kù)、GSE45267數(shù)據(jù)集、GSE121247數(shù)據(jù)集中肝癌組織和正常組織中的表達(dá)情況 d.GEPIA2數(shù)據(jù)庫(kù)中TOP2A表達(dá)與肝癌患者生存期的關(guān)系。*P<0.05,****P<0.000 1在50nM、48h的條件下,TOP2A在肝癌細(xì)胞系中的表達(dá)明顯下降,見圖4a。

a
利用細(xì)胞劃痕實(shí)驗(yàn)來(lái)檢測(cè)TOP2A對(duì)肝癌細(xì)胞遷移的影響,實(shí)驗(yàn)結(jié)果發(fā)現(xiàn),在0h時(shí),兩組劃痕面積的大小基本一致,對(duì)于肝癌細(xì)胞遷移的影響無(wú)較大差別,但培養(yǎng)24h后,發(fā)現(xiàn)對(duì)照組劃痕面積明顯變小,實(shí)驗(yàn)組劃痕面積相較于0h時(shí)并沒(méi)有明顯變化,除此之外,對(duì)照組中肝癌細(xì)胞的數(shù)量顯著增多,呈現(xiàn)雙層甚至三層排列,而實(shí)驗(yàn)組中肝癌細(xì)胞的數(shù)量變化不大,分布較為散在,見圖4b、c。這就表明,降低TOP2A表達(dá)后肝癌細(xì)胞的遷移能力下降。
利用CCK-8對(duì)正常組和實(shí)驗(yàn)組肝癌細(xì)胞的增殖進(jìn)行研究,結(jié)果觀察到,在0~24h內(nèi),正常組肝癌細(xì)胞的增殖隨時(shí)間的推移逐漸上升,而實(shí)驗(yàn)組肝癌細(xì)胞的增殖恰好相反,隨時(shí)間的推移而逐漸下降,且在12h和24h時(shí),肝癌細(xì)胞增殖下降得尤為明顯,見圖4d。表明降低TOP2A使肝癌細(xì)胞的增殖明顯下降。
3 討論
肝癌作為嚴(yán)重威脅人類健康的惡性腫瘤之一,其發(fā)病率和死亡率逐年明顯上升[8-9],目前雖有手術(shù)切除、藥物治療等措施,但因發(fā)現(xiàn)時(shí)已為肝癌中晚期而導(dǎo)致治療結(jié)果不佳,況且預(yù)后效果較差[10],因此深入研究肝癌的發(fā)生發(fā)展機(jī)制,探究有價(jià)值的生物因素標(biāo)志對(duì)于臨床早發(fā)現(xiàn)、早診斷、早治療十分具有意義。TOP2A作為染色體上的上調(diào)基因,通過(guò)參與DNA的轉(zhuǎn)錄復(fù)制以及染色體的凝集分離等過(guò)程調(diào)節(jié)拓?fù)錉顟B(tài)和結(jié)構(gòu)[11-12]。研究表明TOP2A 的表達(dá)常見于 S 期、G2 期和 M 期,而其表達(dá)異常可影響生物節(jié)律,在腫瘤細(xì)胞的發(fā)生、侵襲、轉(zhuǎn)移、化療耐藥等過(guò)程中有著重要作用[13-15]。本文利用生物信息學(xué)以及體外驗(yàn)證實(shí)驗(yàn)找尋肝癌的核心基因TOP2A并且分析其在肝癌發(fā)病以及預(yù)后過(guò)程的重要價(jià)值。
本文研究中,首先通過(guò)TIMER 2.0在線數(shù)據(jù)庫(kù),分析33組腫瘤組織和癌旁組織中TOP2A的表達(dá)情況,其次利用HPA數(shù)據(jù)庫(kù),探索TOP2A在不同腫瘤細(xì)胞系和TOP2A在不同肝癌細(xì)胞中的表達(dá)結(jié)果,結(jié)果表明,與正常組織相比,TOP2A在大部分腫瘤組織中的表達(dá)均明顯上調(diào)(P<0.01),說(shuō)明其可能作為肝癌的診斷標(biāo)志物,然后進(jìn)行進(jìn)一步的調(diào)查,發(fā)現(xiàn)TOP2A在Hep-G2、Hep3B2等肝癌細(xì)胞系中的表達(dá)顯著上升,說(shuō)明TOP2A有望作為肝癌的新生物標(biāo)志因素。利用GEPIA2數(shù)據(jù)庫(kù),剖析TOP2A在TCGA數(shù)據(jù)庫(kù)中369例肝癌組織和160例癌旁組織的表達(dá)差異,研究顯示,其在腫瘤組織中的表達(dá)含量遠(yuǎn)高于正常組織,進(jìn)一步論證了TOP2A參與肝癌的發(fā)生與發(fā)展。GEPIA2數(shù)據(jù)庫(kù)中選取TOP2A高表達(dá)組182例和TOP2A低表達(dá)組182例肝癌預(yù)后情況,解析了TOP2A的表達(dá)與患者生存預(yù)后的關(guān)系,發(fā)現(xiàn)高表達(dá)組明顯縮短了患者的生存周期,高表達(dá)與患者的預(yù)后明顯負(fù)相關(guān)。最后,利用Linkedomics在線數(shù)據(jù)庫(kù),尋找肝癌中與TOP2A共表達(dá)相關(guān)基因,結(jié)果顯示19 922個(gè)基因與TOP2A表達(dá)相關(guān),與TOP2A表達(dá)呈正相關(guān)的有KIF18B、BUB1B等13 571 個(gè)基因,NDUFF1、CCL14等6 351個(gè)基因與TOP2A表達(dá)呈負(fù)相關(guān),通過(guò)TOP2A基因共表達(dá)和GSEA富集分析,KEGG通路富集證明了TOP2A可能參與細(xì)胞周期、DNA復(fù)制、P53信號(hào)通路、氧化磷酸化等過(guò)程,調(diào)控機(jī)體細(xì)胞增殖,免疫反應(yīng)等過(guò)程,細(xì)胞周期的失控是腫瘤惡性轉(zhuǎn)化的標(biāo)志之一,其功能失控可導(dǎo)致腫瘤細(xì)胞向遠(yuǎn)處轉(zhuǎn)移[16]。通過(guò)這一系列的生物信息學(xué)方法,可以判定TOP2A可以作為評(píng)估肝癌的生物因素標(biāo)志。
為進(jìn)一步驗(yàn)證TOP2A對(duì)肝癌的影響,利用人肝癌細(xì)胞株HepG2進(jìn)行細(xì)胞培養(yǎng),待培養(yǎng)結(jié)束后,分為正常組和實(shí)驗(yàn)組,經(jīng)過(guò)實(shí)驗(yàn)驗(yàn)證,發(fā)現(xiàn)在50nM、48h的條件下,TOP2A在肝癌細(xì)胞系中的表達(dá)會(huì)明顯下降,細(xì)胞劃痕實(shí)驗(yàn)表明抑制TOP2A表達(dá)后肝癌細(xì)胞遷移能力顯著下降,通過(guò)CCK-8實(shí)驗(yàn)來(lái)探索TOP2A對(duì)于肝癌細(xì)胞增殖的影響,觀察發(fā)現(xiàn)24h內(nèi),正常組中肝癌細(xì)胞的增殖上升,但實(shí)驗(yàn)組中肝癌細(xì)胞的增殖下降,所以我們可以判定,TOP2A可以促進(jìn)肝癌細(xì)胞的增殖。經(jīng)過(guò)生物信息學(xué)和體外實(shí)驗(yàn)的結(jié)果,提示TOP2A對(duì)于肝癌的發(fā)生發(fā)展有顯著的影響。
綜上所述,TOP2A在肝癌組織中高表達(dá),參與肝癌的發(fā)生發(fā)展且與不良預(yù)后密切相關(guān),可以作為肝癌早期診斷和預(yù)后的新生物指標(biāo),抑制TOP2A后能夠阻抑肝癌細(xì)胞的增殖和遷移[17],因此也給肝癌免疫治療提供新靶點(diǎn)。本研究也有一定的局限性,研究中檢測(cè)的樣本量較小,關(guān)于TOP2A是否可以作為肝癌診斷的標(biāo)志性基因還應(yīng)擴(kuò)大樣本量并且做更深入的研究;缺乏動(dòng)物實(shí)驗(yàn),未考慮肝癌細(xì)胞在體內(nèi)和培養(yǎng)皿環(huán)境不同所造成的差異,也未考慮多種動(dòng)物模型下不同肝癌細(xì)胞種類的差異。除此之外研究單單利用了在線數(shù)據(jù)庫(kù)和體外驗(yàn)證實(shí)驗(yàn),還需要后期收集臨床樣本,同臨床結(jié)合驗(yàn)證其在肝癌中的表達(dá)差異和相關(guān)性。本研究也為TOP2A的后續(xù)研究提供了一定的思路和依據(jù)。
- 醫(yī)學(xué)理論與實(shí)踐的其它文章
- 3例艾滋病合并膀胱癌患者行手術(shù)治療后的護(hù)理經(jīng)驗(yàn)
- 動(dòng)物輔助干預(yù)在兒童疼痛中的應(yīng)用研究進(jìn)展
- 中國(guó)傳統(tǒng)功法干預(yù)腰椎間盤突出癥的研究進(jìn)展
- 基于“氣虛痰瘀”病機(jī)探討細(xì)胞自噬與冠心病的關(guān)系*
- 混合式教學(xué)應(yīng)用于培訓(xùn)護(hù)士突發(fā)公共衛(wèi)生事件應(yīng)急處置的效果*
- 基于CBL的半翻轉(zhuǎn)課堂教學(xué)應(yīng)用于阿克曼外科病理學(xué)線上教學(xué)中的效果

