一種可滿足產業化需求的靶向EpCAM嵌合抗原受體慢病毒生產工藝*
周文婷,鄧公平,付舒翔,田方艷,吳珊珊,柏清玉,鄧長云,唐穎鑫,朱淑英,張培湘
(1.湖南遠泰生物技術有限公司,湖南 長沙 410221;2.海南省人民醫院 急診科,海南 海口 570311)
隨著基因細胞治療行業的飛速發展,嵌合抗原受體T 細胞(CAR-T)作為一種基因工程修飾的新型高效、精準靶向的腫瘤細胞免疫治療藥物,已經在血液腫瘤治療中展現巨大治療潛力,國內外已有多個產品獲批上市。基因傳遞/轉染是制備CAR-T 的關鍵,載體的導入效率影響著CAR-T 產品的成本和質量。目前全球范圍內在研的細胞免疫治療管線中,絕大部分項目選用慢病毒作為感染T 細胞的載體。慢病毒載體是以HIV-1(人類免疫缺陷I 型病毒,80~120 nm)為基礎發展起來的細胞與基因治療載體,主要由莢膜、蛋白殼及內部包裹的RNA 構成。慢病毒載體可以將外源基因有效地整合到宿主細胞的染色體上,從而實現外源基因的穩定表達,是工業和臨床科研常用的一類病毒載體。上皮細胞粘附分子(EpCAM,又稱為CD326)抗原是由EpCAM 基因編碼約30~40 kDa 的細胞表面糖蛋白。人EpCAM 蛋白由314 個氨基酸組成。該蛋白包含一個信號肽和三個結構域(細胞外AA24-265、跨膜AA266-288、細胞質AA289-314)。EpCAM 參與Wnt、ERK 和AKT 生存信號傳導,并在運動、增殖和細胞生長中發揮作用。EpCAM[1-2]最初被發現是人類結腸癌[3]的主要抗原,是一種I 型跨膜糖蛋白,位于正常上皮細胞[4]的一個亞群和許多干細胞表達[5]上。在一些上皮性癌癥[6]中,包括卵巢癌[7],EpCAM 抗原也以異質性的方式過表達。EpCAM 在細胞粘附、生長、增殖、炎癥、癌癥和轉移中起著至關重要的作用,并且明顯呈現在各種癌的細胞表面,使其成為CAR-T 細胞治療中的一個非常有吸引力的靶點[8-9]。
1 材料和方法
1.1 實驗材料
1.1.1 實驗用細胞 病毒生產用人胚腎上皮細胞(HEK 293T)懸浮細胞由湖南遠泰生物技術有限公司自主馴化所得,并按照《中華人民共和國藥典》2020 年版三部生物制品生產檢定用動物細胞基質制備及質量控制等指導文件建立三級細胞庫。HEK 293T 細胞培養:LVPY01 培養基、病毒包裝轉染用LVZR02 培養基、提高病毒表達產量補料用LVBL03 培養基/LVBL04 培養基均為遠泰生物自制。檢定用HEK 293T 細胞購自美國ATCC 生物生物標準品資源中心,貨號CRL-3216。
1.1.2 實驗用動物 SPF 級雌性BALB/C 小鼠產自湖南遠泰生物技術有限公司。
1.1.3 主要試劑與材料 EpCAM 蛋白產自湖南遠泰生物技術有限公司;EpCAM 特異性CAR 的慢病毒載體質粒構建由美國ProMab 公司完成;pMD2.G、pMDLg-pRRE、pRSV-Rev 慢病毒三個包裝質粒從Addgene 購買并經遠泰生物進行了KanR 改造,KanR 改造完成后三個質粒分別命名為P004、P005、P006 質粒;1 M MgCl2溶液購自Thermo,貨號AM9530G;Super Nuclease 核酸酶購自北京義翹神州,貨號GMP-SSNP01;Capto Core 700 填料購自Cytiva,貨號17 548103;層析緩沖液LVPH01溶液為遠泰生物自制;LVBC06 病毒保存液為遠泰生物自制。Biotin-Human Fab specific 購自Jackson ImmunoResearch,貨 號 109-066-097;PE Streptavidin 購自BioLegend,貨號 405204;7AAD購自Biolegend,貨號420404。
1.2 實驗方法
1.2.1 EpCAM 單抗制備實驗方法 ①小鼠免疫及測血:采用EpCAM 蛋白與福氏完全佐劑/福氏不完全佐劑混勻乳化,皮下注射,每只免疫EpCAM蛋白量約25~50 μg。按照Day 1 至Day 21 至Day 35 周期免疫,第三次注射后10 d 測血[酶聯免疫吸附試驗(enzyme-linked immunosorbent assay,ELISA)/蛋白免疫印跡(western blot,WB)/流式細胞術(flow cytometry,FCM)],達到滴度即可做準備融合前準備。②加強免疫及融合:融合前3~4 d,小鼠尾靜脈加強免疫EpCAM 蛋白量約25~50 μg。加強免疫完成后無菌操作獲取小鼠脾臟,制成小鼠脾細胞懸液后,與準備好的小鼠骨髓瘤細胞按一定的比例,通過聚乙二醇(PEG)進行融合,融合后的細胞采用預溫的完全HAT 培養液于96 孔板中共培養。③雜交瘤的擴增和篩選:融合后4~5 d,更換96 孔板中HAT 培養液至HT 培養液。融合后8~10 d 進行96 孔雜交瘤細胞的篩選,篩選96 孔板中所得陽性孔轉入24 孔進行擴增培養。④有限稀釋單克隆化及擴大培養:篩選24 孔板中所得陽性孔進行有限稀釋至96 孔板,進而篩選有限稀釋后的96 孔板中,所得單克隆陽性孔轉入24 孔進行擴增培養,繼續篩選24 孔板中所得陽性孔擴增至6 孔板。⑤陽性克隆細胞凍存與抗體生產:將6 孔板中陽性細胞凍存保種后,將細胞擴增至T75/T175 瓶中,當陽性細胞達到小鼠腹水生產需求量時,按一定的細胞數量進行小鼠腹腔注射,約7~10 d 收集小鼠腹腔內腹水,采用Protein A 進行腹水純化,純化后即為EpCAM 單克隆抗體。
1.2.2 EpCAM 單抗檢測方法 在單克隆抗體制備過程中可根據產品需求對小鼠血清、母克隆、亞克隆、定珠雜交瘤細胞、上清、腹水、抗體等中間品和成品進行相關檢測如ELISA、WB、FCM、免疫組織化學、免疫熒光等檢測項目。本文主要呈現ELISA 法:純化抗體按照1∶103、1∶104、1∶105進行梯度稀釋,純化抗體稀釋后加入包被有相應抗原的酶標板中,同時設定好對照,ELISA 結果判斷標準為450 nm 波長測定吸光值,陰性對照OD 值<0.2,陽性對照OD 值>1.0,待測抗體OD 值>0.2,P/N>2.1 時,純化抗體的最大稀釋倍數為抗體的ELISA 效價。
1.2.3 EpCAM CAR 質粒構建及制備實驗方法①EpCAM 陽性單克隆細胞株可變區測序:復蘇并培養陽性單克隆細胞株,通過Trizol、氯仿等試劑提取陽性細胞RNA,采用一步法cDNA 反轉錄試劑盒進行聚合酶鏈反應(polymerase chain reaction,PCR)、反轉錄PCR(reverse transcription PCR,RTPCR)反應,逆轉錄得到DNA 后采用pMDTM19-T載體克隆試劑盒連接至T-vector,將所得反應體系轉化至異丙基硫代-β-D-半乳糖苷(isopropylthio-β-Dgalactoside,IPTG)、X-gal、Amp 的LB 平板中培養過夜后擴大培養,并針對每個重鏈和輕鏈克隆送上海生工進行測序。得到測序結果后,通過分析確定重鏈和輕鏈的可變區序列。EpCAM CAR 質粒構建:ProMab 公司采用EpCAM 陽性單克隆細胞株可變區測序結果,構建編碼人源化EpCAM 特異性CAR 的慢病毒載體質粒。②EpCAM CAR 質粒制備實驗方法。a:采用ProMab 公司構建好的EpCAM CAR 原始質粒轉化DH5α 感受態細胞,挑選單克隆菌落并擴大培養,按照《中華人民共和國藥典》2020 年版三部:生物制品生產檢定用菌毒種的管理及質量控制等文件指導內容,建立DH5α-EpCAM 三級菌種庫。b:復蘇一支DH5α-EpCAM 工作庫菌種擴大培養至10 L 發酵罐,發酵約24 h,菌液OD 600 nm 值達到50,即收獲發酵菌液;將發酵菌液經高速離心收獲濕菌,濕菌經裂解、澄清、三步層析、濃縮換液、除菌過濾、制劑分裝等工序獲得EpCAM CAR 載體質粒成品。
1.2.4 EpCAM 慢病毒生產方法 ①HEK 293T 細胞復蘇:復蘇一支HEK 293T 懸浮工作庫細胞,加入到預熱的遠泰自制LVPY001 培養基,離心重懸并計數后,按一定的細胞密度接種至125 mL 搖瓶,于CO2濃度為5% 的振蕩培養箱37℃培養。②HEK 293T 細胞傳代:采用遠泰自制LVPY01 培養基進行傳代培養至1 個或多個1 000 mL 搖瓶,應注意細胞密度、細胞活率等數據,傳代期間應保持細胞活率>95%。根據慢病毒成品需求量確定產毒細胞需求量,從而確定細胞傳代次數和傳代周期。③病毒包裝:取適量HEK 293T 細胞離心后,采用遠泰自制LVZR02 培養基重懸細胞;采用EpCAM CAR 載體質粒以及三種包裝質粒(分別為P004、P005、P006 質粒),四種質粒按一定的比例與PEI 轉染試劑,共轉染人胚腎細胞(HEK 293TS)細胞。于CO2濃度為5% 的振蕩培養箱37℃培養。④補料:轉染后7~24 h,分別采用遠泰自制LVBL03 培養基、LVBL04 培養基進行補料。⑤粗毒液收獲:轉染后48 h,收獲所有轉染細胞培養瓶中的細胞懸液,離心后收獲上清即為粗毒液。⑥酶孵育與過濾澄清:加入適量MgCl2溶液、Super Nuclease 核酸酶溶液至粗毒液中孵育后,采用0.45 μm 一次性囊式過濾器進行過濾澄清。⑦Core 700 層析:采用Capto Core 700 填料層析柱,連接層析柱到AKTA pure-150M 層析系統上。平衡:采用遠泰自制LVPH05 溶液1~3 cV,上樣,上樣完成后繼續用LVPH05 溶液進行沖洗1~3 cV。層析方法線性流速≥120 cm/h,紫外收集信號波段為A280 200 mAU~200 mAU。⑧濃縮換液、除菌過濾、制劑分裝:收獲層析洗脫液后選取合適規格的中空纖維柱進行濃縮換液,采用0.22 μm 濾器對病毒濃縮液進行除菌過濾,采用遠泰自制LVBC06病毒保存液按比例加入病毒原液中,最后進行無菌分裝,所得EpCAM 慢病毒成品于-80℃冰箱保存。
1.2.5 EpCAM 慢病毒檢測方法 在生產過程中可根據產品需求對慢病毒粗毒液、終末細胞、慢病毒原液、慢病毒成品等進行相關檢測,如復制型慢病毒(RCL)、轉導滴度、P24 抗原滴度、宿主DNA 殘留、宿主蛋白殘留、目的基因鑒別、核酸酶殘留、質粒DNA 殘留、猿猴病毒40 大T 抗原(SV40LTA)和腺病毒早期區域1A 蛋白(E1A)殘留、內毒素、無菌、支原體等檢測項目。本文主要呈現轉導滴度檢測方法:采用檢定用HEK 293T細胞進行24 孔鋪板,取EpCAM 慢病毒成品樣本進行梯度稀釋,根據對慢病毒樣品轉導滴度的估計,先將病毒稀釋到適當濃度,然后每步2~5 倍依次進行梯度稀釋,使轉導后的檢定細胞的陽性率檢測值落在取值可信范圍內;將各梯度稀釋的慢病毒樣本接種到HEK 293T 細胞中,約20~24 h補加培養基,約48 h 收獲感染細胞進行流式檢測。
2 結果
2.1 EpCAM 單抗制備及檢測
采用EpCAM 蛋白進行小鼠免疫及測血、加強免疫及融合、雜交瘤的擴增和篩選、有限稀釋單克隆化及擴大培養[經過有限稀釋和篩選,最后得到的克隆為7B5(7B5C10)]、陽性克隆細胞(7B5)凍存與抗體生產,最終獲得EpCAM 單克隆抗體(7B5),為驗證EpCAM 單抗(7B5)的特異性,進行ELISA/WB/FCM/IHC 等檢測。
2.1.1 EpCAM 單抗(7B5)ELISA 檢測結果 根據不同的EpCAM 蛋白抗原包被濃度10 ng/50 ng/100 ng,使用EpCAM 小鼠單克隆抗體(7B5)為一抗,圖1 可見該抗體與EpCAM 蛋白抗原特異性結合陽性反應的最大濃度為1∶105,該抗體的ELISA 效價為1∶105。
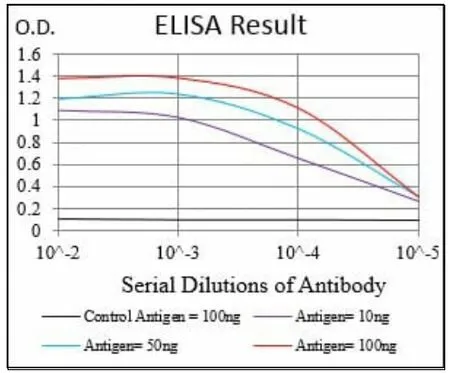
圖1 使用EpCAM 小鼠單克隆抗體(7B5)進行ELISA 檢測
2.1.2 EpCAM 單抗(7B5)Western blot 檢測結果采用HCT116 人結腸癌細胞(泳道1)、HT-29 人結腸癌細胞(泳道2)、SW480 人結腸癌細胞(泳道3)、Sw620 人結腸癌細胞(泳道4)、T47D 人乳腺管癌細胞(泳道5),五種細胞裂解液進行的EpCAM 小鼠單克隆抗體(7B5)的WB 分析。圖2可見不同的細胞裂解液用EpCAM 小鼠單克隆抗體進行免疫印跡后均在40 kDa 目的分子量條帶處出現了特異性條帶。
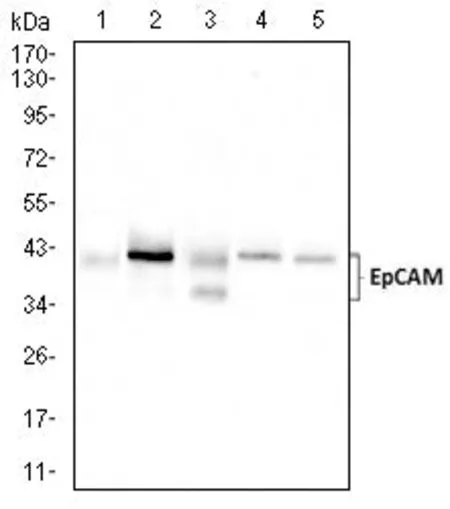
圖2 使用EpCAM 小鼠單克隆抗體(7B5)進行WB 分析
2.1.3 EpCAM 單抗(7B5)Flow cytometric 檢測結果 采用EpCAM 小鼠單克隆抗體(7B5)(綠色)和陰性對照(紅色)對Lovo 人結腸癌細胞進行FCM 分析,圖3 可見在Lovo 人結腸癌細胞中有明顯陽性表達。
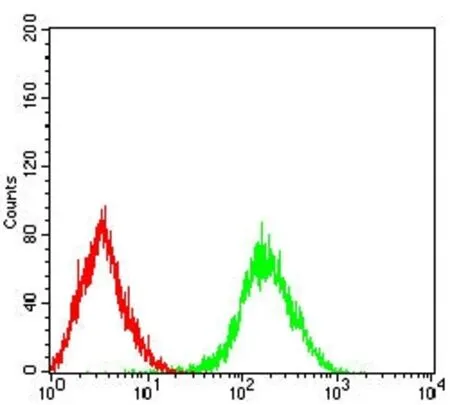
圖3 使用EpCAM 小鼠單克隆抗體(7B5)進行FCM 分析
2.1.4 EpCAM 單抗(7B5)免疫組織化學檢測結果 石蠟包埋癌癥組織使用EpCAM 小鼠單克隆抗體DAB 染色,圖4 可見在人宮頸癌和人食管癌組織的細胞漿膜陽性染色,間質可見少許非特異染色。同時筆者在其他的人病理組織芯片廣篩可見食道癌,胃癌,結腸癌,結腸癌旁組織,直腸癌,直腸癌旁組織,肝癌,肺癌,乳腺癌,卵巢癌也可見細胞漿膜陽性染色。
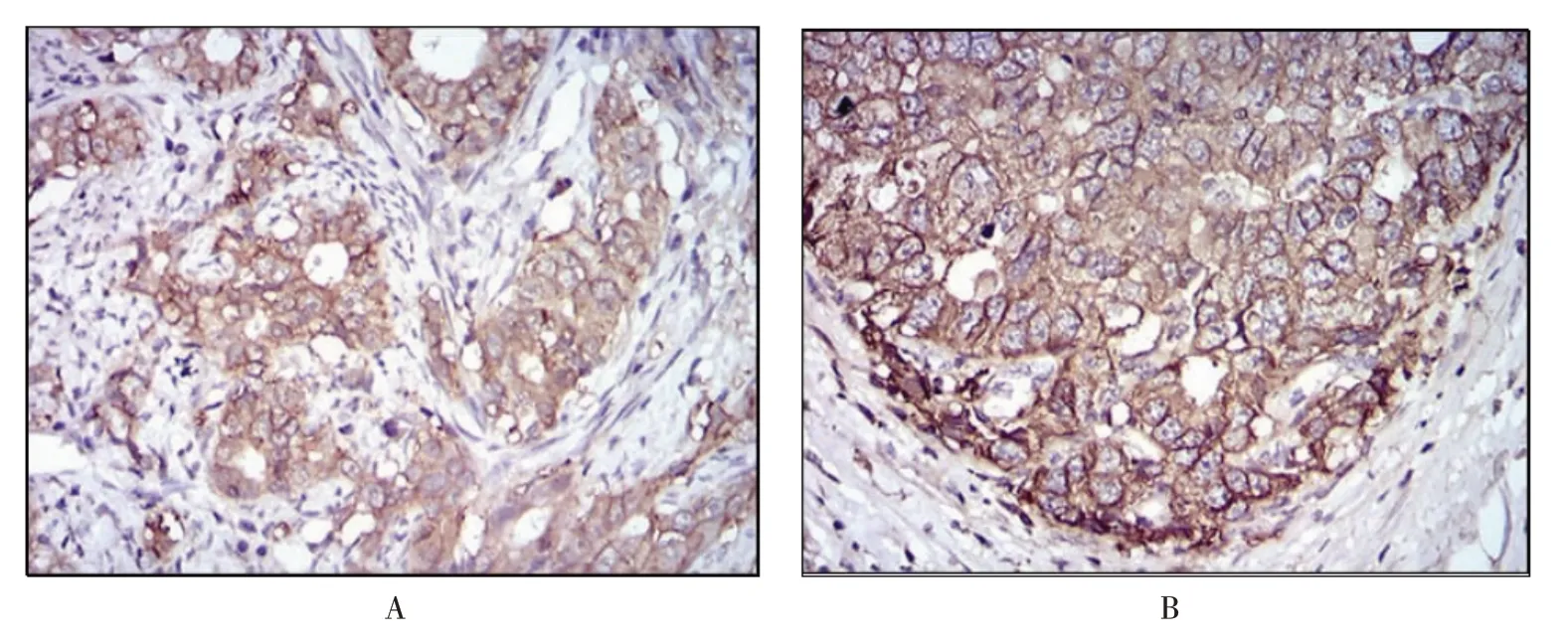
圖4 使用EpCAM 小鼠單克隆抗體(7B5)進行免疫組織化學檢測
2.2 EpCAM CAR 質粒構建及制備
編碼人源化EpCAM 特異性CAR 的慢病毒載體質粒由ProMab USA 設計與合成,命名為PL376質粒,見圖5。經質粒上游菌種發酵及下游層析純化等工藝收獲質粒成品后,送檢成品質粒DNA 至上海生工測序,使用“NCBI 在線標準核苷酸匹對工具”與標準序列匹對。覆蓋率100%;匹配100%,得出結論:序列完全正確。
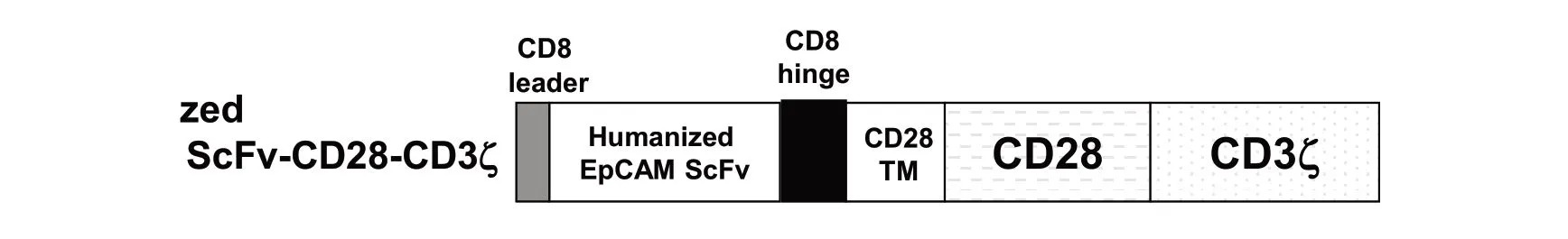
圖5 將人源化EpCAM-ScFv 融合到跨膜和CD28/CD3-zeta T 細胞活化結構域,CAR 構建體EpCAM 被克隆到慢病毒載體中
2.3 EpCAM 慢病毒(LV376)生產
本研究慢病毒生產中的上游病毒包裝部分采用四質粒系統,包括載有目的基因的重組穿梭質粒(即EpCAM CAR 載體質粒)以及三種包裝質粒(分別為pGag/Pol、pRev、pVSV-G),四種質粒按一定的比例與PEI 轉染試劑,共轉染HEK 293T 自主馴化懸浮細胞,48 h 后經離心收獲慢病毒粗毒液2 000 mL,粗毒液經核酸酶孵育、過濾澄清、COR700 層析、濃縮換液、除菌過濾、制劑分裝等工序獲得EpCAM 慢病毒成品,最終收獲單批次成品體積為100 mL。該生產規模可根據產業化需求放大至100~1 000 mL。
2.4 EpCAM 慢病毒(LV376)成品轉導滴度檢測結果
感染EpCAM 慢病毒(LV376)48 h 后收獲HEK 293T 細胞進行流式檢測,轉染EpCAM 慢病毒倍數分別為125×、625×、3125×、15625×,其陽性表達分別為 92.31%、25.10%、6.90%、0.92%,通過慢病毒滴度檢測計算公式,該檢測批次LV376 慢病毒轉導滴度為2.16×108TU/mL,該批次收獲成品體積為100 mL,即該批次收獲慢病 毒總量為2.16×1010TU。見圖6。
3 討論
雖然CAR-T 治療在血液學腫瘤中取得了很大的進展,但CAR-T 治療在實體腫瘤[10]中仍存在許多問題和局限性。同時CAR-T 治療中為了產生可滿足臨床方案中較多的目的基因工程化T 細胞,具備成本效益的慢病毒載體的大量生產顯得尤為關鍵。
本研究成功制備了在人宮頸癌、人食管癌、人結腸癌等癌組織中有高度表達的特異性EpCAM鼠單抗,并采用EpCAM 陽性單克隆細胞株可變區測序,構建了編碼人源化EpCAM 特異性CAR 的慢病毒載體質粒,結合完整的慢病毒懸浮生產工藝,生產出高滴度高純度的靶向EpCAM 嵌合抗原受體慢病毒,該慢病毒生產工藝可根據產業化需求放大至10×1010~10×1011TU 慢病毒總量,為EpCAM CAR-T 細胞治療實體瘤應用及其產業化奠定基礎。

