心力衰竭相關中樞型睡眠呼吸暫停綜合征的危險因素探討
張真琪, 陳 鵬
(四川省成都市第三人民醫院, 1. 麻醉科, 2. 呼吸與危重癥醫學科, 四川 成都, 610000)
心血管疾病患者發生睡眠呼吸障礙會影響生活質量,其中睡眠呼吸障礙、睡眠時間縮短和睡眠質量降低在心力衰竭(簡稱心衰)患者中經常發生。研究[1]認為,睡眠呼吸障礙、睡眠時間縮短和睡眠質量降低等與心血管疾病導致的交感過度激活、血流動力學不穩定以及低氧血癥等有關。大多數研究納入的多數患者為左心衰患者,右心衰患者睡眠障礙的相關臨床研究數據較少,尤其缺乏右心衰患者中樞型睡眠呼吸暫停綜合征(CSAS)的真實發病率數據,中國心衰相關CSAS數據更加匱乏。心衰相關睡眠呼吸障礙的發生率在成年男性與女性中分別為49.7%和23.4%, 因此研究中國心衰相關CSAS的發病情況具有現實意義。本研究納入不同類型心衰患者,篩查CSAS的陽性率,并分析潛在致病因素,探討心衰相關CSAS可能的發病機制,現報告如下。
1 資料與方法
1.1 一般資料
選取2020年6月1日—2023年1月1日在呼吸科和心內科住院的78例患者為研究對象,其中左心衰39例(擴張型心肌病20例,冠狀動脈粥樣硬化性心臟病19例),右心衰39例(均為慢性阻塞性肺疾病所致肺源性心臟病),按照收治時間順序入組,直至采集到預定樣本量。納入標準: ① 心臟彩超和胸科影像學檢查結果符合心衰穩定期表現,其中右心衰患者需同時符合肺功能檢查結果; ② 右心衰患者符合《射血分數保留的心力衰竭診斷與治療中國專家共識2023》[2]中的診斷標準,且符合肺源性心臟病相關標準,且階段為C, 即“出現心功能不全或結構性變化,伴有體液潴留、運動耐量下降、疲勞、心悸等右心衰癥狀和(或)體征”。排除標準: ① 急性心衰發作未控制者; ② 合并糖尿病、甲狀腺功能異常等內分泌系統疾病者; ③ 全心衰者; ④ 有肺栓塞、哮喘、支氣管擴張等呼吸系統疾病者; ⑤ 嚴重腎功能不全者; ⑥ 肥胖引起的低通氣綜合征者; ⑦ 有神經肌肉疾病者; ⑧ 近3個月內有急性心肺腦血管事件(包括急性心梗、腦血管意外)者; ⑨ 超聲證實存在右心受累的擴張型心肌病者。所有入選患者均簽署了知情同意書,本研究通過醫院倫理委員會審批。
1.2 方法
1.2.1 心臟彩超和血氣分析: 左心衰患者通過彩色超聲測定左室射血分數(EF)以評估左心收縮功能。右心三維結構復雜,因此不適宜單純測定右心室EF。本研究分別從右心結構和右心功能2個維度來評價: 通過右室前壁厚度以量化右心結構,通過三尖瓣環收縮期位移(TAPSE)和三尖瓣環收縮期峰值流速(S′)以間接量化右心收縮功能。白天清醒狀態下抽取患者動脈血以測定血二氧化碳分壓[pa(CO2)]基線水平。
1.2.2 睡眠監測及事件判定: 采用瑞思邁APL系列和飛利浦NightOne系列睡眠儀(第3級睡眠監測設備)進行睡眠監測。呼吸暫停判讀規則: ① 滿足氣流傳感器信號曲線峰值較事件前基線值下降≥90%, 且氣流下降≥90%的信號持續事件≥10 s判讀為呼吸暫停; ② 如果滿足呼吸暫停標準,并且在整個氣流缺失期間存在持續或逐漸增加的努力吸氣則判讀為CSAS; ③ 如果滿足呼吸暫停標準,且整個氣流缺失期間不存在努力吸氣,判讀為CSAS。判定存在中樞事件的條件為發生CSAS>5次/h。
1.3 統計學分析

2 結 果
2.1 2組基線資料比較
右心衰組患者年齡高于左心衰組,差異有統計學意義(P<0.05); 2組體質量指數(BMI)、pa(CO2)、性別以及吸煙史等一般資料比較,差異無統計學意義(P>0.05), 見表1。
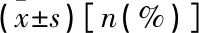
表1 2組各項基線資料比較
2.2 單因素Logistic回歸分析
選取年齡、BMI、性別、吸煙史、陳-施呼吸、心衰部位、pa(CO2)、腦鈉素前體(NT-proBNP)、總膽固醇(TC)、甘油三酯(TG)、高密度脂蛋白膽固醇(HDL-C)、低密度脂蛋白膽固醇(LDL-C)等13個指標為自變量,以發生CSAS為應變量,進行單因素非條件Logistic回歸分析。各自變量的啞變量賦值見表2,由于本研究樣本量較少,為配合后續多因素Logistic回歸穩健,各指標均為或轉化為兩分類變量。回歸結果如表3所示。左心衰、年齡≥60歲以及pa(CO2)基線水平<39 mmHg差異有統計學意義(P<0.05)。

表2 Logistic回歸啞變量賦值

表3 單因素Logistic回歸分析結果
2.3 多因素Logistic回歸分析
自變量選取單因素分析結果中P<0.05的指標,即左心衰、年齡≥60歲、pa(CO2)基線水平<39 mmHg。采用逐步后退法回歸,設定P剔除=0.10,P入選=0.05。Logistic回歸結果顯示,左心衰,年齡≥60歲以及pa(CO2)基線水平<39 mmHg 3個變量被納入多因素Logistic回歸方程,見表4。

表4 多因素Logistic回歸分析結果
2.4 心衰部位、年齡及pa(CO2)基線水平對心衰患者的CSAS的預測效能
以發生呼吸暫停者(n=37)為陽性樣本,以未發生者(n=41)為陰性樣本,建立ROC預測分析模型。繪制心衰部位、年齡及pa(CO2)單獨應用的ROC曲線圖(折線ROC圖),折點為約登指數點,按照實測樣本計算靈敏度、特異度、準確度。聯合應用(LogP模式): 構建風險預測模型,以Ln(P/1-P)=-0.137 +0.274×心衰部位 +0.544×年齡 +-0.188×pa(CO2)基線水平為聯合應用的虛擬概率量指標,繪制ROC曲線。在ROC曲線中確定約登指數點,按實測樣本計算靈敏度、特異度、準確度。 結果顯示,心衰部位、年齡及pa(CO2)基線水平及聯合應用預測心衰患者的CSAS發病的曲線下面積(AUC)分別為 0.677、0.705、0.705、0.815, 其中聯合應用預測模型有更好的預測價值,AUC及靈敏度、特異度、準確度均高于單獨指標檢測,見表5和圖1。

圖1 心衰部位、年齡及pa(CO2)基線水平單獨及聯合應用預測心衰患者的CSAS發病的ROC曲線

表5 心衰部位、年齡及pa(CO2)基線水平及聯合應用對心衰患者CSAS發病的預測效能
2.5 左心衰組和右心衰組部分特征指標
右心衰組呼吸暫停3例,均發生于輕度TAPSE和S′下降的患者,右室前壁厚度(6.05±0.65) mm, TAPSE(12.23±1.23) mm, S′為(10.19±0.86) cm/s。左心衰組呼吸暫停18例,左室EF為(44.86±5.10)%。
3 討 論
睡眠呼吸暫停綜合征是睡眠呼吸障礙中最為常見的疾病,包括阻塞性睡眠呼吸暫停和CSAS。中重度慢性阻塞性肺疾病患者的睡眠呼吸暫停低通氣綜合征患病率高達65.9%,而住院的慢性阻塞性肺疾病急性加重期患者的睡眠呼吸暫停篩查陽性率高達51.4%[3-5]。CSAS與心衰高度相關,在心衰患者中CSAS的發生至少具備3個條件,即信號延遲、環路增益大于1和臨界的pa(CO2)驅動閾值。左心衰患者左心室EF的下降,導致循環效率的下降,呼吸中樞化學感受器接受到pa(CO2)和H+水平變化的信號存在延遲; 心衰患者呼吸中樞反饋處于高敏感狀態,極易發生過度反饋,即符合環路增益大于1的條件; 部分患者長期基線pa(CO2)水平正常偏低,接近呼吸中樞驅動閾值的下限,因此一旦發生過度反饋,將導致pa(CO2)水平低于閾值,從而發生呼吸暫停,即符合臨界的驅動閾值條件。研究[6-7]認為左心衰患者更容易發生CSAS, 而右心衰則并不直接導致信號延遲,所以傾向認為右心衰不容易發生睡眠呼吸暫停。然而,正常EF的心衰患者中仍可發現大量CSAS[8], 因此上述觀點被質疑,但本研究左心衰患者發生呼吸暫停的占比為46.15%, 右心衰患者為7.69%, 且CSAS傾向發生于EF下降的患者。同樣, BOKOV P等[9]發現,不存在心衰相關循環效率下降的阻塞性睡眠呼吸暫停患者中也存在高環路增益,可見上述問題與過多地關注Loop Gain理論對信號延遲的依賴性有關,但心臟射血到達頸動脈竇和主動脈弓化學感受器的路徑很短[10],信號傳遞的延遲造成的影響可能有限[11],且肺源性心臟病右心衰的患者由于肺氣腫的存在,肺泡牽張同樣激活J受體和迷走神經C纖維感受器以及本病慢性缺氧兒茶酚胺的釋放繼發交感興奮[12],同樣導致環路增益大于1。本研究提出CSAS發生的核心條件應為患者基線pa(CO2)水平偏低,接近呼吸中樞驅動閾值的下限,據此推測,右心衰患者同樣存在CSAS的發生風險。由于CO2的彌散能力為O2的21倍,故疾病早期肺血管收縮并不影響CO2排出,反而由于繼發的肺血管壓力上升導致CO2彌散入肺泡排出的效率提高[13]。因此,一定程度的右心阻力負荷增加反而可能誘發pa(CO2)水平偏低,一旦低于呼吸中樞驅動閾值的下限則發生CSAS[14]。
本研究采用右心室前壁厚度小于6 mm量化右心結構受損程度,采用TAPSE≥14 mm以及S′>11 cm/s量化右心收縮功能受損程度[15]。結果表明,右心衰陽性病例均出現在右心結構和功能輕度受損的患者,與上述推測相符。本研究創新性在于在檢測右心結構的基礎上,同時檢測更加敏感的反映右心功能的指標TAPSE和S′, 但本研究中TAPSE和S′只提示了發病率差異存在,尚不能直接獲取ROC曲線,提示需要注意樣本量偏倚,需要更大樣本量再次進行評估,才有可能獲取ROC。
綜上所述,低左心室EF相關的信號延遲可能并非心衰患者發生CSAS的核心因素,呼吸暫停的發生與因各種原因導致的低pa(CO2)基線水平相關。對呼吸類型及相對低pa(CO2)基線水平的心衰患者需及時進行睡眠監測,早期干預呼吸暫停,防止呼吸暫停進一步惡化心衰狀況。本研究結果有待于進行更大樣本量的多中心研究進一步驗證和發現右心衰睡眠呼吸暫停的相關因素。

