基于熵權(quán)TOPSIS 模型對(duì)白芨多糖脫蛋白體系的評(píng)價(jià)研究
袁高陽,秦心睿,聶曉兵,金文芳,楊玉玉,劉詩菡,范寶磊,苗瀟磊,3,*
(1.湖北科技學(xué)院藥學(xué)院,湖北咸寧 437100;2.輻射化學(xué)與功能材料湖北省重點(diǎn)實(shí)驗(yàn)室,湖北咸寧 437100;3.湖北省智慧康養(yǎng)產(chǎn)業(yè)研究院,湖北咸寧 437100)
白芨(Bletilla striata)最早出現(xiàn)于2000 年前的《神農(nóng)本草經(jīng)》,它屬于蘭科植物,在傳統(tǒng)中藥(TCM)中被廣泛使用,是中醫(yī)藥著名的植物之一[1]。白芨多糖(BSP)已被證實(shí)是白芨生物功能中最重要的成分,現(xiàn)代藥理學(xué)表明BSP 具有廣泛的生物活性,如抗?jié)儭⒅寡猍2]、抗炎[3]、抗氧化[4]、抗菌、抗纖維化[5]和抗衰老[6]等,在醫(yī)療、美容等方面具有較好的研究前景。
目前國內(nèi)多糖純化多采用Sevage 法[7]、鹽酸法、三氯乙酸法、重復(fù)凍融法、蛋白酶法[8]、鹽析法等。對(duì)于脫除多糖蛋白效果的評(píng)價(jià)大多只以多糖回收率和蛋白脫除率為指標(biāo),近年來何思辰等[9]、王瑩等[10]、李媛媛等[11]將體外抗氧化活性與多糖結(jié)構(gòu)表征也作為其效果的重要指標(biāo),增強(qiáng)了多糖脫蛋白評(píng)價(jià)的科學(xué)性和全面性,得到了醫(yī)藥行業(yè)廣泛的認(rèn)可。但多糖脫蛋白評(píng)價(jià)指標(biāo)數(shù)量多且各指標(biāo)重要程度未知,以至于目前的研究結(jié)果大多具有主觀性和特殊性,對(duì)各指標(biāo)的評(píng)價(jià)標(biāo)準(zhǔn)缺乏統(tǒng)一。因此,建立一種科學(xué)、操作性強(qiáng)、并且具有普遍性的多糖脫蛋白綜合評(píng)價(jià)系統(tǒng),對(duì)各種多糖脫蛋白方案進(jìn)行綜合評(píng)價(jià)是目前迫切需要解決的問題。
TOPSIS 法又稱逼近理想解排序法[12],是一種多目標(biāo)決策算法,多用于中藥藥材的質(zhì)量綜合評(píng)估[13-15],近年來在糧食安全[16]、電力[17]、礦業(yè)[18]、軍事領(lǐng)域[19]也有較多應(yīng)用。如圖1 所示本研究采用三種方法(Sevage 法、乙腈法、TCA 法)對(duì)白芨多糖進(jìn)行處理,從蛋白質(zhì)脫除率和多糖保留率進(jìn)行評(píng)價(jià),同時(shí)考察其在結(jié)構(gòu)和抗氧化活性方面的差異;不同于陳浩瑩等[20]主觀比較不同脫蛋白方法對(duì)白芨多糖的影響和效果的評(píng)價(jià)思路,本研究利用熵權(quán)TOPSIS 模型,將白芨多糖脫蛋白各項(xiàng)指標(biāo)統(tǒng)一為一個(gè)體系,對(duì)其進(jìn)行客觀評(píng)價(jià),結(jié)果更具有說服力,為未來白芨多糖純化的評(píng)價(jià)研究提供新的思路。
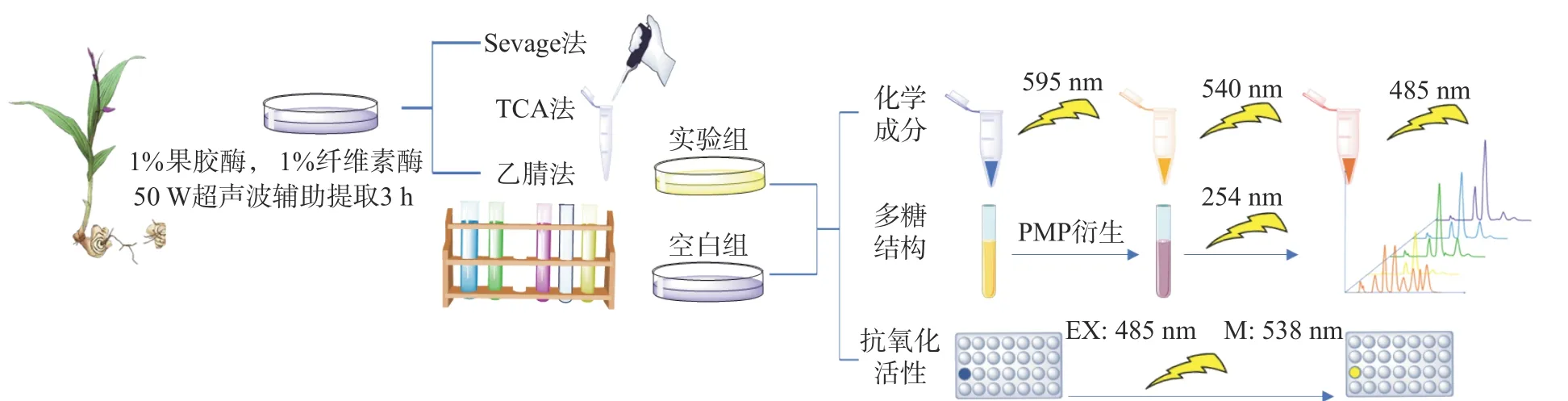
圖1 BSP 脫蛋白的概念流程圖Fig.1 Conceptual flowchart of BSP deproteinization
1 材料與方法
1.1 材料與儀器
白芨 于2022 年9 月采摘,安徽省亳州市陽光新科藥材種苗生產(chǎn)有限公司;纖維素酶(15000 U/g)、果膠酶(50 U/g) 國藥集團(tuán)化學(xué)試劑有限公司;標(biāo)準(zhǔn)品甘露糖(Man)、木糖(Xyl)、D-葡萄糖(Glc)、半乳糖(Gal)、鼠李糖(Rha)、1-苯基-3-甲基-5-吡唑啉酮(PMP) 上海阿拉丁生化科技股份有限公司;3,5-二硝基水楊酸、酒石酸鉀鈉、考馬斯亮藍(lán)G-250 染色液、無水四硼酸鈉、正丁醇、1,1-二苯基-2-苦基肼(DPPH)、牛血清蛋白(BSA)、苯甲基磺酰氯、三氯乙酸、奎諾二甲基丙烯酸酯(Trolox)、偶氮二異丁脒鹽酸鹽(AAPH)、熒光素鈉 分析純,上海麥克林生化科技有限公司。
HPLC-16 高效液相色譜儀、UV-2700 紫外分光光度計(jì)、IRAffinity-1 紅外吸收光譜儀 島津儀器有限公司;Biotek synergy2 多功能酶標(biāo)儀 美國伯騰儀器有限公司;LGJ-10A 冷凍干燥器 上海賀帆儀器有限公司;HR/20M 冷凍離心機(jī) 湖南赫西儀器裝備有限公司。
1.2 實(shí)驗(yàn)方法
1.2.1 白芨粗多糖的提取 參考Zhao 等[21]的方法使用500 mL 90%乙醇作為溶劑對(duì)100 g 白芨粉末進(jìn)行預(yù)處理4 h,以去除色素等乙醇可溶性成分。過濾后,收集殘留物在真空干燥箱55 ℃下干燥,將干燥后的白芨粉末索氏提取6 h 除去脂肪,再次置于真空干燥箱中于50 ℃將有機(jī)溶劑充分揮發(fā),得到預(yù)處理的白芨粉末。
將預(yù)處理的白芨粉末(20 g)和去離子水(1:30,w/v)溶解,加入相當(dāng)于1%的果膠酶和纖維素酶(pH=5)在35 ℃、80 W 功率超聲提取3 h,在此期間不斷攪拌,結(jié)束后過濾,取濾液使用旋轉(zhuǎn)蒸發(fā)儀濃縮體積至初始體積的1/3,向濃縮后的提取液中添加4 倍提取液體積的無水乙醇,4 ℃靜置12 h,過濾后用無水乙醇洗滌,去離子水溶解,將水相用去離子水在25 ℃下透析48 h(截留相對(duì)分子質(zhì)量3600 Da)后在-37 ℃冷凍干燥12 h 后得到粗白芨多糖。
1.2.2 白芨粗多糖脫蛋白方法的初步篩選 配制質(zhì)量濃度為10 g/L 的粗白芨多糖水溶液。分別用TCA 法、Sevage 法、乙腈法脫除BSP 中的蛋白質(zhì),以多糖保留率和蛋白脫除率綜合評(píng)分來篩選每種脫蛋白方法的最佳條件。
1.2.2.1 不同脫蛋白方法設(shè)計(jì) a.Sevage 法:參考Chaubey 等[22]的方法,取5 組質(zhì)量濃度為10 g/L 的BSP 水溶液50 mL,加入等體積的4:1 氯仿-正丁醇溶液,分別萃取1、2、3、4、5 次,6000 r/min 離心30 min 取上清液,將水相清液用去離子水在25 ℃下透析 48 h(截留相對(duì)分子質(zhì)量3600 Da)后在-37 ℃下冷凍干燥 12 h,得到5 組精制的白芨多糖樣品,分別記為Q1、Q2、Q3、Q4、Q5,再進(jìn)行后續(xù)實(shí)驗(yàn)。
b.乙腈法:參考冷桃花等[23]的方法取5 組質(zhì)量濃度為10 g/L 的BSP 水溶液50 mL,分別加入濃度為20%、40%、60%、80%、100%等體積的乙腈溶液,攪拌30 min,放入冰箱4 ℃靜置12 h,取出后6000 r/min 離心30 min 取上清液,將水相清液用去離子水在25 ℃下透析48 h(截留相對(duì)分子質(zhì)量3600 Da)后在-37 ℃下冷凍干燥12 h,得到5 組精制的白芨多糖樣品,分別記為H1、H2、H3、H4、H5,再進(jìn)行后續(xù)實(shí)驗(yàn)。
c.TCA 法:參考楊培等[24]的方法取5 組質(zhì)量濃度為10 g/L 的BSP 水溶液50 mL,分別加入濃度為2%、5%、10%、15%、20%等體積的三氯乙酸溶液,攪拌30 min,放入冰箱4 ℃靜置12 h,取出后6000 r/min離心30 min 取上清液, 將水相清液用去離子水在25 ℃下透析 48 h(截留相對(duì)分子質(zhì)量 3600 Da)后在-37 ℃下冷凍干燥 12 h,得到5 組精制的白芨多糖樣品,分別記為W1、W2、W3、W4、W5,再進(jìn)行后續(xù)實(shí)驗(yàn)。
1.2.2.2 多糖保留率的計(jì)算 多糖含量參考Chen等[25]以總糖含量減去可溶性糖含量來計(jì)算。按式(1)計(jì)算多糖保留率。
a.總糖:參考Qin 等[26]的方法,葡萄糖作為標(biāo)準(zhǔn)品。繪制回歸方程y=5.9037x+0.3751(R2=0.9991);通過回歸方程計(jì)算樣品總糖含量。
b.可溶性糖:參考《NY/T 2742-2015》測(cè)定,以葡萄糖作為標(biāo)準(zhǔn)品。繪制回歸方程y=2.0161x+0.0387(R2=0.9992),通過回歸方程計(jì)算樣品可溶性糖含量。
式中:PO為多糖保留率(%);a1為樣品脫除蛋白前總糖的質(zhì)量濃度(mg/mg);a2為樣品脫除蛋白后總糖的質(zhì)量濃度(mg/mg);b1為樣品脫除蛋白前可溶性糖的質(zhì)量濃度(mg/mg);b2為樣品脫除蛋白后可溶性糖的質(zhì)量濃度(mg/mg)。
1.2.2.3 蛋白質(zhì)脫除率的計(jì)算 蛋白質(zhì)采用考馬斯亮藍(lán)法[27]測(cè)定,以牛血清白蛋白(BSA)作為標(biāo)準(zhǔn)品。繪制回歸方程y=3.5184x+0.4851(R2=0.9958),通過回歸方程計(jì)算樣品蛋白質(zhì)含量;按照式(2)計(jì)算蛋白質(zhì)脫除率。
式中:PR為蛋白質(zhì)脫除率(%);c1為樣品脫除蛋白前蛋白質(zhì)的質(zhì)量濃度(mg/mg);c2為樣品脫除蛋白后蛋白質(zhì)的質(zhì)量濃度(mg/mg)。
1.2.3 綜合評(píng)分的計(jì)算 本實(shí)驗(yàn)采取加權(quán)計(jì)算法,測(cè)定了Sevage 法、乙腈法、TCA 法不同處理?xiàng)l件的精制白芨多糖樣品的多糖保留率、蛋白質(zhì)脫除率,以綜合評(píng)分[28]作為各脫蛋白方法蛋白質(zhì)脫除效果的評(píng)價(jià)指標(biāo),比較綜合評(píng)分?jǐn)?shù)值大小篩選出最佳條件,通過式(3)計(jì)算。
1.2.4 不同脫蛋白方法最優(yōu)條件下純化白芨粗多糖
根據(jù)1.2.2 得出的各種脫蛋白方法的較優(yōu)條件進(jìn)行脫蛋白處理,通過化學(xué)成分含量、結(jié)構(gòu)表征和抗氧化活性來評(píng)價(jià)其影響評(píng)價(jià)其純化效果。
1.2.5 多糖結(jié)構(gòu)
1.2.5.1 BSP 單糖含量測(cè)定 BSP 單糖的測(cè)定參考甘小鳳等[29]的PMP 柱前衍生法,高效液相色譜儀(HPLC)配島津InertsilODS-3(250 mm×4.6 mm,5 μm)色譜柱;配備型號(hào)為SPD-16 紫外檢測(cè)器;流動(dòng)相為0.05 mol/L 磷酸鹽緩沖液(含0.1%乙酸)(A)-乙腈(B),梯度洗脫:0~10 min,74% A,10~15 min,74%~78% A,15~25 min,78% A,柱溫及檢測(cè)器溫度40 ℃;體積流量0.8 mL/min;檢測(cè)波長(zhǎng)254 nm;進(jìn)樣量20 μL。使用葡萄糖、果糖、半乳糖、木糖、甘露糖、鼠李糖作為標(biāo)準(zhǔn),各單糖回歸方程、決定系數(shù)、線性范圍見表1。
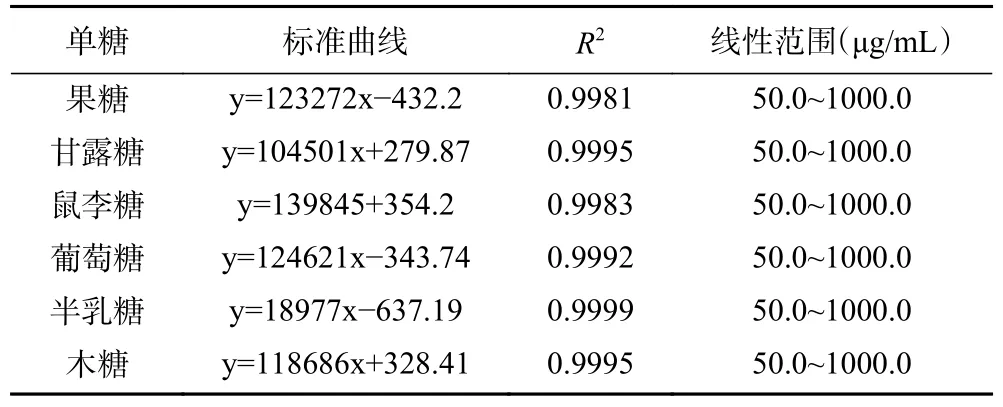
表1 各單糖標(biāo)準(zhǔn)曲線、決定系數(shù)、線性范圍Table 1 Standard curve, determination coefficient, linear range for each monosaccharide
1.2.5.2 UV 測(cè)試 取少量經(jīng)過不同脫蛋白方法處理后的多糖樣品用適量去離子水溶解,用紫外分光光度計(jì)于200~800 nm 進(jìn)行光譜掃描。
1.2.5.3 FTIR 測(cè)試 稱取少量經(jīng)過不同脫蛋白方法處理后的多糖樣品置于研缽中,與干燥的KBr 粉末研磨和壓片。使用傅里葉變換紅外光譜儀進(jìn)行測(cè)試,波數(shù)范圍為4000~400 cm-1。
1.2.6 體外抗氧化活性檢測(cè)
1.2.6.1 DPPH 自由基清除能力評(píng)價(jià) 參考Fan 等[30]的方法測(cè)定多糖樣品自由基半數(shù)清除濃度IC50。配制成不同濃度樣品液(2.0、4.0、6.0、8.0、10.0 mg/mL)各2.0 mL,加入2.0 mL 的DPPH 溶液,混合均勻,避光反應(yīng)30 min 后,在517 nm 波長(zhǎng)下測(cè)定吸光度,用50%體積分?jǐn)?shù)的乙醇調(diào)零,每個(gè)樣品開展3 次平行測(cè)定,取平均值。按式(4)計(jì)算DPPH 自由基清除率:
式中:A0:2.0 mL 50%體積分?jǐn)?shù)乙醇代替多糖溶液的吸光度;A1:不同樣品液的吸光度;A2:2.0 mL 50%體積分?jǐn)?shù)乙醇代替DPPH 的吸光度。
1.2.6.2 氧自由基吸收能力(ORAC)評(píng)價(jià) 參照陳春[31]的方法,試劑和樣品溶液均用磷酸鉀緩沖液(75 mmol/L,pH7.4)配制。在孔板中加入20 μL 多糖樣品溶液或20 μL 不同濃度Trolox 標(biāo)準(zhǔn)液(1.5625、3.125、6.25、12.5、25、50 μmol/L)隨后加入200 μL 熒光素鈉(0.0478 μmol/L)。設(shè)定酶標(biāo)儀搖動(dòng)混合物10 s,并在37 ℃下預(yù)孵化10 min。在每個(gè)孔中加入20 μL AAPH(119.4 mmol/L)后,使用酶標(biāo)儀測(cè)量熒光強(qiáng)度,激發(fā)波長(zhǎng)為485 nm,發(fā)射波長(zhǎng)為538 nm,在37 ℃下每1.5 min 測(cè)定1 次。根據(jù)不同濃度的Trolox 標(biāo)準(zhǔn)溶液中的熒光猝滅凈面積(NETAUC)得到標(biāo)準(zhǔn)曲線Y=4.312X+3.461(R2=0.9985)。ORAC 值以每克樣品中Trolox 的質(zhì)量分?jǐn)?shù)(μmol TE/g)表示。
1.2.7 熵權(quán)TOPSIS
1.2.7.1 評(píng)價(jià)體系設(shè)計(jì) 在參考前人研究[32]的基礎(chǔ)上,分別從化學(xué)成分(I1)、多糖結(jié)構(gòu)(I2)、體外抗氧化活性(I3)3 個(gè)層面出發(fā),設(shè)計(jì)了包括總糖保留率、還原糖保留率、蛋白脫除率等在內(nèi)的9 個(gè)具體指標(biāo)構(gòu)成的不同方法脫蛋白評(píng)價(jià)體系。其中,評(píng)價(jià)指標(biāo)分為正向指標(biāo)和負(fù)向指標(biāo),如 表2 和表3 所示。

表2 白芨多糖除蛋白評(píng)價(jià)體系Table 2 BSP protein removal evaluation system
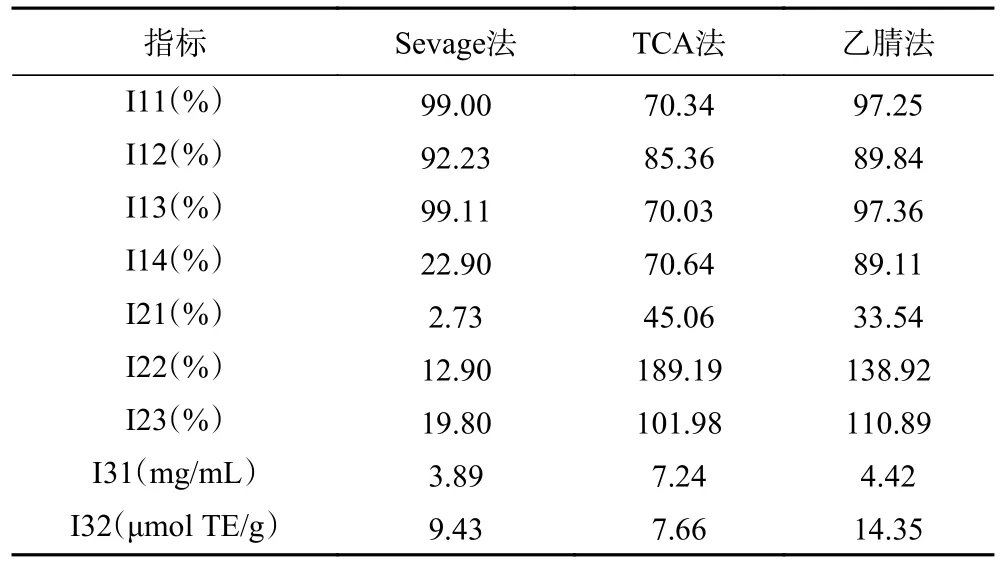
表3 白芨多糖除蛋白評(píng)價(jià)體系各指標(biāo)Table 3 Indexes of the protein removal evaluation system of BSP
1.2.7.2 指標(biāo)計(jì)算與說明 a.化學(xué)成分:供給指標(biāo)共有4 個(gè),以總糖保留率為例,本研究使用的指標(biāo)計(jì)算公式為:
式中:Tx 為總糖保留率;a1為樣品脫除蛋白前總糖的質(zhì)量濃度;a2為樣品脫除蛋白后總糖的質(zhì)量濃度。
b.粗多糖結(jié)構(gòu):本文粗多糖結(jié)構(gòu)的研究表明BSP 主要有葡萄糖、甘露糖、木糖組成,本研究主要以這三種單糖的占比變化為依據(jù)來評(píng)價(jià)。通過相對(duì)變化率來描述各單糖的受影響的強(qiáng)弱,在計(jì)算各單糖變化率時(shí),還應(yīng)考慮其在多糖中的占比。本研究設(shè)計(jì)的反應(yīng)供給指標(biāo)有3 個(gè)。以葡萄糖相對(duì)變化率為例,本研究使用的指標(biāo)計(jì)算公式為:
式中:G 為葡萄糖相對(duì)變化率;G0為脫蛋白處理前葡萄糖占比;G1為脫蛋白處理后葡萄糖占比。
c.體外抗氧化活性:供給指標(biāo)有2 個(gè),以DPPH半數(shù)清除濃度為例,本指標(biāo)的計(jì)算來源為DPPH 清除率達(dá)到50%時(shí)對(duì)應(yīng)的BSP 濃度。
1.2.7.3 歸一化處理 對(duì)原始實(shí)驗(yàn)數(shù)據(jù)進(jìn)行歸一化處理,計(jì)算指標(biāo)性質(zhì)為正,即越大越優(yōu)型(X*ij);計(jì)算指標(biāo)為負(fù),即指標(biāo)越小越優(yōu)型(X*ij)。
式中:Xij表示第i 被評(píng)價(jià)主體中第j 指標(biāo)的原始數(shù)值;表示是第i 個(gè)評(píng)價(jià)對(duì)象中第j 個(gè)指標(biāo)的標(biāo)準(zhǔn)化值;min(Xj)表示該組原始數(shù)值中的極小值;max(Xj)表示該組原始數(shù)值中的極大值。
1.2.7.4 指標(biāo)權(quán)重占比和信息熵的計(jì)算 根據(jù)公式(7)(8)(9)(10)(11)式計(jì)算出各評(píng)價(jià)指標(biāo)的權(quán)重和信息熵。
式中:rij表示計(jì)算第j 項(xiàng)指標(biāo)下第i 個(gè)評(píng)價(jià)對(duì)象的特征比重(貢獻(xiàn)度);yij表示是第i 個(gè)評(píng)價(jià)對(duì)象中第j 個(gè)指標(biāo)的標(biāo)準(zhǔn)化值;m 為評(píng)價(jià)對(duì)象的個(gè)數(shù);n 為評(píng)價(jià)指標(biāo)的個(gè)數(shù);ej為信息熵;wj為權(quán)重。

1.3 數(shù)據(jù)處理
所有實(shí)驗(yàn)重復(fù)3 次,結(jié)果以“平均值±標(biāo)準(zhǔn)差”來表示,數(shù)據(jù)采用IBM SPSS Statistic 26 統(tǒng)計(jì)軟件進(jìn)行分析,圖形采用Origin 2021、ChemDraw 20.0 進(jìn)行繪制,顯著性分析采用ANOVA 法,不同小寫字母表示差異性顯著(P<0.05)。
2 結(jié)果與分析
2.1 綜合評(píng)分及最佳條件的篩選
圖2A 為Sevage 法中不同萃取次數(shù)對(duì)綜合評(píng)分及多糖保留率和蛋白質(zhì)脫除率的影響。由圖中觀察和分析可知,Sevage 法(Q1、Q2、Q3、Q4、Q5)綜合評(píng)分分別為61.01、52.08、52.70、52.43、44.82;隨萃取次數(shù)的增加整體呈下降趨勢(shì),在萃取次數(shù)為1 次時(shí)綜合評(píng)分最高。Sevage 法對(duì)BSP 蛋白質(zhì)具有脫除效果,且蛋白質(zhì)脫除率與萃取次數(shù)呈正相關(guān),隨萃取次數(shù)增加有明顯的上升趨勢(shì),但效率較低,當(dāng)萃取5 次后其脫除率只有55.36%;Sevage 試劑對(duì)BSP 存在損耗作用,保留率與萃取次數(shù)呈負(fù)相關(guān),隨萃取次數(shù)增加有明顯下降趨勢(shì),當(dāng)萃取2 次時(shí)多糖保留率大幅度下降至64.12%。其中的原因可能有以下兩點(diǎn):其一,氯仿對(duì)蛋白變性起主要作用,溶液中的蛋白質(zhì)變性而分離清除蛋白質(zhì)[33],處理次數(shù)越多,脫除率越高;其二,正丁醇對(duì)多糖溶解起一定作用[34],并且在純化過程中,出現(xiàn)乳化現(xiàn)象[35],難免有多糖的損失。
圖2B 為乙腈法中不同濃度乙腈對(duì)綜合評(píng)分及多糖保留率和蛋白脫除率的影響。乙腈法(H1、H2、H3、H4、H5)綜合評(píng)分分別為58.31、80.59、93.24、67.66、65.04;隨乙腈濃度增加先升高后降低,當(dāng)濃度達(dá)到60%時(shí)綜合評(píng)分達(dá)到最高。蛋白脫除率與乙腈濃度呈正相關(guān),隨濃度升高有明顯上升趨勢(shì),濃度達(dá)60%蛋白脫除率高達(dá)85%,并且當(dāng)小于此濃度時(shí),對(duì)于BSP 的損耗現(xiàn)象不明顯,主要體現(xiàn)在具有較高的多糖保留率(>90%)。這可能是由于肽和一些小分子量蛋白能溶于乙腈溶液,而許多大分子蛋白被沉淀出去[36],當(dāng)濃度達(dá)到60%時(shí)大分子沉淀完全,BSP 溶液蛋白質(zhì)含量幾乎不再改變。
圖2C 為TCA 法中不同濃度TCA 對(duì)綜合評(píng)分及多糖保留率和蛋白質(zhì)脫除率的影響。分析可知,TCA 法(W1、W2、W3、W4、W5)綜合評(píng)分分別為68.25、68.87、70.34、65.12、59.84;隨TCA 濃度升高呈現(xiàn)出先升高后降低的趨勢(shì),在TCA 濃度達(dá)到10%時(shí)綜合評(píng)分達(dá)到最高。TCA 試劑對(duì)與BSP 蛋白質(zhì)有明顯的脫除效果,TCA 濃度低于15%時(shí)蛋白質(zhì)脫除率與TCA 濃度呈顯著性相關(guān)(P<0.05),多糖保留率與TCA 濃度呈顯著性相關(guān)(P<0.05);多糖保留率隨TCA 濃度增大而降低,蛋白質(zhì)脫除率隨TCA 濃度增大而升高,而TCA 濃度達(dá)到15%以后變化不明顯。具體原因可能存在以下兩點(diǎn):其一,TCA 與蛋白質(zhì)形成了不溶性鹽,并且TCA 使蛋白質(zhì)構(gòu)象發(fā)生改變,暴露出較多的疏水性基團(tuán)而聚集沉淀[37],質(zhì)量濃度達(dá)到15%時(shí)此現(xiàn)象達(dá)到了飽和;其二,除了游離蛋白質(zhì),TCA 的加入還促進(jìn)了多糖-蛋白質(zhì)復(fù)合物[38]降解,并且隨TCA 量增多加劇了此現(xiàn)象。
比較三種處理方法不同處理?xiàng)l件綜合指標(biāo),對(duì)處理?xiàng)l件的初步篩選,分別選擇Sevage 法萃取1 次;乙腈法乙腈質(zhì)量濃度為60%;TCA 法TCA 質(zhì)量濃度為10%(Q1、H3、W3)進(jìn)行后續(xù)的研究。
2.2 脫蛋白處理對(duì)多糖結(jié)構(gòu)的影響
2.2.1 單糖組成 不同脫蛋白方法處理的BSP 中各單糖高效液相色譜圖及其組分占比如圖3 和表4 所示,未進(jìn)行脫蛋白處理的BSP 主要由葡萄糖和甘露糖組成,并伴有較少量的木糖。各單糖的摩爾占比為18.6:80.39:1.01,其中木糖成分較少。TCA 法、Sevage 法、乙腈法對(duì)BSP 單糖組分均存在影響,Sevage 法更好地保持了各單糖組分的占比,而乙腈法和TCA 法增加了甘露糖占比,減少了葡萄糖占比,對(duì)其各單糖占比影響較大。結(jié)果表明,不同脫蛋白處理對(duì)BSP 的影響不同,Sevage 法純化蛋白能更好地保持各單糖的組分占比。
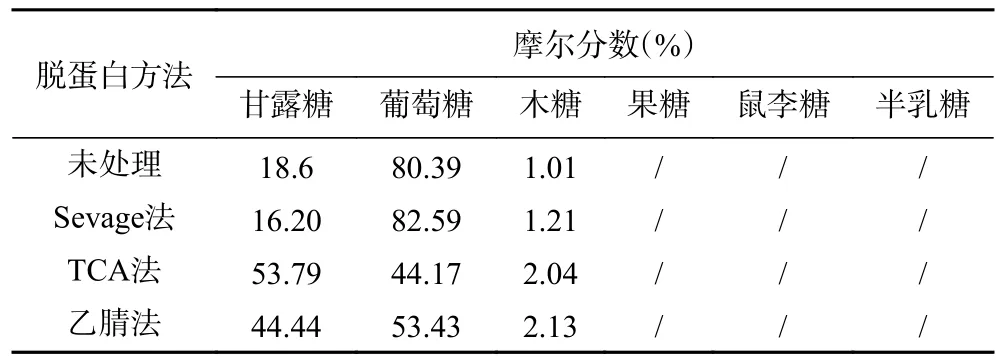
表4 不同脫蛋白方法處理的BSP 中各單糖組分占比Table 4 Proportion of monosaccharide components in BSP treated by different deproteinization methods
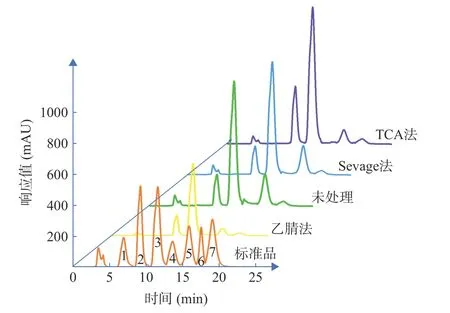
圖3 不同脫蛋白方法處理的BSP 各單糖高效液相色譜圖Fig.3 High performance liquid chromatograms of BSP monosaccharides treated by different deproteinization methods
2.2.2 UV 分析 圖4 為不同脫蛋白處理BSP 的UV 分析圖,未處理組BSP 溶液在280 nm 附近有較強(qiáng)的紫外吸收峰,經(jīng)過三種不同脫蛋白處理紫外吸收強(qiáng)度均有降低。值得注意的是,乙腈法處理的BSP溶液其280 nm 處吸收強(qiáng)度下降最多,其原因可能是蛋白質(zhì)中酪氨酸和色氨酸殘基的苯環(huán)含有共軛雙鍵,所以蛋白質(zhì)溶液在275~280 nm 處具有一個(gè)吸收紫外吸收高峰[39],在一定濃度范圍內(nèi),蛋白質(zhì)溶液在最大吸收波長(zhǎng)處的吸光度與其濃度成正比[40],表明乙腈法對(duì)于BSP 的蛋白脫除效果最好。

圖4 不同脫蛋白方法處理BSP 的UV 分析圖Fig.4 UV analysis plot of BSP treated with different deproteinization methods
2.2.3 FTIR 分析 不同脫蛋白方法處理BSP 的FTIR 譜圖如圖5 所示,各FTIR 圖譜中的吸收峰均表明,出現(xiàn)在3200~3500 cm-1波段是由拉伸振動(dòng)OH 引起的,在約2900 cm-1的弱信號(hào)峰表明C-H 的不對(duì)稱拉伸振動(dòng),出現(xiàn)在1000~1200 cm-1的波段是由吡喃糖中的C-O-C 苷鍵拉伸振動(dòng)[41]引起的。在1600 cm-1處沒有明顯的吸收峰,可以推斷白芨多糖中幾乎不含糖醛酸,799 cm-1和884 cm-1處的吸收峰為甘露糖和葡萄糖殘基,有α-構(gòu)型和β-構(gòu)型的存在[42],這與單糖組成研究的結(jié)果相對(duì)應(yīng)。結(jié)果表明不同脫蛋白方式對(duì)于BSP 的FTIR 圖譜存在影響,但其特征峰基本沒有變化。
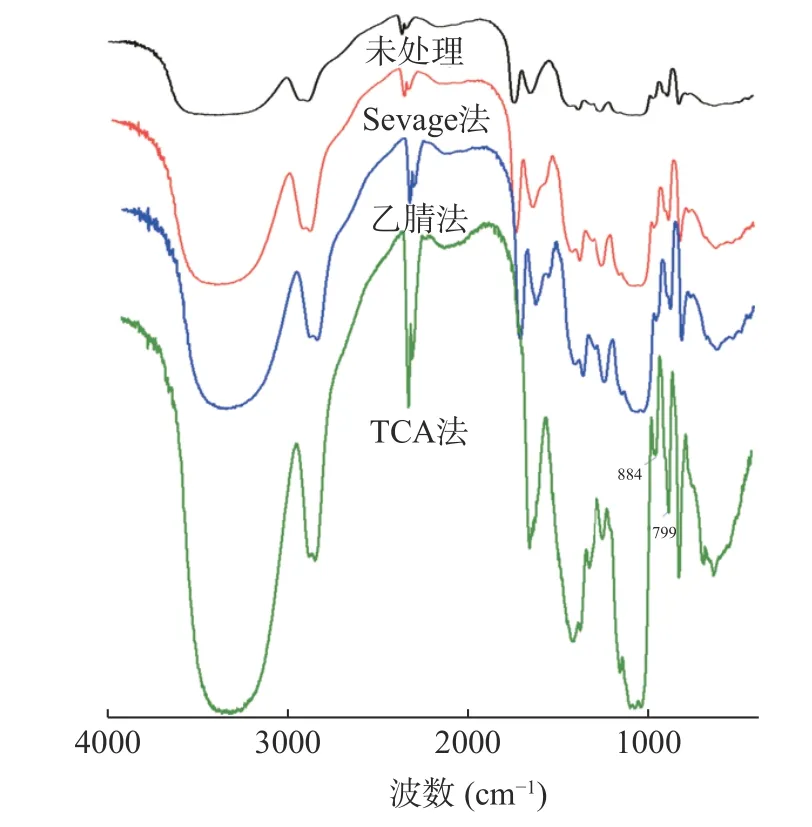
圖5 不同脫蛋白方法處理BSP 的FTIR 譜圖Fig.5 FTIR spectra of different deproteinization methods for BSP
2.3 脫蛋白處理對(duì)多糖體外抗氧化活性的影響
不同脫蛋白方法對(duì)BSP 體外抗氧化活性的影響如圖6 所示。經(jīng)過不同脫蛋白方法處理的BSP 體外抗氧化活性發(fā)生明顯變化,具體體現(xiàn)在DPPH 半數(shù)清除濃度IC50和氧化自由基能力的改變,從強(qiáng)到弱依次為Sevage 法、乙腈法、TCA 法。未進(jìn)行除蛋白處理的BSP 作為陽性對(duì)照組,DPPH 半數(shù)清除濃度IC50為3.78 mg/mL,ORAC 值為12.34 μmol TE/g;值得注意的是乙腈法處理后的BSP 氧化自由基能力顯著高于陽性對(duì)照組(P<0.05)。不同方式處理的BSP在體外抗氧化活性上存在具體差異可能與其BSP 結(jié)構(gòu)的改變[43]和某些多肽物質(zhì)的保留有關(guān),多糖具有-OH、-COOH 等可供氫官能團(tuán),這些官能團(tuán)可以提供氫離子中和自由基中的未配對(duì)電子[44],實(shí)現(xiàn)自由基的清除;分子量較小的多肽因其具有較小的空間位阻,能更好地與自由基發(fā)生反應(yīng)[45],表現(xiàn)出較高的DPPH 自由基清除率,這與有著保留較好多糖結(jié)構(gòu)和較高蛋白含量的Sevage 法處理的白芨多糖的抗氧化活性研究結(jié)果相一致。
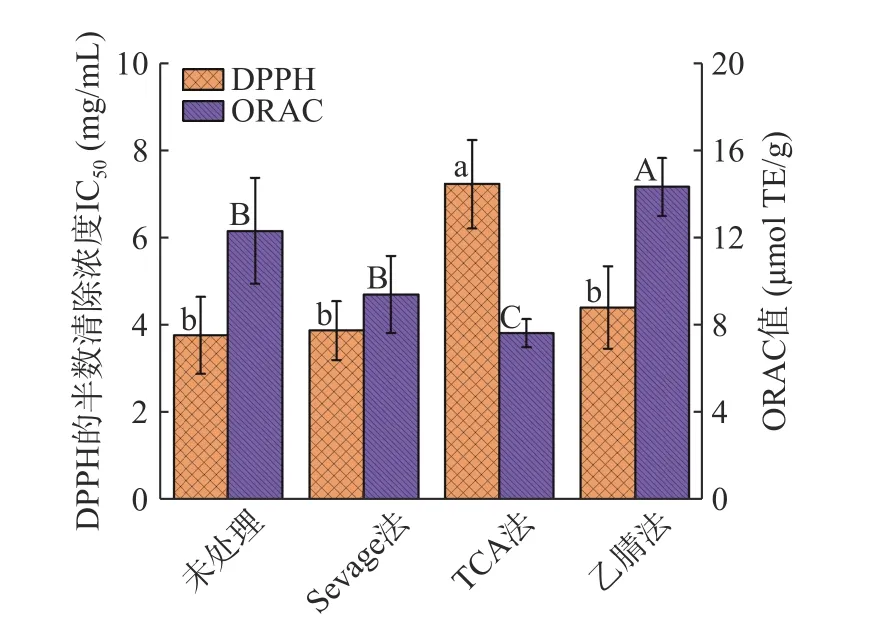
圖6 不同脫蛋白方法處理對(duì)BSP 體外抗氧化活性的影響Fig.6 Effects of different deproteinization treatments on antioxidant activity of BSP in vitro
2.4 熵權(quán)TOPSIS 分析
2.4.1 指標(biāo)權(quán)重占比和信息熵的評(píng)價(jià) 結(jié)果見表5,一級(jí)指標(biāo)中,化學(xué)成分占比最高(38.18%),體外抗氧化活性占比最低(23.12%),二級(jí)指標(biāo)中木糖相對(duì)變化率最高(17.10%),總糖保留率、多糖保留率、葡萄糖相對(duì)變化率占比最低(9.51%)。表明一級(jí)指標(biāo)中化學(xué)成分的變化在脫蛋白評(píng)價(jià)系統(tǒng)中占最重要的因素,而體外抗氧化活性在脫蛋白評(píng)價(jià)體系中重要性偏低;二級(jí)指標(biāo)中總糖保留率、多糖保留率、葡萄糖相對(duì)變化率在評(píng)價(jià)體系中的影響相同,木糖相對(duì)變化率影響最大。

表5 各指標(biāo)權(quán)重占比和信息熵Table 5 Weight ratio and information entropy of each indicator
2.4.2 指標(biāo)TOPSIS 綜合評(píng)價(jià) 結(jié)果見表6,對(duì)各指標(biāo)TOPSIS 綜合評(píng)價(jià),得出三種處理方法的綜合評(píng)價(jià)大小順序?yàn)镾evage 法>乙腈法>TCA 法,其中Sevage 法值最大,說明Sevage 法與理想解最逼近,表明Sevage 法最優(yōu),與秦宇等[46]和楊斌旺等[47]的研究結(jié)果相符,符合預(yù)期結(jié)果。

表6 三種除蛋白方案綜合評(píng)價(jià)Table 6 Comprehensive evaluation of three protein removal regimens
3 結(jié)論
本研究采用三種不同的除蛋白方法,對(duì)BSP 進(jìn)行處理,通過計(jì)算多糖保留率和蛋白質(zhì)脫除率的均值篩選最佳處理?xiàng)l件,同時(shí)對(duì)最佳處理?xiàng)l件得到的三種多糖進(jìn)行多糖結(jié)構(gòu)和抗氧化活性的分析,并對(duì)三種處理?xiàng)l件BSP 進(jìn)行了UV 和FTIR 圖譜表征,最后通過熵權(quán)TOPSIS 法進(jìn)行綜合評(píng)價(jià)。結(jié)果表明:通過綜合評(píng)價(jià)篩選出最佳處理?xiàng)l件為Sevage 法最佳萃取次數(shù)為1 次,此時(shí)的蛋白質(zhì)脫除率為22.9%,多糖保留率為99.11%;乙腈法最佳質(zhì)量濃度為60%,蛋白質(zhì)脫除率為89.11%,多糖保留率為97.36%;TCA 法最佳質(zhì)量濃度為10%,蛋白質(zhì)脫除率為70.64%,多糖保留率為70.03%;根據(jù)各項(xiàng)檢測(cè)指標(biāo)可以看出,不同處理方法對(duì)BSP 的影響存在明顯差異,Sevage 法對(duì)BSP 結(jié)構(gòu)、體外抗氧化活性影響最小,對(duì)BSP 生物活性有較好的保留;TCA 法對(duì)BSP 結(jié)構(gòu)等有較大的改變,其FTIR 圖譜也證實(shí)了這個(gè)結(jié)論;乙腈法對(duì)BSP 損耗效果最小,蛋白脫除效果最好,與UV 掃描結(jié)果相吻合;三種脫蛋白處理方案對(duì)BSP 的FTIR圖譜均有影響,但其特征峰基本不變。研究結(jié)果表明熵權(quán)TOPSIS 可以作為白芨多糖脫蛋白體系的客觀評(píng)價(jià),對(duì)白芨多糖脫蛋白工藝研究具有一定的參考價(jià)值。然而本研究也存在評(píng)價(jià)體系復(fù)雜、個(gè)別指標(biāo)權(quán)重占比不合理的問題,從此次綜合排名來看,Sevage法明顯效果更好,該法具有較高的多糖保留率并且對(duì)于BSP 結(jié)構(gòu)和抗氧化活性影響較小,但存在蛋白質(zhì)脫除率低、操作復(fù)雜等缺陷;如何簡(jiǎn)化體系、合理分配各指標(biāo)權(quán)重占比、將操作難易程度等非數(shù)據(jù)因素并入體系內(nèi)是在今后的研究中需要進(jìn)行探索和解決的問題。
? The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

