燕麥蛋白耦合異源共架技術(shù)對(duì)大米蛋白水溶性的影響
黃馨禾,王長(zhǎng)艷,范龍彬,常雅寧,*
(1.華東理工大學(xué)食品科學(xué)與工程系生物反應(yīng)器工程國(guó)家重點(diǎn)實(shí)驗(yàn)室,上海 200237;2.上海徐匯區(qū)地下空間開(kāi)發(fā)有限公司,上海 200030)
大米是我國(guó)最常見(jiàn)的糧食之一,其中大米蛋白以極低的致敏性而備受矚目[1],與其他谷物蛋白相比,大米蛋白表現(xiàn)出優(yōu)良的氨基酸組成,總必需氨基酸含量約為41.1~41.7 g/100 g,賴氨酸(谷類第一限制氨基酸)的含量高達(dá)4.1 g/100 g[2],同時(shí)凈蛋白質(zhì)利用率(73.8)、生物價(jià)(61)和氨基酸評(píng)分(0.66)也遠(yuǎn)高于其他糧食作物[3],因此大米蛋白作為高附加值成分具有應(yīng)用于多種食品體系之中的潛在價(jià)值。
盡管大米蛋白的營(yíng)養(yǎng)價(jià)值很高,但它含有約80%的谷蛋白[4],谷蛋白會(huì)通過(guò)分子間二硫鍵的交聯(lián)形成大分子聚合物,令大米蛋白在pH4~10 的條件下溶解度、發(fā)泡和乳化性能相對(duì)較差[5],限制了大米蛋白作為功能組分在食品中的應(yīng)用。研究人員采用了多種技術(shù)來(lái)提高大米蛋白的溶解度,其中以化學(xué)改性、生物酶法改性以及物理改性為主。化學(xué)改性與酶改性的反應(yīng)過(guò)程難以控制且會(huì)產(chǎn)生苦味成分[6],物理改性對(duì)設(shè)備要求高,能耗成本大,不利于實(shí)際生產(chǎn)應(yīng)用[7]。因此開(kāi)發(fā)一種安全、操作簡(jiǎn)便的增溶方式尤為重要。
異源共架技術(shù)基于pH-循環(huán)技術(shù),利用外界環(huán)境的改變,從動(dòng)力學(xué)角度出發(fā),改變兩種不同原料之間的非共價(jià)作用,構(gòu)建兩者之間的共架骨架,從而使得復(fù)合材料可以在中性水體系中獲得動(dòng)態(tài)穩(wěn)定性。該技術(shù)因?yàn)榫邆涔に嚭?jiǎn)單、安全性高、能夠保留原料的營(yíng)養(yǎng)特性和生理活性等優(yōu)點(diǎn)而被廣泛應(yīng)用于食品行業(yè),尤其是蛋白質(zhì)改性中。在異源共架的過(guò)程中,兩種蛋白質(zhì)發(fā)生共折疊,使疏水基團(tuán)暴露,從而達(dá)到增溶的效果[8]。He 等[9]利用大豆蛋白耦合異源共架技術(shù)加工小麥面筋蛋白,以實(shí)現(xiàn)對(duì)小麥面筋蛋白的增溶效果。Wang 等[10]通過(guò)大豆分離蛋白耦合異源共架技術(shù)改變大米蛋白結(jié)構(gòu),設(shè)計(jì)新型的蛋白質(zhì)復(fù)合材料,使大米蛋白的溶解度增加。但大豆蛋白的高致敏性限制了復(fù)合材料的實(shí)際應(yīng)用。與大米蛋白相似,燕麥蛋白同樣具有低致敏性、氨基酸配比合理、高生物相容性的特點(diǎn),因此本研究選擇燕麥蛋白與大米蛋白一同構(gòu)建異源共架體,提高大米蛋白的溶解度,這是第一次使用燕麥蛋白耦合大米蛋白。
中國(guó)是全球大米的主要進(jìn)口國(guó)之一,在儲(chǔ)存和運(yùn)輸過(guò)程中,大米的主要副產(chǎn)品碎米的數(shù)量不可低估[11]。因此本文從碎米中提取大米蛋白,并采用異源共架的技術(shù)引入燕麥蛋白對(duì)其進(jìn)行增溶改性,擴(kuò)大其應(yīng)用范圍,以實(shí)現(xiàn)從低價(jià)值資源向高價(jià)值產(chǎn)品的合理轉(zhuǎn)化,從而獲得良好的經(jīng)濟(jì)效益和社會(huì)效益。
1 材料與方法
1.1 材料與儀器
碎米 山東鶴來(lái)香食品有限公司;燕麥蛋白粉純度98%,陜西世紀(jì)千尋生物科技有限公司;SDSPAGE 凝膠配制試劑盒 上海碧云天生物技術(shù)有限公司;食用大豆油 益海嘉里金龍魚(yú)糧油食品股份有限公司;透析袋 北京怡康盛世生物科技有限公司;考馬斯亮藍(lán)、氫氧化鈉、鹽酸和其余常用化學(xué)試劑均為分析純,上海泰坦科技股份有限公司。
PHS-3CU 數(shù)顯臺(tái)式pH 計(jì) 上海越平科學(xué)儀器有限公司;CP213 電子分析天平 奧豪斯儀器(上海)有限公司;DF-101S 集熱式恒溫加熱磁力攪拌器上海秋佐科學(xué)儀器有限公司;DL-5-B 多管離心機(jī)上海安亭科學(xué)儀器廠;FJ200-T 高速均質(zhì)乳化機(jī) 韜越上海機(jī)械科技有限公司;UV-2000 紫外分光光度計(jì) 尤尼柯(上海)儀器有限公司;Scientz Z-10N 真空冷凍干燥機(jī) 鄭州科達(dá)機(jī)械儀器設(shè)備有限公司;FTIR5700 傅里葉紅外光譜儀 安捷倫科技(中國(guó))有限公司;JSM-6390A 掃描電子顯微鏡 日本電子株式會(huì)社;S3500 激光粒度儀 美國(guó)麥奇克有限公司。
1.2 實(shí)驗(yàn)方法
1.2.1 大米蛋白的制備 參照Qadir 等[12]的方法并稍加修改。將碎米粒浸入去離子水中,在4 ℃環(huán)境下冷藏12 h,浸泡過(guò)的碎米粒與4 ℃的去離子水以1:10(w/v)的比例混合打漿。將混合漿料稀釋10倍,用1 mol/L NaOH 將pH 調(diào)至12,在室溫下攪拌4 h。在4 ℃下10000 r/min 離心15 min,取上清液。上清液用1 mol/L HCl 調(diào)節(jié)pH 至4.5 進(jìn)行蛋白質(zhì)沉降,在4 ℃下以10000 r/min 離心15 min,收集沉淀。用去離子水洗滌3 次,再用1 mol/L NaOH將pH 調(diào)至7。冷凍干燥后,得到大米蛋白粉末,在4 ℃的環(huán)境下儲(chǔ)存?zhèn)溆谩?/p>
1.2.2 大米-燕麥蛋白新型復(fù)合材料的制備 參照Z(yǔ)hu 等[13]的方法并稍加修改。向1%(w/v)的大米蛋白中加入不同質(zhì)量的燕麥蛋白,將大米蛋白與燕麥蛋白的質(zhì)量比記作1:0.2、1:0.4、1:0.6、1:0.8、1:1,得到大米-燕麥蛋白溶液。另取大米蛋白和燕麥蛋白分別制得1%(w/v)的溶液作為對(duì)照組。將上述大米-燕麥蛋白溶液、大米蛋白溶液和燕麥蛋白溶液用1 mol/L NaOH 調(diào)至pH 為12,在室溫下用磁力攪拌器攪拌4 h 后,用0.1 mol/L HCl 緩慢中和溶液至pH 為7 后,在4 ℃下以10000 r/min 離心15 min,將上清液用透析袋(3500 Da)在4 ℃下透析24 h 除去鹽分,冷凍干燥后,得到大米-燕麥蛋白粉末和對(duì)照組大米蛋白粉末、燕麥蛋白粉末,在4 ℃的環(huán)境下密封儲(chǔ)存,用以后續(xù)表征分析。沉淀經(jīng)冷凍干燥后,采用SDS-PAGE 進(jìn)行分析。
1.2.3 蛋白質(zhì)濃度的測(cè)定 蛋白質(zhì)的濃度使用考馬斯亮藍(lán)法[14]進(jìn)行測(cè)定。
1.2.4 溶解度的測(cè)定 參照趙方園等[15]的方法并稍加修改,取大米-燕麥蛋白、大米蛋白和燕麥蛋白粉末各0.1 g,分別分散于10 mL 去離子水中,配制成7 份1%(w/v)的大米-燕麥蛋白、大米蛋白和燕麥蛋白溶液,攪拌2 h 后置于4 ℃冰箱過(guò)夜,使其充分水合,再將溶液以5000 r/min 離心15 min。溶解度的計(jì)算公式如下:
其中,M1是上清液中蛋白質(zhì)的含量,單位mg;M2是樣品中總蛋白質(zhì)的含量,單位mg。
1.2.5 十二烷基磺酸鈉-聚丙烯酰胺凝膠電泳(SDSPAGE) 參照Laemmli 等[16]的方法并稍加修改。分別取0.2 g 大米-燕麥蛋白、大米蛋白、燕麥蛋白粉末于7 個(gè)離心管中,加入10 mL 去離子水,充分分散后與4 倍體積的5×緩沖液混合均勻。將異源共架過(guò)程中產(chǎn)生的不溶性沉淀分別分散在緩沖液中,令其濃度為0.2%(w/v)。沸水浴3~5 min 后,各取6.5 μL,上樣加入預(yù)制膠(濃縮膠4%、分離膠12%)進(jìn)行電泳。初始電壓設(shè)置為80 V,樣品進(jìn)入分離膠后調(diào)整至120 V,直至電泳結(jié)束。電泳結(jié)束后染色、脫色至可以看見(jiàn)明顯條帶。
1.2.6 濁度的測(cè)定 參照Wang 等[17]的方法并稍加修改。分別將0.1 g 的大米-燕麥蛋白、大米蛋白、燕麥蛋白粉末加入到100 mL 去離子水中,用1 mol/L NaOH 調(diào)節(jié)pH 至12。磁力攪拌充分溶解后,用0.1 mol/L HCl 緩慢將蛋白溶液pH 調(diào)整為7,溶液pH 每降低0.5 取一次樣,在600 nm 波長(zhǎng)下測(cè)定不同pH 下樣品的透過(guò)率。
1.2.7 粒徑的測(cè)定 由1.2.4 的結(jié)果可知當(dāng)大米蛋白/燕麥蛋白(w/w)為1:0.6 時(shí)溶解度達(dá)到最高,選擇此樣品進(jìn)行后續(xù)實(shí)驗(yàn)。制備2 mg/mL 的大米-燕麥蛋白(1:0.6)、大米蛋白、燕麥蛋白的溶液,采用S3500 激光粒度儀對(duì)蛋白溶液的粒徑進(jìn)行濕法測(cè)定,光源為專利Tri-Laser 激光系統(tǒng),固體二極管激光器,粒度測(cè)試范圍0.01~2000 μm,測(cè)定溫度為25 °C。
1.2.8 掃描電子顯微鏡(Search Engine Marketing,SEM) 將大米-燕麥蛋白、大米蛋白、燕麥蛋白粉末粘附在載物臺(tái)上,然后在真空離子噴濺設(shè)備中進(jìn)行噴金操作,使用掃描電子顯微鏡JSM-6390A 在15 kV的加速電壓下觀察蛋白的微觀表面結(jié)構(gòu)。
1.2.9 乳化特性的測(cè)定 采用Pearce 等[18]的方法并稍加修改。配制2 mg/mL 的大米-燕麥蛋白、大米蛋白、燕麥蛋白的溶液,取8 mL 樣品于離心管中,加入2 mL 大豆油,以10000 r/min 的速度均質(zhì)60 s,迅速?gòu)牡撞咳〕?00 μL 的乳濁液,加入5 mL 0.1%的SDS 溶液稀釋,搖勻后立即在500 nm 波長(zhǎng)下測(cè)定吸光度A0。將剩余乳濁液靜置10 min 后,在底部相同位置進(jìn)行同樣操作,測(cè)定吸光度A10。乳化活性指數(shù)(Emulsifying Activity Index,EAI)和乳化穩(wěn)定性(Emulsifying Stability Index,ESI)計(jì)算公式如下:
式中,A0、A10分別為乳濁液剛制備完成和靜置10 min 之后在500 nm 處的吸光度值;C 為蛋白質(zhì)濃度,單位g/mL;φ為油相占比,此處為0.2;D 為稀釋倍數(shù),此處為51。
1.2.10 起泡特性的測(cè)定 參照Li 等[19]的方法并稍加修改。配制2 mg/mL 的大米-燕麥蛋白、大米蛋白、燕麥蛋白的溶液,將10 mL 樣品溶液用高速均質(zhì)乳化機(jī)以10000 r/min 的速度均質(zhì)2 min,迅速將混合液轉(zhuǎn)移至量筒中測(cè)量體積V0,靜置30 min 后再次測(cè)量體積V30。起泡性(Foaming Capacity,F(xiàn)C)和泡沫穩(wěn)定性(Foaming Stability,F(xiàn)S)的計(jì)算公式如下:
式中,V0為均質(zhì)后0 min 時(shí)的體積,單位mL;V30為靜置30 min 后剩余的體積,單位mL。
1.2.11 傅里葉紅外光譜(Fourier Transform Infrared Spectroscopy,F(xiàn)TIR) 將2 mg 大米-燕麥蛋白、大米蛋白、燕麥蛋白粉末分別與200 mg KBr 混合,充分研磨后壓制成薄膜,用FTIR 5700 傅里葉紅外光譜儀對(duì)蛋白質(zhì)進(jìn)行掃描分析,掃描波數(shù)范圍4000~400 cm-1,分辨率4 cm-1。
1.3 數(shù)據(jù)處理
所有實(shí)驗(yàn)數(shù)據(jù)均為3 個(gè)平行樣本,用Microsoft Office Excel 2021、Origin 2021 以及SPSS statistics 20 軟件進(jìn)行數(shù)據(jù)分析并繪圖,結(jié)果以“平均值±標(biāo)準(zhǔn)偏差”表示,并使用ANOVA 程序進(jìn)行顯著性分析(P<0.05)。
2 結(jié)果與分析
2.1 大米-燕麥蛋白復(fù)合材料的溶解度
如圖1a 和圖1b 所示,大米蛋白和燕麥蛋白在水中不能形成穩(wěn)定的膠體,停止攪拌后,在極短的時(shí)間內(nèi)就會(huì)沉淀。經(jīng)過(guò)異源共架后,大米-燕麥蛋白(1:0.6)在水中能形成均勻的膠體(圖1c),靜置24 h后依然穩(wěn)定。

圖1 大米蛋白(a)、燕麥蛋白(b)和大米-燕麥蛋白(1:0.6,c)在水中分散液的相圖Fig.1 Rice protein (a), oat protein (b) and rice protein-oat protein (1:0.6, c) dispersions in water
異源共架對(duì)溶解度的改善情況如圖2 所示。相比大米蛋白和燕麥蛋白,大米-燕麥蛋白的溶解度顯著提升(P<0.05),這可能是由于經(jīng)過(guò)pH 循環(huán)后,大米蛋白和燕麥蛋白之間發(fā)生了相互作用。大米-燕麥蛋白的溶解度隨燕麥蛋白添加比例的增加而增大。當(dāng)比例為1:0.6 時(shí),復(fù)合材料的溶解度達(dá)到最大,為93.07%±2.15%,約是大米蛋白溶解度(8.49%±1.53%)的10.96 倍。但是,燕麥蛋白添加量的繼續(xù)增加導(dǎo)致大米-燕麥蛋白復(fù)合材料溶解度呈現(xiàn)下降的趨勢(shì),這可能是由于過(guò)量的燕麥蛋白會(huì)影響大米蛋白的分散性,阻礙均一、穩(wěn)定膠體的形成[20]。
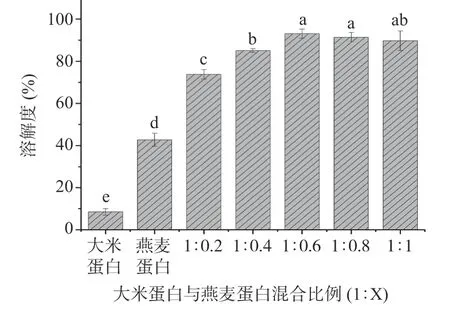
圖2 大米蛋白、燕麥蛋白和大米-燕麥蛋白的溶解度Fig.2 Solubility of rice protein, oat protein and rice protein-oat protein
2.2 大米-燕麥蛋白復(fù)合材料的SDS-PAGE
破壞蛋白質(zhì)的一級(jí)結(jié)構(gòu)會(huì)影響其功能特性并造成營(yíng)養(yǎng)的流失[21]。因此,通過(guò)SDS-PAGE 對(duì)樣品的一級(jí)結(jié)構(gòu)進(jìn)行表征,結(jié)果如圖3 所示。圖3a 泳道2、3 分別代表了大米蛋白和燕麥蛋白的主要亞基條帶。大米蛋白在15~20、25~37、49.6、70~100 kD 顯示的條帶分別對(duì)應(yīng)大米谷蛋白的堿性亞基(β亞基)、酸性亞基(α亞基)、大米清蛋白和大米球蛋白[22-23]。燕麥蛋白在15~24、21、29.5、32~37 kD 以及55 和65 kD 顯示的條帶分別對(duì)應(yīng)于12S 球蛋白β亞基、3S 球蛋白、清蛋白[24-25]、12S 球蛋白α亞基[26]以及7S 球蛋白的亞基[27]。
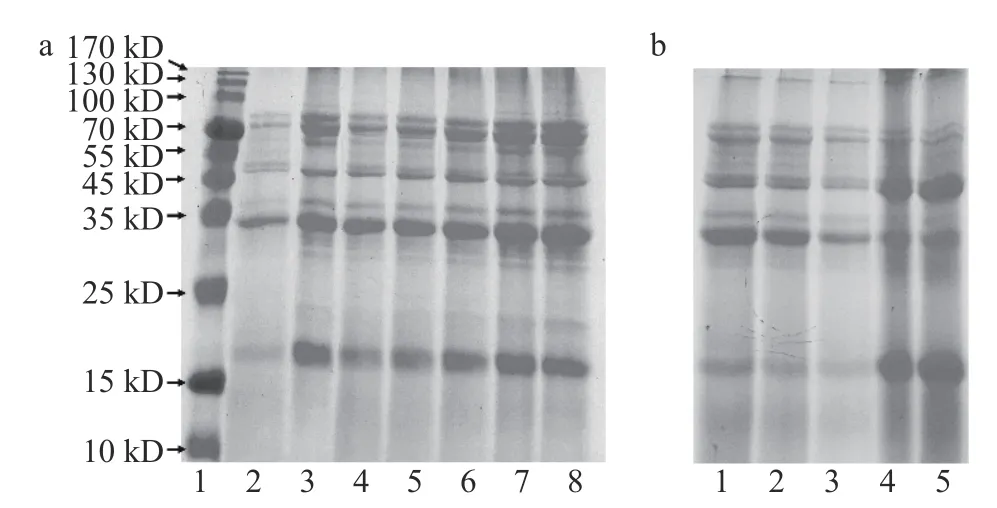
圖3 不同樣品的SDS-PAGE 圖像Fig.3 SDS-PAGE images of different samples
不同比例蛋白復(fù)合物的SDS-PAGE 圖像(圖3a泳道4~8)清晰呈現(xiàn)出了兩者的全部亞基,且無(wú)新的條帶出現(xiàn)。上述結(jié)果表明,在異源共架的過(guò)程中,大米蛋白和燕麥蛋白兩種蛋白質(zhì)分子一級(jí)結(jié)構(gòu)完整,且并未反應(yīng)生成新的亞基。相比大米蛋白,大米-燕麥蛋白樣品在49.6 kD 處的條帶顏色更深,對(duì)應(yīng)大米清蛋白的特征亞基[23],說(shuō)明異源共架增加了大米-燕麥蛋白中的大米蛋白在中性條件下的溶解度。隨著燕麥蛋白比例逐步增加,其在21、29.5 和65 kD 處的特征亞基條帶顏色也逐步加深,說(shuō)明大米-燕麥蛋白中共架的燕麥蛋白含量逐漸增加。異源共架過(guò)程中所產(chǎn)生沉淀的SDS-PAGE 圖像如圖3b 所示,圖中只觀察到大米蛋白的主要亞基,無(wú)法觀察到燕麥蛋白的特征亞基,說(shuō)明燕麥蛋白幾乎完全溶解于水中,圖2 中溶解度的增加主要來(lái)源于對(duì)大米蛋白的溶解度改善。
2.3 大米-燕麥蛋白復(fù)合材料的濁度
濁度的變化可以體現(xiàn)出溶液中溶質(zhì)的聚集,以及溶質(zhì)聚集體質(zhì)量、大小的變化,在一定程度上可以反映出蛋白質(zhì)的溶解性、聚集狀態(tài)和粒徑大小[28]。
如圖4 所示,樣品的濁度總體隨pH 的增加呈現(xiàn)下降趨勢(shì),其中大米蛋白的下降速率最快。pH 為7 時(shí),大米蛋白的透過(guò)率僅為13.17%,較pH 為12時(shí)降低了85.7%,說(shuō)明此時(shí)大米蛋白分子聚集,懸浮于溶液中,使得透過(guò)率較低[29]。異源共架之后,大米-燕麥蛋白的透過(guò)率與大米蛋白相比明顯增加,透過(guò)率的下降速率越來(lái)越慢,當(dāng)大米蛋白/燕麥蛋白(w/w)為1:0.6 時(shí)透過(guò)率變化最小,原因可能是異源共架技術(shù)使得復(fù)合蛋白分子之間的靜電斥力增加,從而形成更加均勻和穩(wěn)定的蛋白質(zhì)溶液[30]。透過(guò)率越大說(shuō)明溶解度越好,與上文得出大米蛋白/燕麥蛋白(w/w)為1:0.6 時(shí)溶解度最高的結(jié)論相一致。

圖4 大米蛋白、燕麥蛋白和大米-燕麥蛋白水溶液的透過(guò)率隨pH 的變化Fig.4 Changes in the transmittance of rice protein, oat protein,and rice protein-oat protein aqueous solutions with pH
2.4 大米-燕麥蛋白復(fù)合材料的粒徑分布情況
不同蛋白樣的粒徑分布如圖5 所示,大米蛋白和燕麥蛋白樣品的粒徑較大,極易發(fā)生大分子間的聚集而沉降[13],與上文2.3 所得大米蛋白和燕麥蛋白溶液透過(guò)率很低的結(jié)果相一致。而經(jīng)過(guò)異源共架處理的大米-燕麥蛋白復(fù)合物粒徑為0.1 μm 左右,與單一組分蛋白相比,粒徑明顯降低,分子聚沉作用減弱,更利于在水中形成均勻穩(wěn)定的膠體,從而達(dá)到增溶效果。
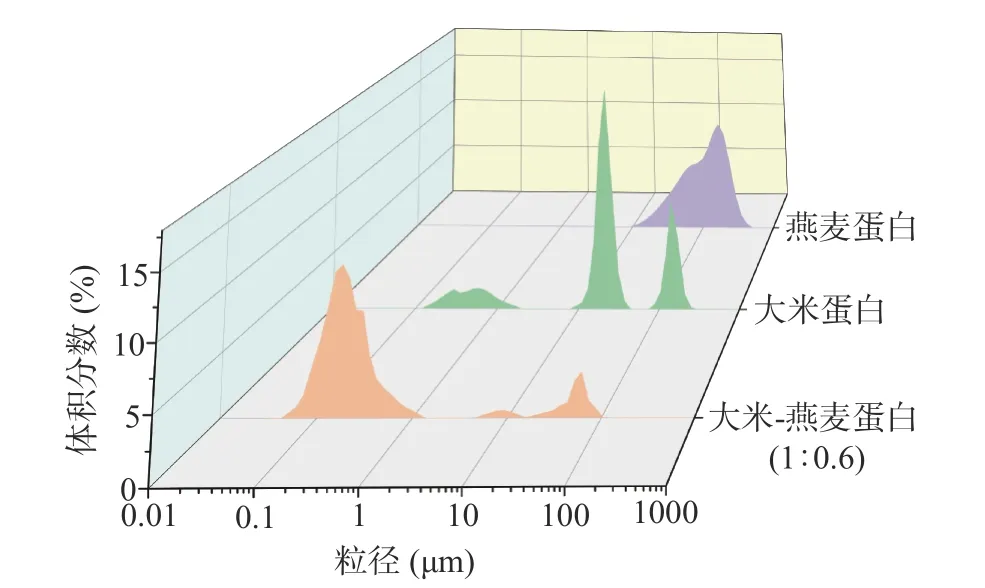
圖5 大米蛋白、燕麥蛋白、大米-燕麥蛋白(1:0.6)在水中的粒徑分布Fig.5 Particle size distribution of rice protein, oat protein, rice protein-oat protein (1:0.6) in water
2.5 大米-燕麥蛋白復(fù)合材料的結(jié)構(gòu)表征
不同蛋白樣品的微觀形態(tài)可以通過(guò)SEM 觀察。如圖6 所示,大米蛋白表面光滑,且顆粒粒徑不均一;燕麥蛋白的表面粗糙、凹凸不平,且顆粒聚集。大米-燕麥蛋白相較于大米蛋白結(jié)構(gòu)更松散、均一,相較于燕麥蛋白表面更加光滑。這可能是異源共架技術(shù)改變了蛋白質(zhì)的分子間作用力以及二硫鍵之間交聯(lián)的平衡,使得大米蛋白和燕麥蛋白的結(jié)構(gòu)展開(kāi),發(fā)生重組,蛋白顆粒變小[31],這使其更容易分散在水中。在不同燕麥蛋白比例的蛋白復(fù)合材料中,大米-燕麥蛋白(1:0.6)的顆粒最小,與其溶解度最高的結(jié)果相一致,而隨著燕麥蛋白的比例進(jìn)一步增加,顆粒逐漸增大,這可能是因?yàn)檠帑湹鞍椎暮窟^(guò)高,使得最終所得蛋白樣品中存在未完全參與反應(yīng)的燕麥蛋白,影響了均一結(jié)構(gòu)的形成。

圖6 大米蛋白、燕麥蛋白和大米-燕麥蛋白的微觀結(jié)構(gòu)Fig.6 Microstructure of rice protein, oat protein and rice protein-oat protein
2.6 大米-燕麥蛋白復(fù)合材料的乳化特性
異源共架處理后的蛋白乳化活性指數(shù)和乳化穩(wěn)定性指數(shù)的變化如圖7 所示。與大米蛋白(22.93 m2/g)不同,引入燕麥蛋白之后大米-燕麥蛋白的乳化活性顯著提升(P<0.05),這是因?yàn)楫愒垂布芴幚泶龠M(jìn)了蛋白質(zhì)聚集物的部分解離和結(jié)構(gòu)展開(kāi),暴露了疏水基團(tuán),從而促進(jìn)了蛋白質(zhì)在油水界面的擴(kuò)散,提高了乳化性能[32],但大米蛋白與燕麥蛋白比例為1:0.2、1:0.4 時(shí)和1:0.6、1:0.8 時(shí),乳化活性并未有顯著性差異(P>0.05),說(shuō)明對(duì)于乳化活性來(lái)說(shuō),異源共架技術(shù)帶來(lái)的影響高于燕麥蛋白的加入量不同帶來(lái)的影響。此外,蛋白質(zhì)的高溶解性也有利于蛋白質(zhì)在微小油滴表面迅速吸附[33],從而提高乳化活性,與圖2 中的溶解度結(jié)果相一致。蛋白的乳化穩(wěn)定性在大米蛋白/燕麥蛋白(w/w)為1:0.6 時(shí)達(dá)到最高(85.38%),比大米蛋白增加了8.11%,說(shuō)明異源共架技術(shù)提高了大米-燕麥蛋白 在油水界面的固化[34],但燕麥蛋白比例進(jìn)一步增加,破壞了蛋白質(zhì)膜表面的結(jié)構(gòu)特性穩(wěn)定,反而使復(fù)合蛋白的乳化穩(wěn)定性有所下降。
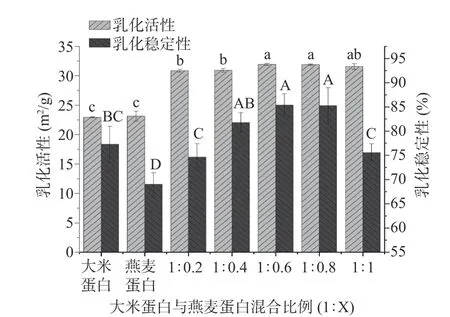
圖7 大米蛋白、燕麥蛋白和大米-燕麥蛋白水溶液的乳化特性Fig.7 Emulsifying properties of rice protein, oat protein, and rice protein-oat protein aqueous solutions
2.7 大米-燕麥蛋白復(fù)合材料的起泡特性
起泡特性歸因于蛋白質(zhì)降低水-空氣界面表面張力的能力[35],如圖8 所示,大米蛋白的溶解性較差,界面浸潤(rùn)性差,導(dǎo)致起泡性低。而大米-燕麥蛋白表面經(jīng)過(guò)異源共架之后暴露出充足的疏水基團(tuán),同時(shí)肽鍵的展開(kāi)增加[36],可以在熱力學(xué)驅(qū)動(dòng)下更容易吸附在空氣-水界面,形成厚實(shí)的泡沫層,以降低過(guò)多表面能,使得其起泡性高于大米蛋白和燕麥蛋白,在大米蛋白/燕麥蛋白(w/w)為1:0.6 時(shí)起泡性比大米蛋白提高4.9 倍。泡沫穩(wěn)定性反映蛋白質(zhì)穩(wěn)定泡沫抵抗機(jī)械應(yīng)力或重力的能力[35],燕麥蛋白表面的靜電斥力可以有助于防止相鄰氣泡之間的接觸,從而抵消泡沫的不穩(wěn)定[37],因此,燕麥蛋白含量較高的大米-燕麥蛋白表現(xiàn)出更好的泡沫穩(wěn)定性,隨著燕麥蛋白比例的增加泡沫穩(wěn)定性分別比大米蛋白提高了18.3%、37.4%、38.3%、45.1%和58.2%。

圖8 大米蛋白、燕麥蛋白和大米-燕麥蛋白水溶液的起泡特性Fig.8 Foaming properties of rice protein, oat protein, and rice protein-oat protein aqueous solutions
2.8 大米-燕麥蛋白復(fù)合材料的傅里葉紅外光譜(FTIR)
蛋白樣品的FTIR 光譜如圖9 所示。FTIR 光譜中的酰胺I 帶(1600~1700 cm-1)是由肽鍵中C=O 拉伸振動(dòng)引起的,酰胺II 帶(1500~1600 cm-1)則是由于酰胺基團(tuán)的C-N 拉伸振動(dòng)和N-H 彎曲振動(dòng)引起的[38]。圖9 中大米-燕麥蛋白在此范圍內(nèi)的吸收峰強(qiáng)度均低于大米蛋白,尤其是大米-燕麥蛋白(1:0.6),這可能是因?yàn)楫愒垂布芗夹g(shù)使得羰基和氨基基團(tuán)丟失,對(duì)蛋白的二級(jí)結(jié)構(gòu)產(chǎn)生了影響[39]。而2800~3100 cm-1處的峰與-CH3和-CH2的C-H 拉伸振動(dòng)有關(guān),在2930 cm-1左右區(qū)域的變化反映了脂肪族氨基酸的暴露,代表了疏水相互作用,C-H 拉伸振動(dòng)的降低意味著該區(qū)域的疏水相互作用增強(qiáng)[40]。異源共架的處理使得大米蛋白的峰值位置從2939.52 cm-1紅移至2931.80~2937.59 cm-1,說(shuō)明疏水相互作用可能是大米蛋白和燕麥蛋白之間的主要內(nèi)驅(qū)力之一。此外,由于氫鍵效應(yīng)帶來(lái)的N-H 和O-H 的拉伸振動(dòng)[41],產(chǎn)生了在3300 cm-1左右較寬的峰,大米蛋白的峰值位置從3288.63 cm-1藍(lán)移至3298.28~3302.13 cm-1,說(shuō)明氫鍵也在兩者之間起到一定作用。

圖9 大米蛋白、燕麥蛋白和大米-燕麥蛋白的傅里葉紅外光譜圖Fig.9 FTIR of rice protein, oat protein, and rice proteinoat protein
3 結(jié)論
本文通過(guò)燕麥蛋白耦合異源共架技術(shù)對(duì)大米蛋白進(jìn)行增溶以增加其應(yīng)用價(jià)值。異源共架技術(shù)可以增強(qiáng)大米蛋白和燕麥蛋白之間的疏水相互作用和氫鍵,在不破壞大米蛋白和燕麥蛋白一級(jí)結(jié)構(gòu)的基礎(chǔ)上,降低分子聚集程度及顆粒粒徑,使蛋白微觀結(jié)構(gòu)更加松散,從而增強(qiáng)了大米-燕麥蛋白的溶解度。當(dāng)大米蛋白/燕麥蛋白(w/w)為1:0.6 時(shí),溶解度達(dá)到最高(93.07%±2.15%),顯著高于大米蛋白(8.49%±1.53%)(P<0.05)。同時(shí),大米-燕麥蛋白的乳化特性及起泡特性也隨之提高。綜上,本研究為擴(kuò)大大米蛋白的應(yīng)用及大米-燕麥蛋白異源共架體的進(jìn)一步研究提供理論基礎(chǔ)。
? The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

