化學合成原料藥國際注冊中起始物料選擇探討
趙 燕
(浙江海正藥業股份有限公司,浙江臺州 318000)
在化學合成類原料藥工藝研發中,起始物料如何進行合理的選擇和論證是合成工藝研發人員首先需要考慮的問題。既然如此,研發人員對哪類物料才是起始物料,即起始物料的基本定義和選擇要有一定的了解和認知。起始物料 (SM: starting material) 是指一種原料、中間體或原料藥,用來生產另一種原料藥,以重要結構片段結合進原料藥化學結構中;此類物料可能在市場上有銷售、能夠通過商業合同或供貨協議從一個或多個供應商處購得,或由原料藥生產廠家自行生產;具有明確的物理化學性質、立體化學結構、雜質控制策略。以上是根據ICH Q7、Q11[1]以及國際主要藥政市場指南梳理的合成類原料藥起始物料的基本定義。起始物料如何合理地定義和選擇,ICH Q11指南中給出了一套基礎的選擇原則,并提供了一定的科學指導,但具體到某一個原料藥的起始物料如何合理地選擇,因產品工藝路線和背景信息的差異,不可能從指南中找到一個固定答案,故起始物料如何選擇依然成了一個仁者見仁、智者見智的熱門爭議話題。基于此,本文將以ICH Q11指南為基礎,并結合多年原料藥國際注冊的實際工作經驗展開對合成類原料藥起始物料如何合理定義和選擇的科學探討。
1 起始物料合理選擇重要意義
在合成類藥品從研發開始到成功上市的整個生命周期中,起始物料合理定義和正確選擇一直占有舉足輕重的地位,如下所述。
1)工藝研發階段:研發工作從起始物料的正確選擇開始。
2)大生產階段:GMP管理要求從起始物料的引入開始。
3)原料藥注冊階段:注冊文件工藝描述從起始物料的引入開始。
4)制劑注冊階段:起始物料定義不準確,制劑文件將被拒收[2]。
5)注冊批準后階段:變更控制從起始物料的引入開始。
因原料藥合成路線過短或原起始物料化學結構復雜,被國外藥政官方提了缺陷信要求原料藥合成路線前移,重新定義起始物料,則將對原料藥GMP生產起點和國外注冊文件內容產生重大影響,同時也可能對關聯制劑產品的注冊審評進度產生負面的影響。
因原起始物料需要按照中間體管理,原料藥廠家勢必面臨以下問題。
(1)GMP資質:原起始物料廠家是否具備中間體GMP資質要求?如不具備,需要尋找其他有GMP資質的中間體廠家,并進行中間體新供應商的變更上報。
(2)資料保密:原起始物料廠家是否愿意按照中間體的要求提供詳細的工藝資料和質量文件支持原料藥的國外注冊工作?如中間體廠家不愿意直接提供詳細資料給原料藥廠家,是否愿意配合原料藥廠家申報中間體國外市場注冊文號或是否愿意配合直接送交中間體的英文資料到國外官方?如以上方式都不可行,則需要尋找其他有資質并愿意配合原料藥國外注冊的中間體廠家,同樣需進行中間體新供應商的變更上報。
(3)雜質研究:新定義起始物料引入的各類雜質,尤其是基因毒性雜質、亞硝銨雜質、元素雜質、有機雜質、殘留溶劑等,需進行評估、研究、并制定合理的控制策略。
如以上信息補充工作無法按照官方缺陷信要求的回復時限要求按期完成,原料藥廠家需要向國外藥政官方申請延期回復缺陷信函或者主動申請退審注冊文件。原料藥注冊文件的審評如出現以上這種情況,勢必會對制劑注冊項目的審評周期造成重大影響:制劑文件審評周期延長或直接被官方拒收。
2 基于ICH Q11探討起始物料選擇問題
2.1 國際藥政市場認可度介紹
ICH Q11指南主要用于指導原料藥的研發和生產,于2012年05月01日批準實施。該文件是目前關于合成類原料藥起始物料如何進行選擇和論證方面最全面、最權威的指南,對如何選擇起始物料和原料藥國際注冊申報時應提交哪些起始物料信息提供了積極指導,目前已被世界主要藥政監管機構認可采納。
2.2 起始物料合理選擇決策樹
起始物料選擇決策樹分為兩個部分。第一部分主要關注起始物料化學結構,如圖1所示;第二部分主要關注起始物料雜質控制策略,如圖2所示。
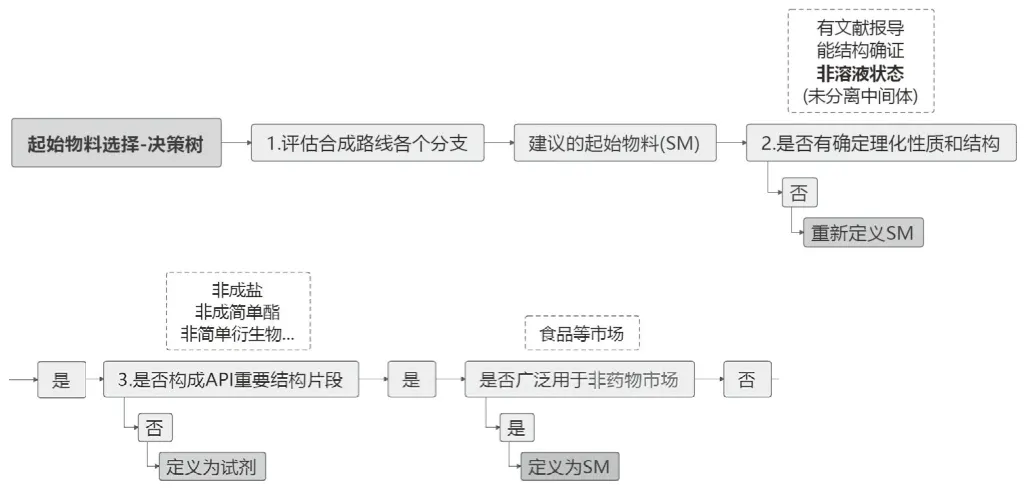
圖1 起始物料選擇決策樹第一部分
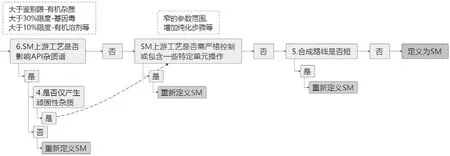
圖2 起始物料選擇決策樹第二部分
2.2.1 決策樹第一部分重點內容解析[3]
是否有確定理化性質和結構?主要是針對有文獻報道、能夠進行化學結構確證實驗和解析的化合物、非溶液狀態的化合物 (如分離中間體一般處于溶液狀態,是一個混合物,不能開展化學結構確認的實驗和解析,故不適合作為起始物料)。
是否構成原料藥重要結構片段?ICH Q11初衷主要是指導業界用于區分起始物料和其他簡單的物料,所以用來成鹽、成酯的簡單酸或簡單堿、或其他簡單有機物,則應為試劑,不是起始物料。起始物料是指分子結構對原料藥分子的藥理活性有貢獻或是有重要意義的部分,但有時候也被研發人員或注冊申報人員錯誤地理解為原料藥結構相近的片段,這時候可能就會因為起始物料化學結構復雜而被官方要求原料藥合成路線前移。綜上所述,企業研發人員或注冊申報人員要理解重要結構片段的實質要求和實際含義,知悉這是一個相對的概念,才能把起始物料和其他試劑、催化劑、溶劑、中間體進行準確區分。
是否廣泛用于非藥物市場[4]?對這一條做出正確判斷的前提,首先要理解什么是非藥物市場。非藥物性市場是指用于藥品生產的數量只占該化合物總市場份額的一小部分,如某化合物已作為商品在食品、化妝品等市場使用多年,則可認為是來自非藥物性市場,此類化合物可認為質量安全,故來自非藥物市場的起始物料不需要進行雜質控制策略的詳細論證。
2.2.2 決策樹第二部分重點內容解析
什么情況下是影響原料藥雜質譜?根據ICH Q11的解釋:大于ICH Q3A鑒別限的有機雜質;大于30% ICH M7限度的基因毒性雜質;大于10% ICH Q3C限度的2類有機溶劑等。
(1)起始物料上游工藝是否需嚴格控制或包含一些特定單元操作?指的是比較窄的工藝操作參數范圍、增加特定的純化步驟等,這些步驟往往包含關鍵工藝參數,故起始物料合成路線需前移。
(2)是否僅產生頑固性雜質?頑固性雜質的限定條件:在既定起始物料至少前一步化學合成產生,且這些步驟沒有其他影響原料藥的雜質產生。
(3)合成路線是否短?到底幾步合成反應路線才合適,沒有固定的答案。需要具體產品具體分析,但需注意對于未分離中間體步驟,因沒有雜質去除機會,嚴格來說不能算是一步化學合成反應。最后一步成簡單鹽的步驟,因沒有共價鍵的產生,也不能算是一步化學合成反應。
2.3 起始物料選擇的基本原則
起始物料選擇基本原則解讀如下。這六個基本原則相輔相成,缺一不可。在起始物料合理性論證時,不能僅針對某一個原則展開詳細論述,而忽略其他原則,
(1)化學反應的每一個分支都要進行評估,確認是否有一個或多個起始物料。
(2)起始物料應有確定的物理化學性質和立體化學結構。未分離的中間體處于溶液的狀態或混合物的狀態,無法進行化學結構的確證,從這個方面來說不能作為起始物料。
(3)起始物料化學結構是構成原料藥化學結構的顯著片段。
(4)工藝前端物料屬性和操作條件的變更對最終原料藥成品質量影響較小。工藝前端的雜質更易去除。因此起始物料離原料藥的工藝步驟距離越長,起始物料所帶來的雜質殘留到成品的風險越低,但同時也要綜合考慮企業的GMP生產成本,并不是生產工藝越長越好。
(5)應有足夠的工藝描述(通常包括多個化學轉化步驟),以了解工藝變化對雜質形成和去除的影響。
(6)影響雜質譜的生產步驟一般應包含在工藝描述中。如原定起始物料合成路線影響原料藥成品雜質譜,且這些雜質不全是頑固性雜質,則合成路線需前移,重新按照以上六個基本原則選擇新的起始物料。原料藥生產廠家應對起始物料帶來的雜質有全面準確的了解,并采用適當的分析方法進行殘留研究,并根據各雜質對后續化學反應及原料藥質量的影響制訂合理的控制策略。
起始原料的選擇除了應符合以上基本指導原則的要求外,企業實際生產運行中還需考慮以下因素:起始原料是否有穩定的、能滿足原料藥大規模生產的商業化來源;起始物料供應商是否有較完善的生產與質量控制體系;是否能與原料藥生產廠家建立良好的溝通與協作,例如,起始原料工藝或質量控制有變更,應及時告知原料藥生產廠家,以便原料藥或制劑廠家及時進行變更評估和注冊申報。
3 起始物料合理選擇的實戰應用
在原料藥國際注冊主文件 (DMF:Drug Master File) 3.2.S.2.3物料章節需要對起始物料選擇的合理性進行論證。根據原料藥國際市場注冊指南要求并結合多年實際注冊工作經驗,建議從以下方面進行起始物料選擇是否合理的評估和論證。
3.1 起始物料基本信息
(1)化學名稱:IUPAC命名。
(2)立體化學結構式:需體現手性中心。
(3)CAS NO.:按需書寫。
(4)廠家信息:體現實際的生產場地,不能是辦公地點。
3.2 合成路線信息展示
起始物料合理選擇論證時,工藝路線書寫請參考圖3 (來自ICH Q11 Q&A),書寫注意事項:
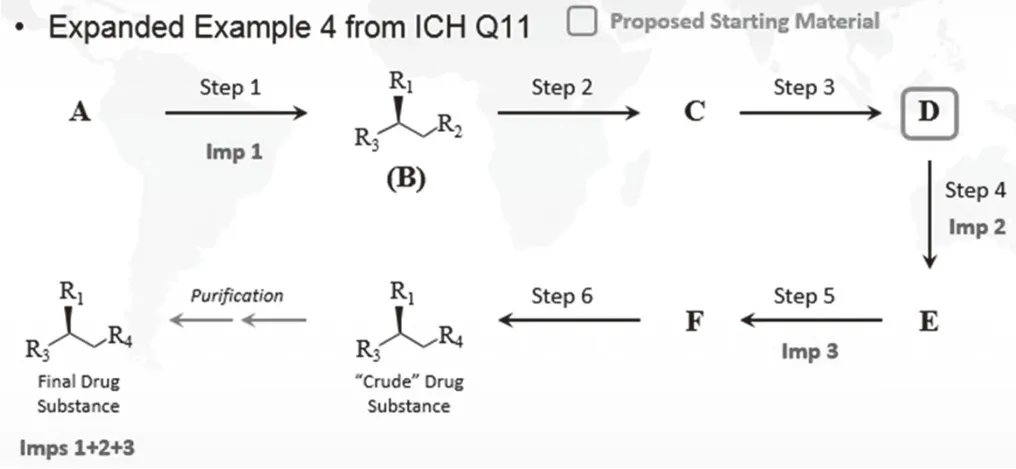
圖3 ICH Q11起始物料論證合成路線書寫格式
(1)標識出每個化合物的立體化學結構式
(2)標識出每個工藝步驟中可能產生的雜質
(3)標識出原料藥的雜質譜
3.3 起始物料選擇論證
依據ICH Q11指南對起始物料如何合理選擇展開論證。基于起始物料選擇六大基本原則和決策樹展開合理性論證,六條原則相輔相成,缺一不可。
原料藥廠家在起始物料選擇論證的過程中可能遇到以下幾種情況,如有問題按需整改后才能安排注冊申報:
(1)既定起始物料同時滿足六大基本原則,則推薦定義為起始物料,可開展后續的研究和注冊工作。
(2)既定起始物料已在非藥用市場廣泛使用,則推薦定義為起始物料,可開展后續的研究和注冊工作。
(3)既定起始物料如不能同時滿足以上六大基本原則,需根據起始物料其他情況論證,支持既定起始物料定義是否合理。例如,既定起始物料有有效的DMF或CEP,可以考慮作為原料藥起始物料,可開展后續的研究和注冊工作。
(4)需要重新定義起始物料,工藝路線前移,既定起始物料升級為中間體。原起始物料供應商資質如無法滿足GMP要求,需尋找其他有資質的合格中間體供應商。以上工作完善后再開展后續的研究和注冊工作,否則等被官方要求路線前移而企業還沒有做好應對措施,將面臨非常被動的局面。
4 結束語
國際藥政市場對合成類原料藥起始物料選擇合理性的審評越來越嚴格,ICH Q11指南的符合性是合成類原料藥進軍國際市場的敲門磚。原料藥廠家一定要清楚國外藥政官方在起始物料合理性審評時想看到什么?綜上所述歸納兩點:原料藥合成路線長短合適,雜質控制策略恰當充分。合成路線長短和雜質控制策略相輔相成,相得益彰。如起始物料的選擇同時滿足以上這兩點,原料藥國際注冊過程中基本不會收到官方針對起始物料提出重大缺陷信函,例如起始物料前移。在起始物料合理選擇的前提下,才能使得原料藥和制劑的國外市場注冊審評順利獲批,產品早日出口上市。

