慢性腎臟病患者睡眠障礙的相關(guān)因素分析
蔡銀香,楊雪球,姜 俊,任 偉
慢性腎臟病(chronic kidney disease,CKD)是臨床極為常見的疾病,全球范圍內(nèi)患病率高達(dá)13.4%[1]。睡眠與覺醒是人類維持生命活動必須的生理現(xiàn)象,睡眠障礙在全球人群的患病率為 4%~29%,且睡眠障礙在腎臟替代治療的CKD患者中患病率更高[2]。研究[3]顯示,睡眠障礙可加速CKD向終末期腎臟病(end-stage kidney disease,ESRD)進(jìn)展,主要是由睡眠問題引發(fā)的高血壓、糖尿病、肥胖導(dǎo)致的。失眠可導(dǎo)致腎素-血管緊張素-醛固酮系統(tǒng)(renin-angiotensin-aldosterone system,RAAS)的紊亂,醛固酮通過鹽皮質(zhì)激素受體發(fā)揮作用,介導(dǎo)腎臟和心血管疾病的發(fā)生,被證明與腎小球硬化和腎臟纖維化有關(guān)[4]。睡眠障礙可導(dǎo)致動脈間歇性的缺氧和復(fù)流,誘導(dǎo)活性氧產(chǎn)生,促進(jìn)炎癥和內(nèi)皮受損,從而引起腎臟功能下調(diào)[5]。同時,睡眠障礙患者可出現(xiàn)異常的腎小管損害,影響夜間尿鈉的排泄。綜上所述,睡眠障礙可直接影響 CKD,促進(jìn) CKD 向 ESRD 的進(jìn)展。
目前對于未行腎臟替代治療的CKD患者睡眠障礙的研究較少,缺乏CKD患者睡眠障礙的患病率數(shù)據(jù),且CKD患者睡眠障礙的影響因素尚不明確。該研究旨在CKD住院患者中探討睡眠質(zhì)量的影響因素,以期為CKD患者睡眠質(zhì)量的管理提供依據(jù),改善患者生活質(zhì)量。
1 材料與方法
1.1 病例資料連續(xù)收集2022 年11 月01日—2023年06月31日在中國科技大學(xué)附屬第一醫(yī)院(安徽省立醫(yī)院)腎臟內(nèi)科住院的未行腎臟替代治療的CKD1-5期患者的基礎(chǔ)資料。納入標(biāo)準(zhǔn):① 慢性腎臟病,年齡≥18歲;② 調(diào)查時,患者病情穩(wěn)定,無嚴(yán)重的心、腦、肺、肝臟及認(rèn)知障礙的合并癥;③ 患者意識清楚,判斷正常,能夠理解問卷并愿意參加調(diào)查;④ 對本項目知情同意。排除標(biāo)準(zhǔn):① 急性腎損傷;② 已行腎臟替代治療的CKD患者,包含血液透析、腹膜透析或腎移植的患者;③ 生命體征不平穩(wěn),或合并嚴(yán)重心腦肺等重要臟器損害的患者(紐約心臟病協(xié)會心功能分級 IV級、心律失常急性發(fā)作、慢性或急性腦卒中、慢性或急性呼吸衰竭、慢性或急性肝功能衰竭);④ 合并癌癥或癡呆患者;⑤ 患者意識不清楚,不能做出判斷或不能理解問卷;⑥ 合并精神疾病如精神分裂癥、躁狂癥等;⑦ 使用糖皮質(zhì)激素、免疫抑制劑(環(huán)磷酰胺、嗎替麥考酚酯、麥考酚鈉、環(huán)孢素、他克莫司等)或生物制劑的患者。本研究經(jīng)過中國科技大學(xué)附屬第一醫(yī)院(安徽省立醫(yī)院)倫理委員會批準(zhǔn)實施(倫理批號:2023KY倫審第257號)。
1.2 診斷標(biāo)準(zhǔn)參照2023年版NKF-K/DOQI指南中CKD的診斷[6]:① 腎臟結(jié)構(gòu)或功能異常,且持續(xù)時間≥3個月,可以有或無腎小球濾過率(glomerular filtration rate,GFR)的下降,(滿足1項或多項腎臟損傷):白蛋白尿(albumnuria excretion rate,AER)≥30 mg/g;尿沉渣異常;由腎小管紊亂引起的電解質(zhì)和其他異常;組織學(xué)異常;影像學(xué)異常;腎移植史;② GFR下降:GFR<60 ml/min·1.73 m2(分期G3a-G5)。采用慢性腎臟病流行病學(xué)協(xié)作公式[7]估算的腎小球濾過率(estimated glomerular filtration rate,eGFR)來對GFR進(jìn)行評估。
1.3 資料的收集和量表評估收集患者的一般資料,包括性別、年齡、合并癥(高血壓病或糖尿病)、身高、體重、腎臟基礎(chǔ)疾病及服用的藥物(影響睡眠或腎功能的藥物),并收集患者收縮壓(systolic pressure,SBP)、舒張壓(diastolic pressure,DBP)、白細(xì)胞計數(shù)(white blood cell,WBC)、血小板計數(shù)(platelet,PLT)、血紅蛋白(hemoglobin,HB)、總蛋白(total protein,TP)、白蛋白(albumin,ALB)、球蛋白(globulin,GLO)、總膽固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、血尿酸(uric acid,UA)、血肌酐(serum creatinine,SCR)、血尿素氮(blood urea nitrogen)、總二氧化碳(total carbon dioxide,TCO2),血清鐵蛋白(serum ferritin,SF)、全段甲狀旁腺激素(intact parathyroid hormone,iPTH)、胱抑素C (serum cystatin,Cys C)、尿總蛋白/尿肌酐(urinary protein to creatinine ratio,UPCR)、及電解質(zhì)等指標(biāo)。匹茲堡睡眠質(zhì)量指數(shù)(pittsburburgh sleep quality index,PSQI)是評估睡眠質(zhì)量最廣泛使用的量表[8]。患者入院第1天采用PSQI量表進(jìn)行睡眠質(zhì)量的評估,PSQI評分 ≤5 分定義為睡眠正常,PSQI評分>5分定義為睡眠障礙[8]。根據(jù)PSQI評分患者分為睡眠正常組與睡眠障礙組。
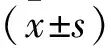
2 結(jié)果
2.1 研究對象一般臨床資料研究對象人口學(xué)數(shù)據(jù)、合并癥資料及入院時的實驗室檢驗結(jié)果見表1。共納入189例未行腎臟替代治療的CKD患者,其中男性114例(60.3%),女性75例(39.7%),年齡為19~89(56.5±15.2)歲,CKD 1~3期47例,占24.9%,CKD 4~5期142例,占75.1%。中位PSQI評分為7.00 (5.00,8.00)分,睡眠正常患者58(30.7%)例,睡眠障礙患者131(69.3%)例。在未行腎臟替代治療的CKD住院患者中,CKD 1-5期的睡眠障礙患病率分別為12.50%、45.45%、50.00%、59.52%、與86.00%,趨勢卡方檢驗檢驗結(jié)果顯示,隨著CKD分期的升高,睡眠障礙患病率升高(χ2=34.977,P<0.001)。見圖1。與睡眠正常組相比,睡眠障礙組患者中女性比例、年齡、CKD4-5期比例、無業(yè)或退休比例、UREA、血鉀、血磷、Cys C、SCR更高,TCO2、血鈣、血鈉、HB、eGFR更低(均P<0.05)。見表1。

表1 CKD患者一般資料以及臨床資料的比較

圖1 CKD 1-5期患者睡眠障礙患病率的比較
2.2 CKD患者睡眠障礙組與睡眠正常組的PSQI量表的各項得分情況與睡眠正常組相比,CKD 患者睡眠障礙組在主觀睡眠質(zhì)量、睡眠潛伏期、睡眠時間、睡眠效率、睡眠障礙和日間功能紊亂的得分更高(均P<0.001),而睡眠藥物使用項目的得分差異無統(tǒng)計學(xué)意義(P=0.506)。見表2。

表2 睡眠障礙組與睡眠正常組患者在PSQI量表各項得分情況的比較
2.3 CKD患者PSQI評分的Spearman相關(guān)分析結(jié)果將可能影響睡眠質(zhì)量的相關(guān)因素與PSQI評分進(jìn)行Spearman相關(guān)分析,結(jié)果顯示,年齡、血鉀、UREA、SCR及Cys C與PSQI評分呈正相關(guān)(均P<0.05),而CKD分期、TCO2、血鈣、血鈉、HB及eGFR與PSQI評分呈負(fù)相關(guān)(均P<0.05)。見表3。

表3 CKD患者PSQI評分的Spearman相關(guān)分析
2.4 CKD患者睡眠障礙的Logistic回歸分析結(jié)果本研究的二元Logistic回歸模型中,睡眠質(zhì)量(賦值:0=睡眠正常,1=睡眠障礙)為因變量,將睡眠障礙組與睡眠正常組組間比較差異具有統(tǒng)計學(xué)意義及與PSQI評分具有相關(guān)性的變量作為自變量納入模型。包括年齡、性別(賦值:0=男性,1=女性)、CKD分期(賦值:0=CKD 1-3期,1=CKD 4-5期)、工作狀態(tài)(賦值:0=在崗或?qū)W生,1=退休或無業(yè))、HB、TCO2、血鈣、血磷、血鉀、血鈉、UREA及Cys C。單因素Logistic回歸分析結(jié)果顯示:高齡、女性、CKD4-5期、退休或無業(yè)、UREA、血鉀及Cys C水平的升高與睡眠障礙風(fēng)險增加有關(guān)(均P<0.05),而HB、TCO2、血鈣及eGFR水平的升高與睡眠障礙風(fēng)險降低有關(guān)(均P<0.05)。在單因素Logistic回歸的基礎(chǔ)上進(jìn)一步進(jìn)行了多因素的Logistic回歸,因CKD分期與eGFR存在共線性,CKD分期未納入自變量,僅納入eGFR為自變量。以睡眠質(zhì)量(賦值:0=睡眠正常,1=睡眠障礙)為因變量,將單因素Logistic回歸分析中P≤0.05自變量納入睡眠障礙的多因素Logistic回歸分析中。多因素Logistic回歸分析結(jié)果顯示,退休或無業(yè)(OR=6.509,95%CI:1.844~22.976)與女性(OR=4.561,95%CI:1.241~16.767)是睡眠障礙的獨(dú)立危險因素,而eGFR(OR=0.960,95%CI:0.931~0.991)是睡眠障礙的保護(hù)性因素。見表4。
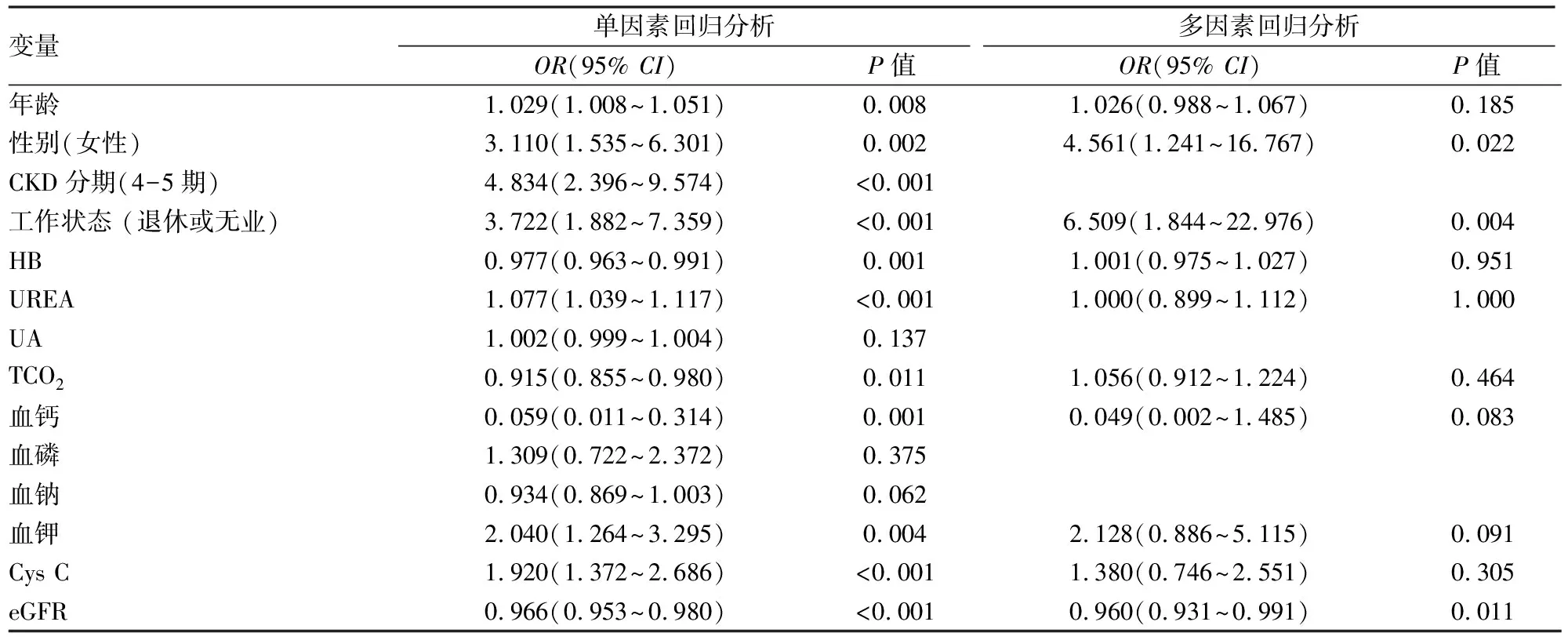
表4 CKD患者睡眠障礙的Logistic回歸分析
3 討論
影響CKD患者睡眠障礙的原因有多種,CKD可致疲勞、抑郁、瘙癢、行動不便、睡眠不足和口干等癥狀[9]。睡眠障礙的患者有著更低的血漿腎素、Ang II 和醛固酮水平,直接導(dǎo)致腎小管對鈉的重吸收減少,利尿作用增加。在CKD患者日常隨診中,睡眠問題總被提及,多數(shù)患者反饋睡眠質(zhì)量差,但臨床上CKD患者并未得到及時的干預(yù)。睡眠障礙會使患者生活質(zhì)量下降,增加了病死率[10]。既往缺乏未行腎臟替代治療的CKD患者睡眠障礙患病率的研究。本研究前瞻性地收集CKD住院患者的臨床資料,在患者住院第1天采用PSQI量表評估CKD患者的睡眠質(zhì)量。本研究結(jié)果顯示,在未行腎臟替代治療的CKD住院患者中,睡眠障礙患病率隨CKD分期逐漸增長。CKD1-3期患者睡眠障礙患病率46.6 %,而在CKD4-5期患者中睡眠障礙患病率則高達(dá)84.7%。這可能與CKD進(jìn)展體內(nèi)毒素的堆積、疼痛及心理因素有關(guān)。因本研究在患者住院第1天即評估了患者的睡眠質(zhì)量,研究結(jié)果能一定程度反應(yīng)未行腎臟替代治療CKD門診患者的睡眠質(zhì)量情況。本研究結(jié)果還顯示,在PSQI評分各項中,睡眠障礙組與睡眠正常組在睡眠藥物使用方面差異無統(tǒng)計學(xué)意義,說明CKD患者的睡眠障礙未能得到及時的干預(yù)。
CKD患者出現(xiàn)睡眠障礙的影響因素并不是單一的。本研究單因素Logistic回歸顯示,女性、高齡、CKD4-5期、退休或無業(yè)、UREA、血鉀及Cys C水平與睡眠障礙呈正相關(guān),而HB、TCO2、血鈣及eGFR水平與睡眠障礙呈負(fù)相關(guān)。而多因素Logistic回歸顯示:女性、退休或無業(yè)及eGFR是睡眠障礙獨(dú)立影響因素。本研究中女性患病率為82.67%,男性患病率為60.53%,且女性是未行腎臟替代治療的CKD患者睡眠質(zhì)量的危險因素。相對于男性而言,女性睡眠質(zhì)量差的風(fēng)險更大,更容易產(chǎn)生睡眠障礙[11],這可能與雌性激素可引起女性更強(qiáng)的炎癥反應(yīng),以及女性更易受抑郁癥、焦慮癥等影響有關(guān)。對離退休后生活的不適應(yīng)以及由于無業(yè)后經(jīng)濟(jì)來源減少,尤其是就醫(yī)費(fèi)用的增加給患者帶來很大的壓力,也會成為影響患者睡眠質(zhì)量的直接因素[12]。同時CKD患者在疾病進(jìn)展過程中會伴隨著eGFR的下降,出現(xiàn)毒素堆積、代謝性酸中毒、鈣磷代謝紊亂、貧血等情況,這些所引起的臨床癥狀導(dǎo)致的皮膚瘙癢、惡心嘔吐、骨痛、大腦缺氧等也會影響患者的睡眠質(zhì)量[13]。
綜上所述,CKD患者睡眠障礙的患病率隨著eGFR的下降、CKD分期的增加逐漸升高,但CKD患者臨床上并未得到及時干預(yù)。臨床工作者需要重點(diǎn)評估女性與無業(yè)或退休CKD患者的睡眠質(zhì)量。然而本研究存在一定局限性,本研究為單中心小樣本的觀察性研究,目前僅進(jìn)行了未行腎臟替代治療CKD患者基礎(chǔ)資料的分析,初步探討了睡眠障礙的相關(guān)因素,無法得出睡眠障礙與eGFR進(jìn)展的因果聯(lián)系,是否適用其他中心的患者尚需進(jìn)一步證實。未來需要進(jìn)一步隨訪觀察以評估睡眠障礙與CKD 進(jìn)展的關(guān)系,并探討睡眠障礙的干預(yù)措施能否延緩CKD進(jìn)展。
- 安徽醫(yī)科大學(xué)學(xué)報的其它文章
- Sirtuins家族和線粒體未折疊蛋白反應(yīng)在疾病中的研究進(jìn)展
- 炎癥反應(yīng)在重性抑郁障礙發(fā)生發(fā)展中的作用和機(jī)制
- 哺乳動物不育系20樣激酶1基因多態(tài)性與結(jié)直腸癌的關(guān)聯(lián)分析
- 淋巴細(xì)胞亞群聯(lián)合趨化因子對兒童原發(fā)免疫性血小板減少癥診斷價值研究
- 基于C-TIRADS聯(lián)合SWE和臨床獨(dú)立危險因素建立的列線圖在甲狀腺4類結(jié)節(jié)中的診斷價值
- 內(nèi)蒙古地區(qū)結(jié)核病的耐藥現(xiàn)狀及影響因素研究

