基于Akt/mTOR信號通路探討洋地黃毒苷調(diào)控甲狀腺濾泡上皮細胞自噬與凋亡的機制
蔣學(xué)林,劉長江
(新疆醫(yī)科大學(xué)第六附屬醫(yī)院,新疆 烏魯木齊 830002)
橋本甲狀腺炎也稱為慢性淋巴細胞性甲狀腺炎,是目前最常見的器官特異性自身免疫性疾病,其主要特征在于甲狀腺特異性抗體的產(chǎn)生、淋巴細胞浸潤及甲狀腺濾泡破壞,導(dǎo)致甲狀腺功能減退[1]。橋本甲狀腺炎發(fā)病隱匿且病程遷延,若不進行及時治療,會損害全身組織器官,甚至引發(fā)癌變[2-3]。自噬是維持真核細胞數(shù)量的正常代謝途徑,主要由溶酶體介導(dǎo),其功能障礙與多種疾病的發(fā)生發(fā)展有關(guān)。研究表明,橋本甲狀腺炎患者的甲狀腺組織中自噬相關(guān)蛋白的表達水平低于正常組織,提示甲狀腺濾泡上皮細胞自噬異常,并引起了細胞凋亡,從而參與橋本甲狀腺炎的疾病進展[4]。因此,探尋調(diào)節(jié)橋本甲狀腺炎中甲狀腺濾泡上皮細胞自噬與凋亡的有效方案,可為橋本甲狀腺炎的預(yù)防、控制和治療提供新方向和新思路。洋地黃毒苷是一種源自洋地黃的天然強心苷,臨床上主要用于改善慢性心功能不全。近年來大量研究集中于洋地黃毒苷的抗癌潛力及機制上,表明洋地黃毒苷具有抑制腫瘤生長、誘導(dǎo)腫瘤細胞凋亡、抑制上皮間充質(zhì)轉(zhuǎn)化及腫瘤細胞干性等作用[5-6]。此外,洋地黃毒苷還可以減少促炎因子的產(chǎn)生,抑制炎癥性疾病和自身免疫性疾病的發(fā)生發(fā)展[7],但洋地黃毒苷對橋本甲狀腺炎的潛在作用機制尚未見報道。本研究通過體外脂多糖刺激人甲狀腺濾泡上皮細胞系Nthy-roi3-1來模擬甲狀腺炎癥模型,探究了洋地黃毒苷對脂多糖誘導(dǎo)的Nthy-roi3-1細胞自噬與凋亡的影響及其可能的作用機制。
1 實驗材料與方法
1.1主要材料與試劑 人甲狀腺濾泡上皮細胞系Nthy-roi3-1(廣州博輝生物科技有限公司),洋地黃毒苷(四川省維克奇生物科技有限公司),脂多糖(北京伊塔生物科技有限公司),自噬抑制劑3-MA(美國Selleck公司),胎牛血清、RPMI-1640培養(yǎng)基及胰酶(美國Sigma公司),CCK-8細胞增殖活性檢測試劑盒(上海酶研生物科技有限公司),Triton X-100(美國Thermo Fisher公司),DAPI(北京康瑞納生物科技有限公司),抗熒光淬滅封片劑、RIPA裂解液、BCA法蛋白濃度檢測試劑盒及ECL化學(xué)發(fā)光液(上海碧云天生物科技公司),PVDF膜(美國Millipore公司),Annexin V-FITC/PI細胞凋亡檢測試劑盒(南京諾唯贊生物科技股份有限公司),抗體微管相關(guān)蛋白1輕鏈3(LC3)、Bcl-2同源結(jié)構(gòu)域蛋白抗體(Beclin 1)、p70S6K、Alexa Fluor 488熒光標記山羊抗兔IgG、辣根過氧化物酶標記山羊抗兔IgG(英國Abcam公司),抗體磷酸化蛋白激酶B(p-Akt)、蛋白激酶B(Akt)、磷酸化哺乳動物雷帕霉素靶蛋白(p-mTOR)、哺乳動物雷帕霉素靶蛋白(mTOR)及GAPDH(北京索萊寶生物科技有限公司)。
1.2實驗方法
1.2.1細胞培養(yǎng)與分組處理 在Nthy-roi3-1細胞中添加含10%胎牛血清的RPMI-1640培養(yǎng)基,置于37 ℃恒溫、5%CO2培養(yǎng)箱中培養(yǎng),每2 d換液1次,按照1∶3比例傳代培養(yǎng)。將對數(shù)生長期的Nthy-roi3-1細胞按照每孔5×104個接種于96孔板,實驗分為5組:對照組采用正常培養(yǎng)基培養(yǎng),脂多糖組采用含10 ng/mL 脂多糖的培養(yǎng)基培養(yǎng),脂多糖+洋地黃毒苷低劑量組采用含10 ng/mL 脂多糖與0.5 μmol/L洋地黃毒苷的培養(yǎng)基培養(yǎng),脂多糖+洋地黃毒苷中劑量組采用含10 ng/mL 脂多糖與1.0 μmol/L洋地黃毒苷的培養(yǎng)基培養(yǎng),脂多糖+洋地黃毒苷高劑量組采用含10 ng/mL 脂多糖與2.0 μmol/L洋地黃毒苷的培養(yǎng)基培養(yǎng),各組均培養(yǎng)24 h。
1.2.2細胞活力檢測 將Nthy-roi3-1細胞置于37 ℃恒溫、5%CO2培養(yǎng)箱過夜培養(yǎng)后,棄掉原培養(yǎng)基,按照1.2.1進行分組處理,每組設(shè)置6個復(fù)孔,置于培養(yǎng)箱中分別培養(yǎng)24,48,72 h,每孔加入10 μL CCK-8試劑液,將細胞與試劑液混勻,繼續(xù)孵育2 h,結(jié)束后用酶標儀測定每孔在450 nm處的光密度。
1.2.3細胞中LC3陽性表達檢測 收集按1.2.1處理后的各組Nthy-roi3-1細胞,接種于含蓋玻片的6孔培養(yǎng)板上培養(yǎng)至融合度達到90%以上,PBS洗滌,4%多聚甲醛固定,0.1%Triton X-100透化20 min,5%牛血清白封閉30 min,在玻片上加入LC3兔多克隆抗體(1∶200),放入濕盒,4 ℃孵育過夜。次日,PBS洗滌,接著加入熒光標記的山羊抗兔IgG抗體(1∶500),室溫避光孵育1 h。PBS洗滌后,DAPI染核,抗熒光淬滅封片劑封片,晾干,通過熒光顯微鏡觀察各組Nthy-roi3-1細胞熒光染色情況并獲取圖像。
1.2.4細胞凋亡檢測 收獲各組Nthy-roi3-1細胞,PBS洗滌后,加入胰酶消化,通過離心機4 ℃、4 000 r/min離心5 min,棄上清,將沉淀重懸于100 μL結(jié)合緩沖液中,依次加入5 μLAnnexin V-FITC和5 μL PI染色液,輕輕混勻后在室溫下避光孵育15 min,再次離心去除上清,吸取500 μL結(jié)合緩沖液添加到流式管中,重懸細胞,使用流式細胞儀分析各組細胞凋亡情況。
1.2.5細胞中自噬及Akt/mTOR信號通路相關(guān)蛋白表達檢測 采用Western blot法檢測:在收集的各組Nthy-roi3-1細胞中添加適量RIPA裂解液,冰上靜置30 min,通過離心機4 ℃、12 000 r/min離心10 min,吸取上清液,測定蛋白濃度。將蛋白與Loading buffer混合,100 ℃加熱變性,通過電泳分離并電轉(zhuǎn)移至PVDF膜上,再將膜浸入5%脫脂牛奶中,室溫封閉1 h,TBST洗膜,加入相應(yīng)一抗工作液(1∶1 000),置于4 ℃孵育過夜,次日,取膜復(fù)溫,TBST洗膜,再加入相應(yīng)二抗工作液(1∶5 000),室溫孵育1 h,再次用TBST清膜。利用ECL化學(xué)發(fā)光液顯影,將蛋白可視化,以GAPDH作為內(nèi)參蛋白,使用Image J軟件分析各目的蛋白條帶的灰度值。
1.2.6自噬抑制劑處理細胞與實驗檢測 將對數(shù)生長期的Nthy-roi3-1細胞按照每孔5×104個接種于96孔板,分為4組進行處理:對照組采用正常培養(yǎng)基培養(yǎng),脂多糖組采用含10 ng/mL脂多糖的培養(yǎng)基培養(yǎng),脂多糖+洋地黃毒苷組采用含10 ng/mL脂多糖與2.0 μmol/L洋地黃毒苷的培養(yǎng)基培養(yǎng),脂多糖+洋地黃毒苷+自噬抑制劑組采用含10 ng/mL 脂多糖、2.0 μmol/L洋地黃毒苷及5 mmol/L 3-MA的培養(yǎng)基培養(yǎng),各組均培養(yǎng)24 h。處理結(jié)束后,收集4組Nthy-roi3-1細胞,流式細胞術(shù)檢測各組細胞凋亡率,Western blot法檢測各組細胞中自噬及Akt/mTOR信號通路相關(guān)蛋白表達情況。
2 結(jié) 果
2.1未抑制自噬洋地黃毒苷對脂多糖誘導(dǎo)Nthy-roi3-1細胞的影響
2.1.1各組Nthy-roi3-1細胞活力比較 培養(yǎng)48 h和72 h,脂多糖組細胞活力均明顯低于對照組(P均<0.05),脂多糖+洋地黃毒苷各組細胞活力均明顯高于脂多糖組(P均<0.05),且脂多糖+洋地黃毒苷各組細胞活力隨洋地黃毒苷劑量增加而逐漸升高,組間兩兩比較差異均有統(tǒng)計學(xué)意義(P均<0.05)。見圖1。
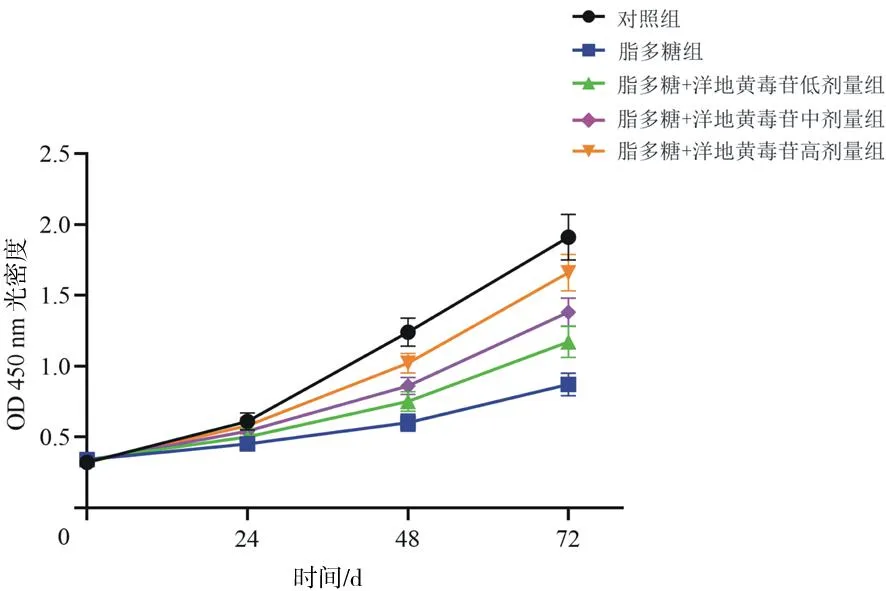
圖1 各組Nthy-roi3-1細胞培養(yǎng)不同時間后細胞活力比較
2.1.2各組Nthy-roi3-1細胞自噬情況比較 與對照組比較,脂多糖組細胞中LC3熒光染色強度明顯減弱;與脂多糖組比較,脂多糖+洋地黃毒苷各組細胞中LC3熒光染色強度隨洋地黃毒苷劑量增加而逐漸增強。見圖2。
2.1.3各組Nthy-roi3-1細胞凋亡情況比較 脂多糖組細胞凋亡率明顯高于對照組(P<0.05);脂多糖+洋地黃毒苷各組細胞凋亡率均明顯低于脂多糖組(P均<0.05),脂多糖+洋地黃毒苷中、高劑量組細胞凋亡率均明顯低于脂多糖+洋地黃毒苷低劑量組(P均<0.05),脂多糖+洋地黃毒苷高劑量組明顯低于脂多糖+洋地黃毒苷中劑量組(P<0.05)。見圖3。
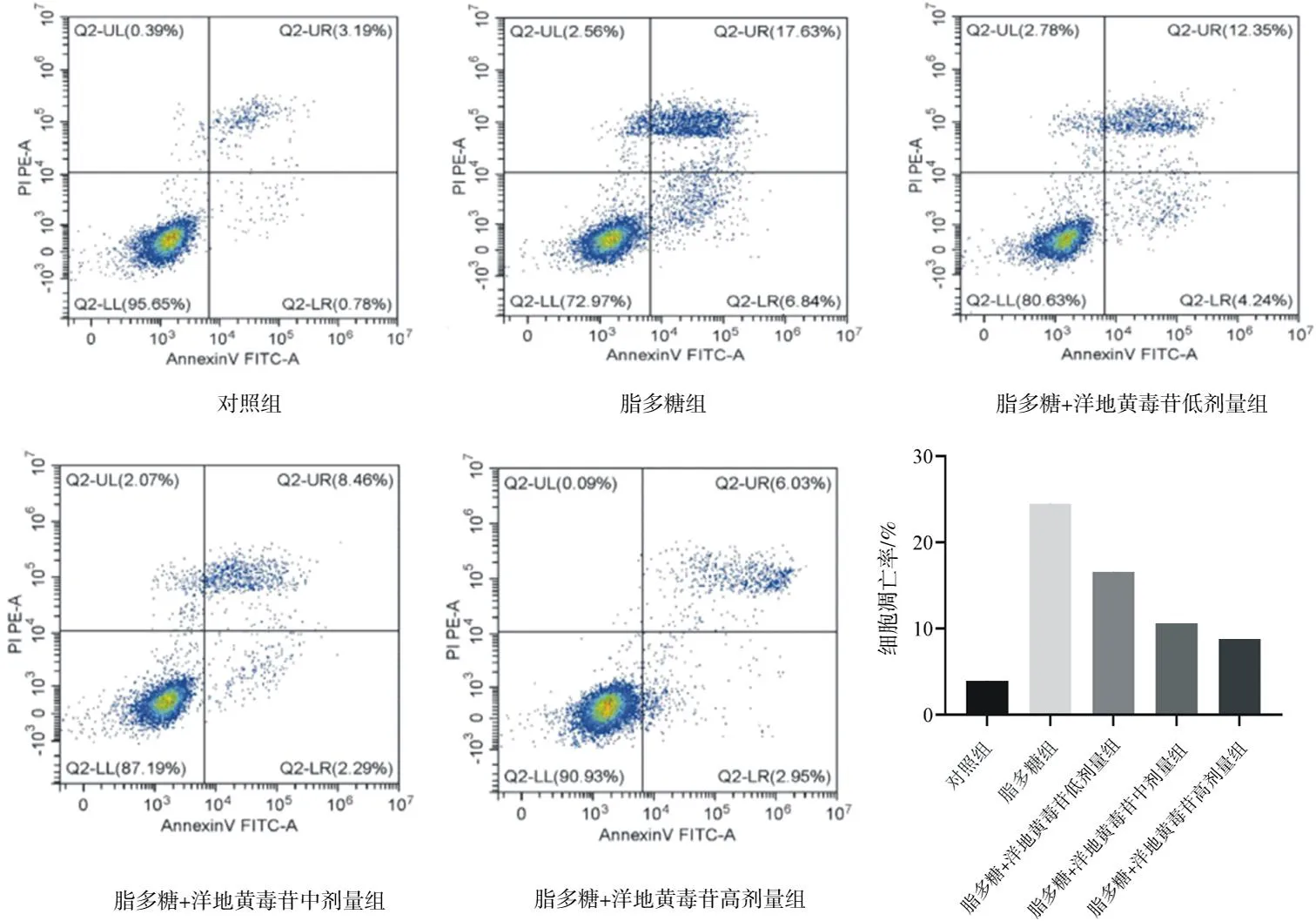
圖3 各組Nthy-roi3-1細胞凋亡情況比較
2.1.4各組Nthy-roi3-1細胞中自噬及Akt/mTOR信號通路相關(guān)蛋白表達情況 與對照組比較,脂多糖組LC3Ⅱ/LC3Ⅰ和Beclin1蛋白相對表達量均明顯降低(P均<0.05),p-Akt/Akt、p-mTOR/mTOR及p70S6K蛋白相對表達量均明顯升高(P均<0.05);與脂多糖組比較,脂多糖+洋地黃毒苷各組LC3Ⅱ/LC3Ⅰ和Beclin1蛋白相對表達量均明顯升高(P均<0.05),p-Akt/Akt、p-mTOR/mTOR及p70S6K蛋白相對表達量均明顯降低(P均<0.05);脂多糖+洋地黃毒苷各組LC3Ⅱ/LC3Ⅰ和Beclin1蛋白相對表達量隨洋地黃毒苷劑量增加而逐漸升高,p-Akt/Akt、p-mTOR/mTOR及p70S6K蛋白相對表達量隨洋地黃毒苷劑量增加而逐漸降低,組間兩兩比較差異均有統(tǒng)計學(xué)意義(P均<0.05)。見圖4及圖5。
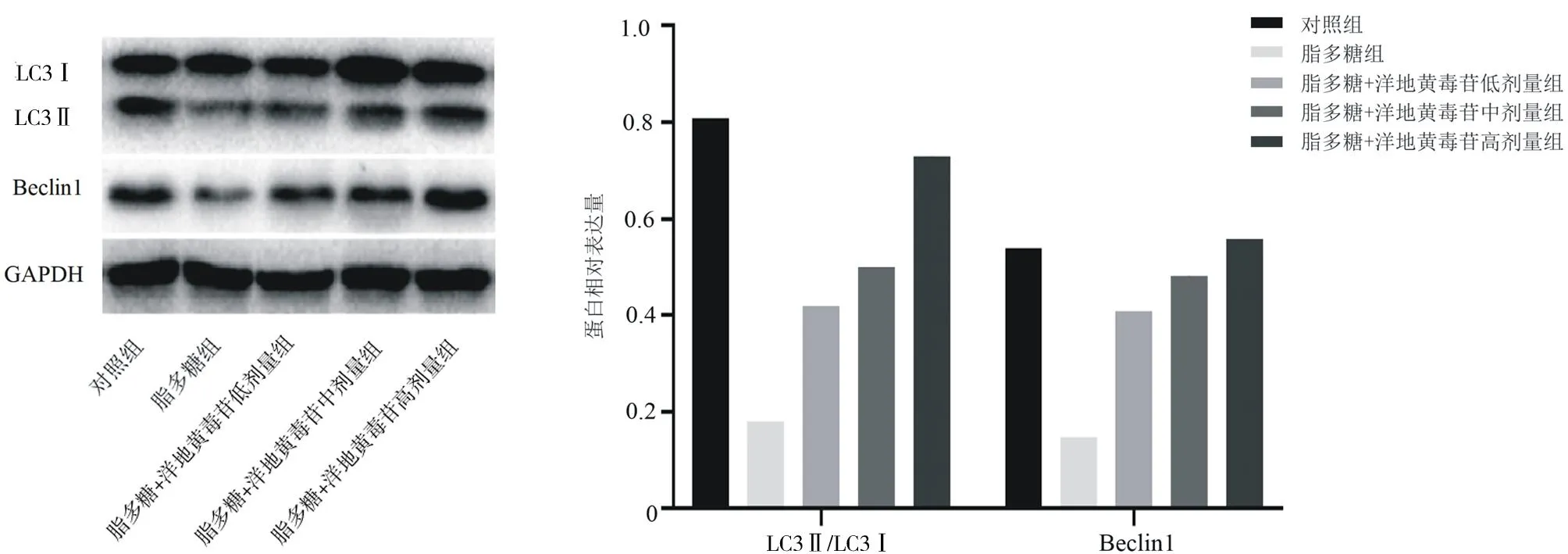
圖4 各組Nthy-roi3-1細胞中自噬相關(guān)蛋白表達情況
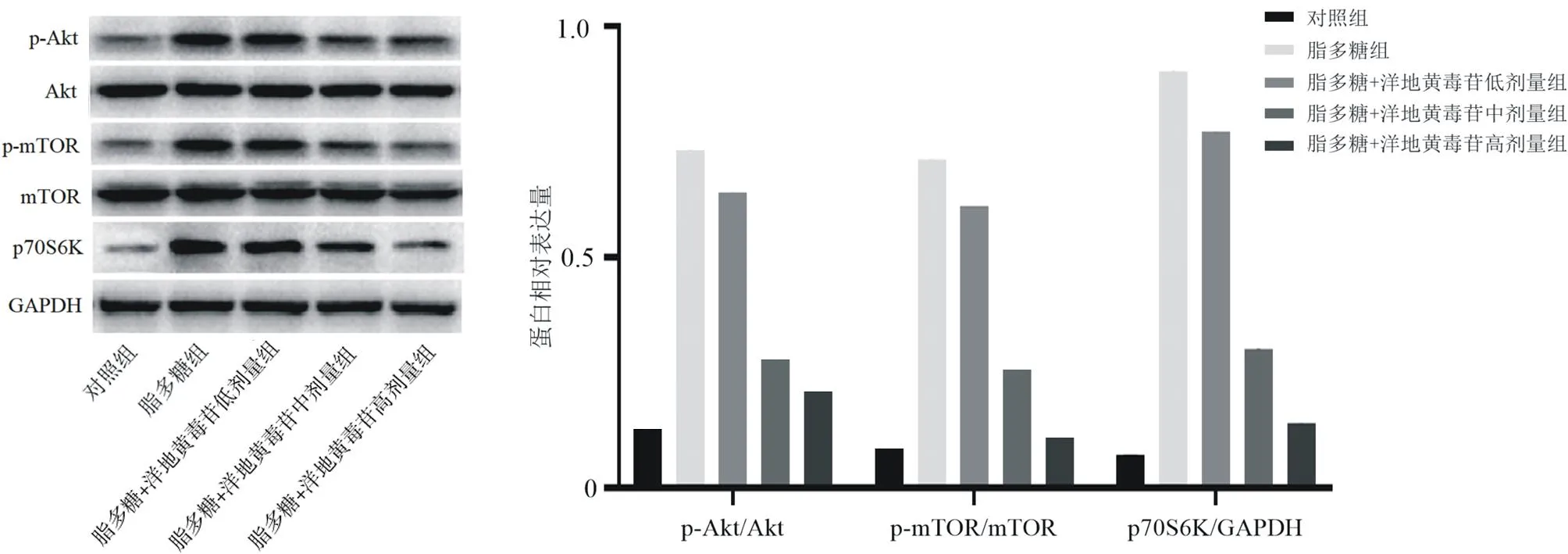
圖5 各組Nthy-roi3-1細胞中Akt/mTOR信號通路相關(guān)蛋白表達情況
2.2抑制自噬對洋地黃毒苷調(diào)節(jié)脂多糖誘導(dǎo)Nthy-roi3-1細胞的影響
2.2.1各組細胞凋亡情況比較 脂多糖組細胞凋亡率明顯高于對照組(P<0.05),脂多糖+洋地黃毒苷組細胞凋亡率明顯低于脂多糖組(P<0.05),脂多糖+洋地黃毒苷+自噬抑制劑組細胞凋亡率明顯高于脂多糖+洋地黃毒苷組(P<0.05)。見圖6。
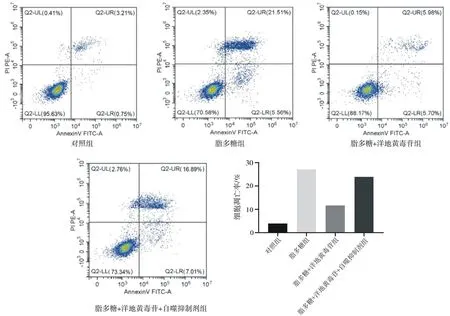
圖6 各組Nthy-roi3-1細胞凋亡情況比較
2.2.2各組細胞中自噬及Akt/mTOR信號通路相關(guān)蛋白表達情況比較 與對照組比較,脂多糖組LC3Ⅱ/LC3Ⅰ和Beclin1蛋白相對表達量均明顯降低(P均<0.05),p-Akt/Akt、p-mTOR/mTOR及p70S6K蛋白相對表達量均明顯升高(P均<0.05);與脂多糖組比較,脂多糖+洋地黃毒苷組LC3Ⅱ/LC3Ⅰ和Beclin1蛋白相對表達量均明顯升高(P均<0.05),p-Akt/Akt、p-mTOR/mTOR及p70S6K蛋白相對表達量均明顯降低(P均<0.05);與脂多糖+洋地黃毒苷組比較,脂多糖+洋地黃毒苷+自噬抑制劑組LC3Ⅱ/LC3Ⅰ和Beclin1蛋白相對表達量均明顯降低(P均<0.05),p-Akt/Akt、p-mTOR/mTOR及p70S6K蛋白相對表達量均明顯升高(P均<0.05)。見圖7及圖8。
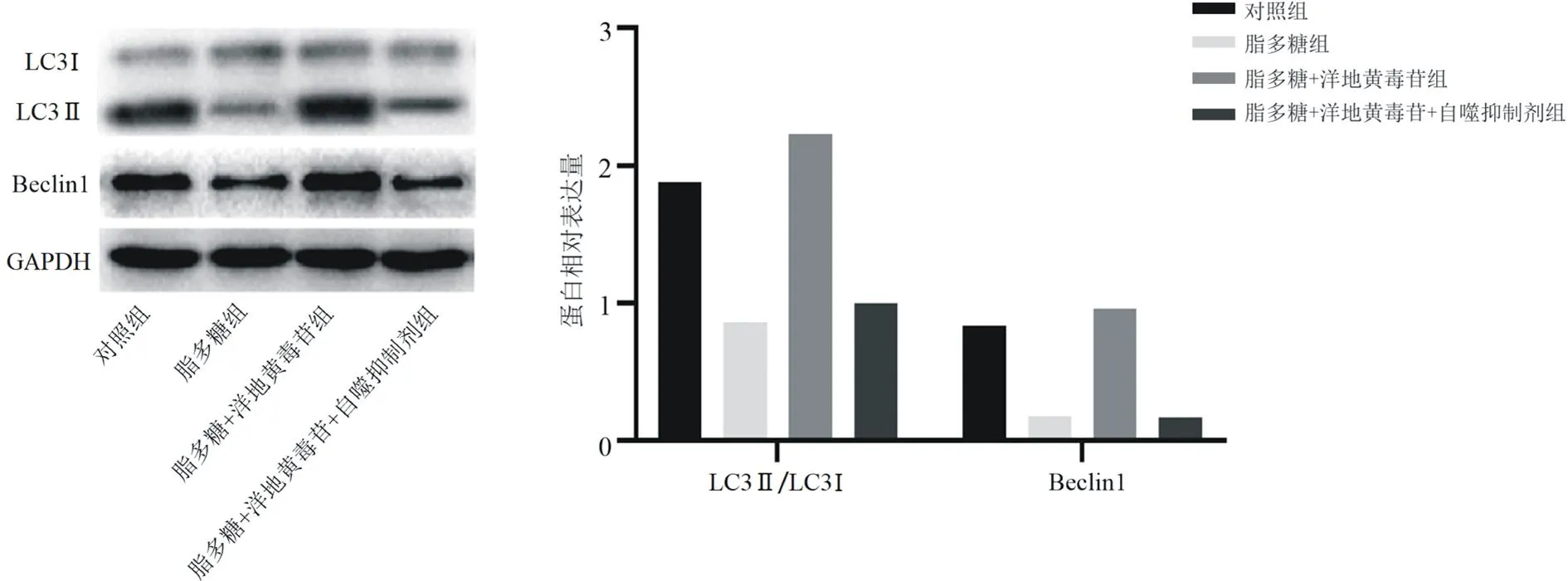
圖7 各組Nthy-roi3-1細胞中自噬相關(guān)蛋白表達情況
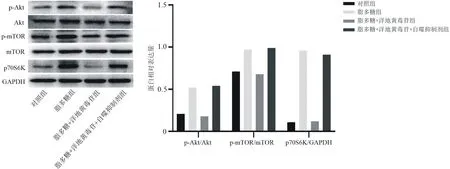
圖8 各組Nthy-roi3-1細胞中Akt/mTOR信號通路相關(guān)蛋白表達情況
3 討 論
甲狀腺作為最大的內(nèi)分泌腺,對于機體的正常生長發(fā)育和新陳代謝至關(guān)重要。甲狀腺基本結(jié)構(gòu)和功能單位是甲狀腺濾泡,其周圍環(huán)繞著甲狀腺濾泡上皮細胞,當腺體功能低下時,甲狀腺濾泡上皮細胞由立方狀變?yōu)楸馄綘?這一形態(tài)改變與橋本甲狀腺炎的發(fā)生密切相關(guān)[8]。橋本甲狀腺炎作為最常見的自身免疫性內(nèi)分泌疾病之一,其病因尚不明確,遺傳易感性、免疫紊亂、環(huán)境因素和表觀遺傳因素均對該疾病產(chǎn)生影響。目前主要的治療方法是進行甲狀腺激素替代治療,可以恢復(fù)甲狀腺功能,但不能完全根治,長期服用還會引起一系列不良反應(yīng)[9]。通過深入探究橋本甲狀腺炎的病因及機制來尋找針對性靶點或有效藥物,對于患者的臨床治療具有重要意義。
洋地黃毒苷能夠減輕心肌重塑和增強心肌收縮力,改善血流動力學(xué),具有抗心力衰竭的作用[10-11]。目前已發(fā)現(xiàn)洋地黃毒苷對多種腫瘤生長有抑制作用,如洋地黃毒苷可通過誘導(dǎo)G2/M細胞周期停滯,觸發(fā)線粒體凋亡,抑制宮頸癌生長[12];在結(jié)腸癌中,洋地黃毒苷以信號轉(zhuǎn)導(dǎo)及轉(zhuǎn)激活因子3(STAT3)非依賴性方式抑制KRAS突變結(jié)腸癌細胞中缺氧誘導(dǎo)因子-1α(HIF-1α)的表達,從而促進細胞凋亡并抑制其增殖和遷移[13]。此外,在流感病毒存在下,洋地黃毒苷能夠抑制棉鼠肺組織中腫瘤壞死因子-α(TNF-α)、生長相關(guān)癌基因/角細胞趨化因子(GRO/KC)、巨噬細胞炎性蛋白-2(MIP-2)、單核細胞趨化因子-1(MCP-1)及干擾素γ(IFN-γ)的表達,對流感和冠狀病毒感染都有治療潛力[14]。本實驗結(jié)果顯示,洋地黃毒苷能夠增強脂多糖誘導(dǎo)下Nthy-roi3-1細胞活力,由此推測洋地黃毒苷可能在炎性環(huán)境下對人甲狀腺濾泡上皮細胞起保護作用。
自噬可以去除或降解受損的細胞器和大分子物質(zhì),參與細胞成分的基本轉(zhuǎn)化,使營養(yǎng)物質(zhì)循環(huán)利用,實現(xiàn)細胞的自我更新,從而為細胞提供維持其穩(wěn)態(tài)的營養(yǎng)物質(zhì)和能量[15]。凋亡存在于各種細胞生物體中,是一種受促凋亡因子和抗凋亡信號調(diào)節(jié)的程序性細胞死亡[16]。自噬和凋亡之間有著千絲萬縷的聯(lián)系,兩者的相互作用可以在一定程度上達到動態(tài)平衡,從而維持細胞的基本生理功能,而當兩者之間的平衡被打破時,就會發(fā)生疾病。以往研究表明,自噬抑制可以激活橋本甲狀腺炎患者體內(nèi)的活性氧水平,誘導(dǎo)甲狀腺濾泡上皮細胞凋亡[17],因此,促進自噬可能是減少橋本甲狀腺炎中甲狀腺濾泡上皮細胞凋亡的重要途徑。本實驗結(jié)果顯示,脂多糖誘導(dǎo)的Nthy-roi3-1細胞中自噬標志蛋白LC3熒光染色強度明顯減弱,LC3Ⅱ/LC3Ⅰ和Beclin1蛋白表達也顯著下調(diào),而細胞凋亡率明顯增高,說明自噬水平受到抑制從而誘導(dǎo)細胞凋亡;在脂多糖誘導(dǎo)下同時加入洋地黃毒苷進行處理,結(jié)果顯示Nthy-roi3-1細胞中自噬標志蛋白LC3熒光染色強度明顯增強,LC3Ⅱ/LC3Ⅰ和Beclin1蛋白表達顯著上調(diào),細胞凋亡率降低,這一結(jié)果提示洋地黃毒苷可能通過促進自噬來減少脂多糖誘導(dǎo)的Nthy-roi3-1細胞凋亡。
Akt/mTOR信號通路參與調(diào)節(jié)自噬,是自噬的負調(diào)節(jié)因子,抑制該通路可直接激活自噬[18-19]。在本研究中,通過脂多糖誘導(dǎo)的Nthy-roi3-1細胞中p-Akt/Akt、p-mTOR/mTOR及p70S6K蛋白表達顯著上調(diào),說明該信號通路被激活而抑制了自噬;而經(jīng)過脂多糖和洋地黃毒苷共處理的Nthy-roi3-1細胞中p-Akt/Akt、p-mTOR/mTOR及p70S6K蛋白表達顯著下調(diào),因此推測洋地黃毒苷對自噬的促進作用可能與抑制Akt/mTOR信號通路有關(guān)。為了進一步驗證這一推測,本研究在脂多糖和洋地黃毒苷處理時加入自噬抑制劑3-MA,結(jié)果顯示LC3Ⅱ/LC3Ⅰ和Beclin1蛋白表達顯著下調(diào),p-Akt/Akt、p-mTOR/mTOR及p70S6K蛋白表達顯著上調(diào),由此表明洋地黃毒苷通過抑制Akt/mTOR信號通路促進了脂多糖誘導(dǎo)下的Nthy-roi3-1細胞自噬。
綜上所述,脂多糖誘導(dǎo)的人甲狀腺濾泡上皮Nthy-roi3-1細胞活性降低,自噬受到抑制,細胞凋亡增加,而洋地黃毒苷能夠促進脂多糖誘導(dǎo)的人甲狀腺濾泡上皮Nthy-roi3-1細胞自噬,從而抑制細胞凋亡,該作用與其抑制Akt/mTOR信號通路的激活有關(guān)。本研究為洋地黃毒苷治療橋本甲狀腺炎提供了一定的實驗依據(jù),但橋本甲狀腺炎病理機制復(fù)雜,洋地黃毒苷能否在體內(nèi)發(fā)揮良好的治療效果以及是否還涉及調(diào)控其他重要通路,有待后續(xù)進一步深入探討。
利益沖突:所有作者均聲明不存在利益沖突。

