氨芐西林膠囊質量分析
李一蘭?王丹?付曉麗?劉旭春?張玲變?周曉溪

摘要: 目的 評價目前國產氨芐西林膠囊的質量現(xiàn)狀及存在問題。方法 按國家藥品抽檢計劃總體要求,采用法定檢驗方法結合探索性研究對氨芐西林膠囊樣品進行檢驗,通過對雜質譜、溶出度、溶出曲線、原料藥對制劑質量的影響和包裝材料對制劑質量的影響等項目的考察,分析本品的質量狀況。結果 按法定標準檢驗103批次樣品,合格率100%,與2016年氨芐西林膠囊國抽結果比較,產品質量總體持續(xù)穩(wěn)定。探索性研究對各雜質的來源與結構進行了確證;溶出度測定方法采用HPLC法檢測結果與標準檢驗排除膠囊殼干擾后結果無明顯差異;不同企業(yè)樣品的溶出曲線存在較大差異;原料藥的質量影響制劑質量;不同包裝氨芐西林膠囊在相同的放置條件下雜質變化差異較大。結論 氨芐西林膠囊質量總體較好,現(xiàn)行質量標準需進一步完善,建議修訂溶出度測定方法為HPLC法以消除膠囊殼的干擾;建議企業(yè)開展仿制藥質量和療效一致性評價,選用質量更好的原料藥,選用防潮效果更好的鋁塑鋁包裝,或者在鋁塑泡罩外加防潮袋。
關鍵詞:氨芐西林;質量分析;溶出曲線;膠囊
中圖分類號:R978.1文獻標志碼:A
Quality assessment of ampicillin capsules
Abstract Objective This study evaluated the current quality status and existing problems with domestic ampicillin capsules. Methods According to the overall requirements of the national drug sampling plan, the sample of ampicillin capsules was tested using statutory methods combined with exploratory research. The quality status of this product was analyzed by examining impurity profiles, dissolution, dissolution curve, the impact of raw materials on the quality of the products and the impact of packaging materials on the quality of the preparation. Results A total of 103 batches of samples were tested according to the specifications, and all of them complied with regulations. Compared with the results obtained in 2016, the product quality of ampicillin capsules was generally stable. Exploratory research had confirmed the sources and structures of various impurities in the products. There was no significant difference between the results of the HPLC test and those of the standard test after excluding the interference of the capsule shell. The dissolution curves of samples from different manufacturers were significantly different. The quality of the raw materials affected the quality of the products. The impurity changes of ampicillin capsules with different packages varied significantly under the same storage conditions. Conclusion The quality of ampicillin capsules was generally good, and the current specifications needed to be further improved. It was recommended to revise the dissolution determination method to the HPLC method to eliminate the interference from the capsule shell. It was also recommended that enterprises carry out a consistent evaluation of the quality and efficacy of generic drugs, choose better-quality raw materials, choose aluminum foil-plastic-aluminum foil packaging with a better moisture-proof effect, or add a moisture-proof bag to the aluminum-plastic blister.
Key words Ampicillin; Quality evaluation; Dissolution curve; Capsules
氨芐西林,曾用名氨芐青霉素,為廣譜半合成青霉素類抗生素[1-2],由英國Beecham研究所于1961年合成。氨芐西林膠囊為口服制劑,活性成分為氨芐西林三水合物,主要用于治療敏感細菌所致的呼吸道、泌尿道、消化道和耳鼻喉等各種感染性疾病[3-5],不良反應主要為過敏反應。國內1965年由上海醫(yī)藥工業(yè)研究院研制成功。
氨芐西林膠囊執(zhí)行標準為國家食品藥品監(jiān)督管理局國家藥品標準WS-10001-(HD-0981)-2002-2012[6],其在英國藥典2023年版及美國藥典45版中均被收載,但日本藥局方第17改正版未收載該制劑。2016年曾對氨芐西林膠囊進行過國家藥品抽檢,研究表明國產氨芐西林膠囊的總體質量情況良好。本文結合標準檢驗和探索性研究檢驗結果,對國內市場上氨芐西林膠囊的關鍵質量屬性進行比較分析,并對2016和2022年的抽檢結果進行縱向比較,對產品存在的主要質量問題進行探討,從而對完善現(xiàn)行質量標準提出合理建議,為進一步提高產品質量提供方向。
1 儀器與試藥
1.1 儀器
Ultimate 3000高效液相色譜儀(美國賽默飛公司); AL-240電子天平(瑞士Mettler Toledo公司); CPA225D電子天平(德國Sartorius公司);V30水分滴定儀(瑞士Mettler Toledo公司);SOTAX AT自動溶出儀(瑞士Sotax公司);U3000/QE液質聯(lián)用儀(美國Thermo Scientific公司)。
1.2 試藥
氨芐西林對照品(批號130410-201908,含量:85.6%);頭孢拉定對照品(批號130427-201708,含量:頭孢拉定88.4%;頭孢氨芐0.81%);氨芐西林系統(tǒng)適用性對照品(批號130618-201202)均購自中國食品藥品檢定研究院。水為超純水,乙腈為色譜純,其他試劑均為分析純。
1.3 樣品
氨芐西林膠囊為2022年國家藥品抽檢樣品,共103批,其中抽自生產企業(yè)26批,經營單位86批,使用單位1批,涉及國內25家生產企業(yè)。
2 試驗方法
2.1 法定標準檢驗
102批次按國家藥品標準WS-10001-(HD-0981)-2002-2012檢驗,1批次按進口藥品注冊標準JX20140306檢驗[7]。主要項目包括溶出度、有關物質、含量測定等。
2.2 探索性研究
根據(jù)法定檢驗結果,結合文獻報道[8-9]以及品種特點、企業(yè)調研等情況,對本品的雜質譜、溶出度、溶出曲線、原料藥對制劑質量的影響、不同包裝材料對樣品質量的影響等項目進行研究。
2.2.1 雜質譜研究
(1)按WS-10001-(HD-0981)-2002-2012標準有關物質方法測定樣品。
(2)雜質的確證:將單個雜質分離后通過LC-MS測定,色譜條件:色譜柱MGⅡ(5 μm ,3.0 mm ×150? mm);以冰醋酸溶液-乙腈-1 mmol/L乙酸銨溶液(0.3:50:950, V/V/V)為流動相A,冰醋酸溶液-乙腈-1 mmol/L乙酸銨溶液(0.3:400:600, V/V/V)為流動相B;按表1進行梯度洗脫;流速: 0.3 mL/min;柱溫: 30 ℃;波長254 nm。利用質譜對雜質峰進行一級和二級掃描分析。
2.2.2 溶出度測定
氨芐西林膠囊溶出度按WS-10001-(HD-0981)-2002-2012標準,溶出方法不變,檢測方法改為HPLC法,照含量測定項下方法測定。選取標準檢驗中存在膠囊殼干擾的12批樣品進行測定,與標準檢驗結果進行比較。
2.2.3 溶出曲線分析
因未能采購到參比制劑(DAVA Pharmaceuticals INC),且國內目前沒有通過仿制藥一致性評價的氨芐西林膠囊,故選取市場份額較大的Z企業(yè)氨芐西林膠囊作為參比制劑。選取大于6批次的6家企業(yè)(含Z企業(yè))0.25 g規(guī)格的樣品,參照日本橙皮書氨芐西林膠囊的溶出曲線測定方法,采用籃法,分別以水、pH3.0檸檬酸-磷酸氫二鈉緩沖液、pH4.0檸檬酸-磷酸氫二鈉緩沖液和pH6.8磷酸鹽緩沖液900 mL為溶出介質,轉速為50 r/min,依法操作,分別于5、10、15、30、45、60、90、120和180 min時取樣,HPLC法測定,繪制溶出曲線。
2.2.4 原料藥對制劑質量的影響
選取同一家制劑企業(yè)使用不同原料生產的樣品各1批,置于溫度40 ℃、相對濕度75%的條件下,分別放置20、40和60 d,與0 d的樣品進行比較,分析其雜質的變化情況。
2.2.5 不同包裝材料對樣品質量的影響
選取企業(yè)1和企業(yè)2各2批不同包裝的氨芐西林膠囊以及其他企業(yè)不同包裝的樣品共9批次,置于溫度
40 ℃、相對濕度75%的條件下,分別放置20、40和
60 d,與0 d的樣品進行比較,分析其雜質的變化情況。
3 結果與討論
3.1 法定檢驗結果
按現(xiàn)行標準檢驗,103批次樣品均符合規(guī)定,合格率為100%。溶出度、有關物質,含量測定等主要檢查項目與產品質量密切相關,對其結果進行進一步統(tǒng)計分析。
(1)有關物質 103批次樣品按法定標準檢驗,合格率100%。其中單個雜質為0.11%~0.64%,均未超過標準規(guī)定的限度1.0%;總雜質為0.56%~2.87%,均未超過標準規(guī)定的限度3.0%。
(2)溶出度 103批次樣品的溶出度值在72%~109%之間,平均溶出度為96.9%。同一企業(yè)樣品的溶出度批內(6粒)的RSD值在0.9%~13.2%之間,表明部分樣品溶出均一性較差。部分企業(yè)批次間差異較大,提示這些企業(yè)的生產工藝穩(wěn)定性和控制水平有待提高。標準檢驗中還發(fā)現(xiàn)部分企業(yè)使用的膠囊殼對溶出度測定結果存在干擾,結果偏高。
(3)含量測定 103批次樣品的含量在93.0%~102.9%之間,平均含量為97.7%。呈正態(tài)分布,對不同企業(yè)樣品的含量測定結果進行單因素方差分析,組間P<0.05,表明各企業(yè)投料差異較大。
(4)質量縱向比較 按法定標準檢驗,氨芐西林膠囊2016及2022年的合格率均為100%,質量狀況良好,比較穩(wěn)定。其中,2016年樣品溶出度多數(shù)集中在95%~112%之間,平均溶出度為106%,檢驗中發(fā)現(xiàn)部分廠家使用的膠囊殼對溶出度測定存在一定干擾,導致測定結果偏高[3];2022年檢驗中仍發(fā)現(xiàn)膠囊殼干擾問題,扣除膠囊殼干擾后,樣品溶出度在72%~109%之間,平均溶出度為96.9%。2016年樣品含量在90.8%~105.7%范圍內,平均值為96.5%[3];2022年樣品含量在93.0%~102.9%范圍內,平均值為97.7%。法定標準檢驗說明該品種含量控制水平2022年較2016年略有提升,部分企業(yè)溶出度的控制水平還有待提高。
3.2 探索性研究結果
3.2.1 雜質譜分析
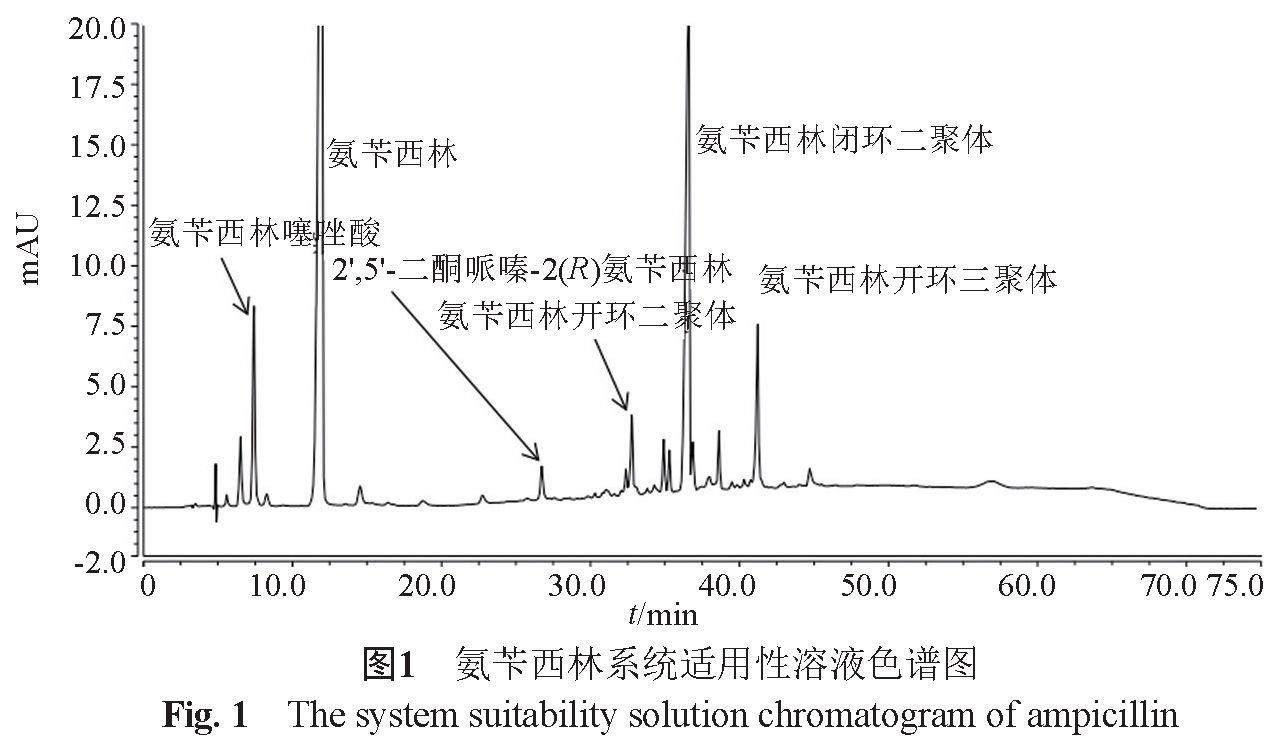
氨芐西林系統(tǒng)適用性溶液圖譜見圖1。氨芐西林膠囊共檢出22個雜質,各雜質峰與主峰分離良好,典型色譜圖見圖2。利用氨芐西林系統(tǒng)適用性對照品確證了其中的5個雜質;通過LC-MS,結合氨芐西林合成路線、β-內酰胺類質譜裂解規(guī)律[10-12],推測了4個雜質結構,雜質名稱見表2。103批次樣品中除1批樣品為氨芐西林輕粉與輔料混合制粒外,其余102批次樣品均為氨芐西林重粉與輔料直接混合填充,未經過制粒或干燥等,工藝過程對雜質影響較小。與2016年氨芐西林膠囊國抽有關物質探索研究相比,樣品檢出的雜質總數(shù)相差不大,主要已知雜質基本一致,為氨芐西林噻唑酸,2,5-二酮哌嗪-(2R)氨芐西林、氨芐西林閉環(huán)二聚體,大部分企業(yè)最大雜質為氨芐西林閉環(huán)二聚體。2016年部分樣品氨芐西林噻唑酸含量超過0.5%,2022年103批次樣品氨芐西林噻唑酸及氨芐西林噻唑酸異構體總量均低于0.4%,表明氨芐西林結晶工藝總體有所提高。
3.2.2 溶出度測定
標準檢驗采用UV法測定,部分企業(yè)膠囊殼干擾測定結果,使結果偏高。HPLC法測定結果和標準檢驗扣除膠囊殼影響后結果無明顯差異(表3)。表明采用HPLC法可以消除膠囊殼的干擾,而且檢驗更加高效便捷。
3.2.3 溶出曲線研究
口服固體制劑的溶出特征是其重要的質量屬性。6家企業(yè)樣品在水、pH3.0檸檬酸-磷酸氫二鈉緩沖液、pH4.0檸檬酸-磷酸氫二鈉緩沖液和pH6.8磷酸鹽緩沖液4種介質中的溶出曲線見圖3。
采用f2因子評價法,比較6家企業(yè)的溶出曲線(表4)。5家企業(yè)樣品溶出曲線與企業(yè)6(參比制劑)相比,僅在部分介質中相似,在pH6.8磷酸鹽緩沖液中均不相似,說明不同的處方和生產工藝對產品的溶出行為有較大影響,提示不同企業(yè)樣品存在體內生物不等效的可能性。與2016年氨芐西林膠囊國抽溶出特性研究所得出的 “不同生產廠家的氨芐西林膠囊之間溶出行為有顯著差異,說明不同的處方和生產工藝對產品的溶出行為影響較大”結果一致。目前國內尚未有氨芐西林膠囊通過仿制藥質量和療效一致性評價,建議企業(yè)參照原研藥品積極優(yōu)化處方工藝,嚴格工藝控制過程,盡早開展一致性評價工作。
3.2.4 原料藥對制劑質量的影響
(1)對比原料藥與制劑雜質檢測情況發(fā)現(xiàn),原料藥中有16個雜質,未檢出制劑樣品中的4、7、11、14、20和22號雜質,但雜質總體分布情況與制劑相似,原料藥質量影響著制劑的質量。該結果與2016年氨芐西林膠囊國抽有關物質探索研究結果一致。
(2)在加速試驗中,兩種原料來源的樣品,氨芐西林閉環(huán)二聚體均減小,18號雜質(氨芐西林閉環(huán)二聚體異構體)均增大,總雜質均增大,推測是在加速試驗過程中氨芐西林閉環(huán)二聚體轉變成18號雜質;使用原料1的樣品,18號雜質和總雜質增幅較使用原料2的樣品大(圖4)。說明原料藥質量影響制劑質量。
3.2.5 不同包裝材料對樣品質量的影響
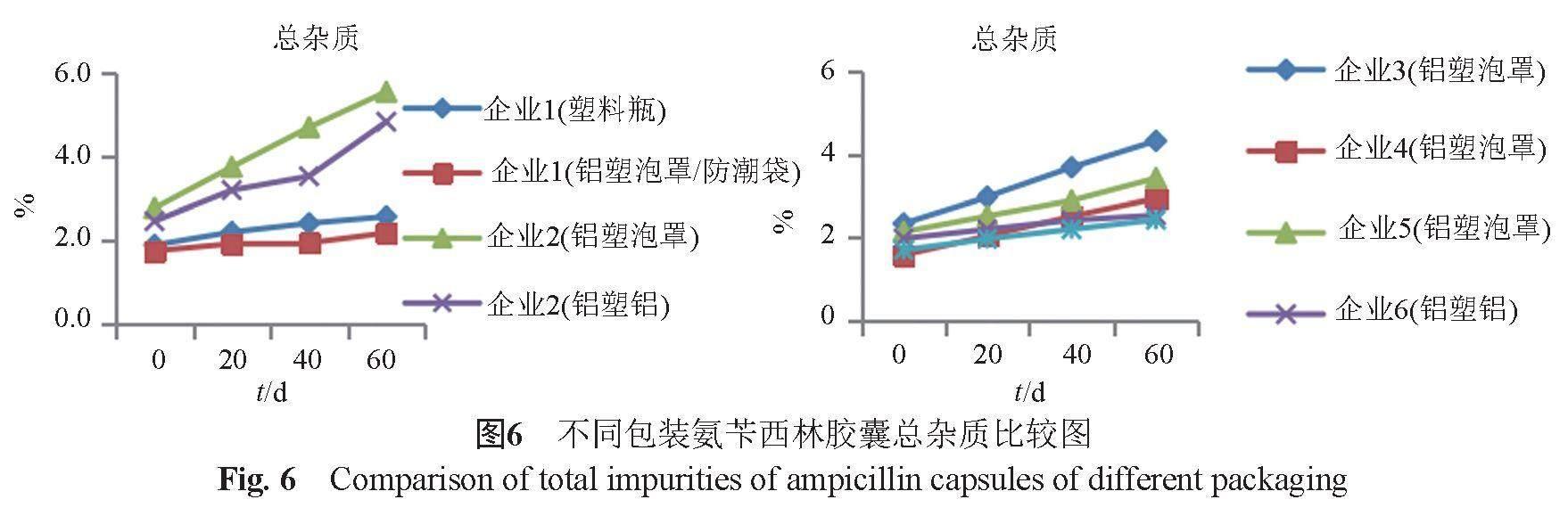
在溫度40 ℃,相對濕度75%條件下,按有關物質方法測定樣品中雜質。企業(yè)1鋁塑泡罩加防潮袋包裝的樣品雜質變化幅度比塑料瓶包裝的小;企業(yè)2鋁塑鋁包裝的樣品雜質變化幅度比鋁塑泡罩包裝的小。比較不同企業(yè)的樣品,鋁塑鋁包裝的樣品雜質變化幅度比鋁塑泡罩小(圖5~6)。因此,建議企業(yè)選用防潮效果更好的鋁塑鋁包裝,或者在鋁塑泡罩外再加防潮袋以阻隔環(huán)境中水分對樣品的影響。
4 小結
本次抽檢結果顯示,氨芐西林膠囊總體質量較好,產品合格率100%。與2016年氨芐西林膠囊國抽結果比較,其各項指標變化不大,提示產品質量總體持續(xù)穩(wěn)定。
實驗中發(fā)現(xiàn),氨芐西林膠囊標準WS-10001-(HD-0981)-2002-2012溶出度測定采用UV法,存在膠囊殼干擾的情況,建議修訂為HPLC法測定;不同企業(yè)樣品的溶出曲線存在較大差異,建議企業(yè)參照原研藥物優(yōu)化處方工藝,盡早開展仿制藥質量和療效一致性評價工作;原料藥的質量影響制劑質量,建議企業(yè)選用高質量的原料藥;不同包裝材料氨芐西林膠囊在相同的放置條件下雜質變化差異較大,說明包裝材料的優(yōu)劣對本品質量存在一定的影響,建議企業(yè)選用防潮效果更好的鋁塑鋁包裝,或者在鋁塑泡罩外再加防潮袋以阻隔環(huán)境中水分對樣品的影響。
參 考 文 獻
薛詠蘭, 滕鈺, 黃婕, 等. 水分對氨芐西林膠囊穩(wěn)定性的影響[J]. 中國抗生素雜志, 2018, 43(3): 303-306.
李香荷, 王強, 張軼華, 等. 國產氨芐西林丙磺舒膠囊的質量評價[J]. 中國抗生素雜志, 2021, 46(1): 53-61.
黃婕, 滕鈺, 徐洪, 等. 國產氨芐西林膠囊質量評價[J]. 中國抗生素雜志, 2018, 43(3): 296-301.
國家藥典委員會. 中華人民共和國藥典臨床用藥須知: 化學藥和生物制品卷[S]. (2010年版). 北京: 中國醫(yī)藥科技出版社, 2011: 632-633.
岑海燕, 吳建國, 陳燕, 等. 老年性尿路感染的流行病學及診治現(xiàn)狀[J]. 國外醫(yī)藥(抗生素分冊), 2023, 44(6): 379-382.
國家食品藥品監(jiān)督管理局. 國家食品藥品監(jiān)督管理局國家標準[S]. 2012: WS-10001-(HD-0981)-2002-2012.
國家食品藥品監(jiān)督管理總局. 國家食品藥品監(jiān)督管理總局進口藥品注冊標準[S]. 2014: JX20140306.
胡昌勤. 對抗生素藥品評價性抽驗基本思路與方法的思考[J]. 中國抗生素雜志, 2013, 38(1): 1-11.
胡昌勤. 國內抗生素藥品的質量現(xiàn)狀[J]. 中國抗生素雜志, 2018, 43(3): 255-261.
李桃. 液質聯(lián)用技術在藥物降解產物及雜質分析中的應用[D]. 石家莊: 河北醫(yī)科大學, 2014.
寧志強, 李猛, 張宏森, 等. 氨芐西林質譜解析及離子化方式研究[J]. 化學與粘合, 2013, 35(5): 34-35.
李瑋, 張偉清, 李翔, 等. 阿莫西林、氨芐西林混合降解雜質對照品的研究與應用[J]. 藥學學報, 2014, 49(9): 1310-1314.

