術前CT定量參數與肝動脈化療栓塞術后肝癌患者預后的相關性及預后預測列線圖模型的構建
張 強,王廣才,楊方波,李存彪,劉 娜,楊 波
(濮陽市第五人民醫院醫學影像科,河南 濮陽 457000)
肝癌具有“高發病率、高致死率”等特征,常見致病原因有肝硬化、病毒性肝炎、黃曲霉素感染等,早期無明顯癥狀,隨疾病進展出現肝區疼痛、肝臟進行性增大、乏力消瘦時,往往已處于中晚期[1-4]。肝動脈化學治療栓塞術(transhepatic arterial chemoembolization,TACE)是針對不可行肝切除術的中晚期肝癌患者常用的治療手段之一,其優勢在于經導管將化學治療藥物與栓塞劑注入腫瘤供血靶動脈,栓塞靶動脈血管后達到抗癌作用;TACE治療肝癌療效確切、不良反應少,但術后腫瘤復發一直困擾臨床[5-6]。肝臟具有特殊肝動脈、門靜脈雙重供血,了解TACE術前血流特點可為肝癌患者預后評估提供參考依據。范曉華等[7]研究報道,肝細胞癌患者于數字減影血管造影引導下行TACE后通過超聲造影進行療效評估價值較高,其中達峰時間和增強速率預測價值最優,能夠作為預測療效的輔助影像學方法之一。隨著CT技術不斷發展、完善,螺旋CT灌注成像觀察腫瘤血供受到廣泛關注。有研究報道,CT定量參數在評估肝癌病理分化程度、治療效果等方面優勢較為突出,推測其有可能用于TACE治療的肝癌患者預后評估[8]。本研究旨在探討術前CT定量參數與TACE術后肝癌患者預后的相關性,并構建預后預測列線圖模型,以期早期評估經TACE治療的肝癌患者預后不良的風險。
1 資料與方法
1.1 一般資料
選擇2020年5月至2022年5月于濮陽市第五人民醫院醫學影像科行TACE治療的120例肝癌患者為研究對象。其中男82例,女38例;年齡40~65(52.36±8.25)歲。病例納入標準:(1)經穿刺病理活檢確診為肝癌;(2)均行TACE治療;(3)患者的認知、言語、溝通能力正常,依從性良好;(4)自愿簽署相關研究知情同意書。排除標準:(1)伴腹水、嚴重黃疸或其他系統惡性腫瘤;(2)入組前接受免疫、消融或其他抗肝癌治療;(3)對CT掃描相關碘試劑過敏;(4)預計生存時間<3個月。本研究獲得濮陽市第五人民醫院醫學倫理委員會審核批準。
1.2 螺旋CT平掃及灌注成像掃描
TACE治療前完善螺旋CT平掃及灌注成像掃描:患者取仰臥位,平穩呼吸后使用GE Optima680型64排128層螺旋CT機(北京航衛通用電器醫療系統有限公司)行肝臟平掃,確定腫瘤病灶位置后避開壞死區選擇感興趣區(region of interest,ROI)作為灌注掃描層面,動態掃描層面覆蓋病灶組織、門靜脈,掃描參數:管電壓、電流分別為100 kV、200 mA,層厚5 mm、矩陣512×512,以4 mL·s-1速率經肘靜脈團注碘對比劑(1.0 mL·kg-1),延遲8 s行動態掃描。將灌注成像掃描圖像傳送至工作站,應用Advantage Workstation上的perfusion 4D 軟件分析掃描圖像并得到灌注參數圖,在灌注參數圖上選擇ROI,測量各部分ROI CT值,生成對應時間-密度曲線,讀取灌注參數,包括肝血流量(hepatic blood flow,HBF)、肝動脈灌注量(hepatic artery perfusion volume,HAP)、門靜脈灌注量(portal vein perfusion volume,PVP)、肝動脈灌注指數(hepatic artery perfusion index,HAI)、平均通過時間(mean transit time,MTT)。
1.3 臨床資料收集及病例分組
收集入組患者的臨床資料,包括性別、年齡、體質量指數(body mass index,BMI)、吸煙史、酗酒史、TNM分期、腫瘤最大徑、腫瘤數目、包膜是否完整、白蛋白、血小板、總膽紅素、白細胞計數、丙氨酸氨基轉移酶(alanine aminotransferase,ALT)、天冬氨酸氨基轉移酶(aspartate aminotransferase,AST)、甲胎蛋白(alpha-fetoprotein,AFP)。隨防至2023年5月,病死患者數據收集至末次隨訪,將死亡、復發、因嚴重并發癥再次入院的肝癌患者納入預后不良組(n=30),隨訪期間無復發、無嚴重并發癥的患者納入預后良好組(n=90)。
1.4 統計學處理

2 結果
2.1 預后良好組與預后不良組患者的臨床資料比較
預后不良組患者TNM分期Ⅲ~Ⅳ期占比、包膜不完整占比及AFP、HBF、HAP、HAI水平顯著高于預后良好組,MTT顯著短于預后良好組,差異有統計學意義(P<0.05);預后不良組與預后良好組患者的性別構成、年齡、BMI、吸煙史占比、腫瘤最大徑>5 cm占比、腫瘤數目>1個占比、白蛋白水平、血小板計數、總膽紅素水平、ALT水平、AST水平,PVP比較差異無統計學意義(P>0.05)。結果見表1。
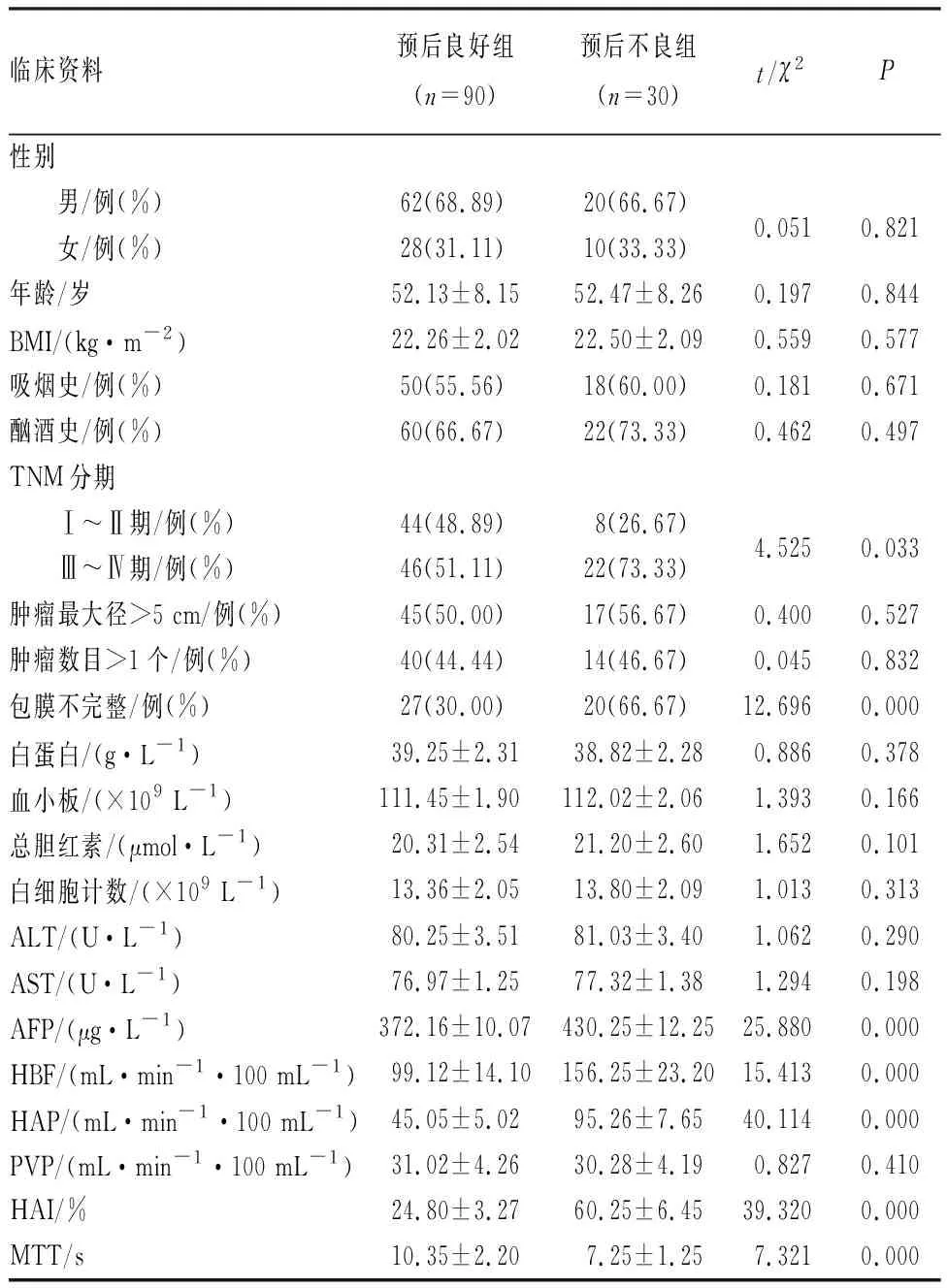
表1 預后良好組與預后不良組患者的臨床資料比較Tab.1 Comparison of clinical data of patients between the good prognosis group and poor prognosis group
2.2 影響經TACE治療肝癌患者預后的危險因素
將TNM分期Ⅲ~Ⅳ期、包膜不完整、AFP、HBF、HAP、HAI、MTT作為自變量(X),預后作為因變量(Y)進行logistic多因素回歸分析,結果顯示,包膜不完整[比值比(odds ratio,OR)=2.202,95%置信區間(confidence interval,CI):1.884~2.880,P=0.000]、AFP水平高(OR=2.187,95%CI:1.818~2.787,P=0.000)、HBF高(OR=2.177,95%CI:1.859~2.862,P=0.000)、HAP高(OR=2.192,95%CI:1.907~2.909,P=0.000)、HAI高(OR=2.212,95%CI:1.926~2.816,P=0.000)、MTT短(OR=2.208,95%CI:1.927~2.954,P=0.000)是影響經TACE治療肝癌患者預后的危險因素。結果見表2。
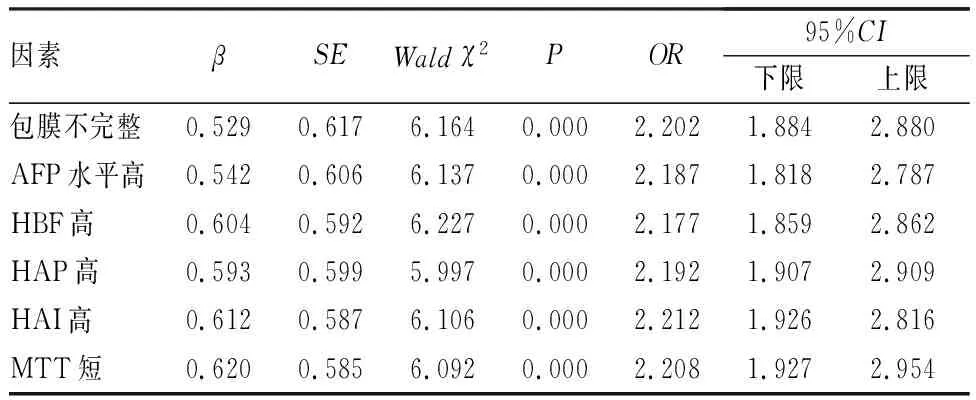
表2 影響經TACE治療肝癌患者預后的危險因素logistic多因素回歸分析Tab.2 Logistic multivariate regression analysis of risk factors affecting prognosis of liver cancer patients treated with TACE
2.3 經TACE治療肝癌患者預后預測列線圖模型及驗證
基于HBF、HAP、HAI、MTT構建經TACE治療肝癌患者預后預測列線圖模型(見圖1)。Calibration驗證結果顯示實測值與預測值結果基本一致,表明該模型預測性能良好,結果見圖2。Bootstrap內部驗證法結果顯示,C-index為0.908(95%CI:0.787~0.968),表明該模型區分度、準確度均較好,結果見圖3。
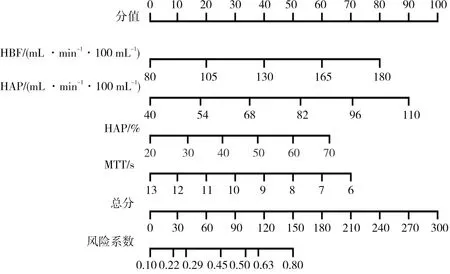
圖1 經TACE治療肝癌患者預后預測列線圖模型Fig.1 Prognostic nomogram model of liver cancer patients treated by TACE
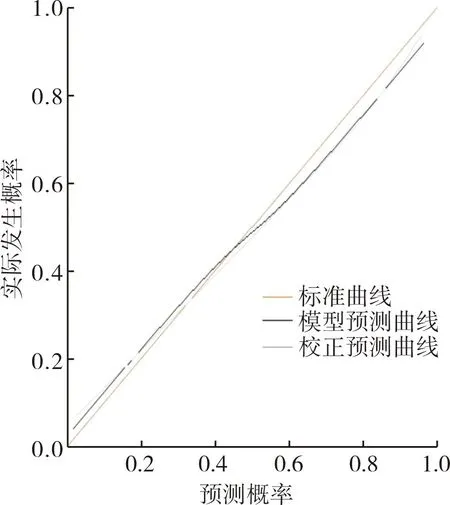
圖2 Calibration驗證經TACE治療肝癌患者預后預測列線圖模型Fig.2 Calibration for prognostic prediction of patients with hepatocellular carcinoma treated by TACE
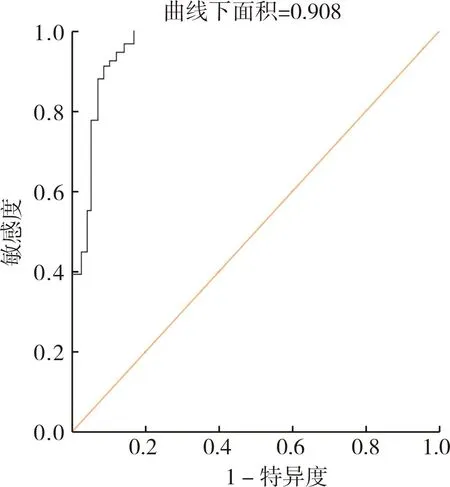
圖3 Bootstrap內部驗證法驗證經TACE治療肝癌患者預后預測列線圖模型ROC曲線圖Fig.3 Bootstrap internal validation validated the ROC curve of the TACE treatment for liver cancer patients
3 討論
TACE是臨床公認治療不能手術切除的中晚期肝癌患者的首選方法,但術后腫瘤復發一直是臨床重點關注的問題[9]。血管生長是腫瘤進展的關鍵環節,新生血管與鄰近組織血管易于在腫瘤細胞活躍期建立側支循環,病灶ROI血流灌注增加,TACE通過栓塞肝腫瘤病灶血供,減少血流量后使腫瘤細胞發生缺血缺氧、壞死,評估肝癌患者腫瘤血供特點有望評估患者預后[10-11]。螺旋CT灌注成像基于肝臟雙重供血特點,定量檢測病灶血供以評估血流動力學特點,提供腫瘤生物學行為信息,有望成為判斷預后的依據[12]。
本研究結果顯示,與預后良好組比較,預后不良組患者的HBF、HAP、HAI較高,MTT較短。肝癌病理改變主要是肝細胞彌漫性變性壞死、結締組織增生,此時肝小葉結構、血液循環途徑被改建,廣泛側支循環形成后導致門靜脈血供減少,因肝臟雙重供血的特點,門靜脈灌注不足由肝動脈灌注增加補償,即HBF升高[13-14];HAP、HAI為肝動脈血供指數,肝腫瘤病灶主要由動脈供血,HAP、HAI升高提示腫瘤細胞浸潤程度較深,病灶已出現形態學改變而被檢出,出現此變化趨勢可能與病變組織導致血管扭曲或異性型改變有關[15];肝癌發生后,病灶組織血管管徑、通透性顯著增加,血供更加暢通,即表現為MTT縮短[16]。本研究將HBF、HAP、HAI、MTT納入logistic多因素回歸分析發現,HBF、HAP、HAI、MTT均為影響經TACE治療肝癌患者預后的危險因素,提示臨床可基于CT定量參數探討降低肝癌TACE術后復發風險的方案以提高患者生存率。除CT定量參數外,本研究logistic多因素回歸分析結果亦顯示,包膜不完整、AFP水平高是經TACE治療肝癌患者預后不良的獨立危險因素,分析原因在于:(1)肝癌包膜主要由擴張的肝血竇、纖維結締組織混合組成,完整的包膜可阻止腫瘤細胞浸潤、轉移,側支循環形成概率較低,包膜完整性被破壞后,腫瘤易透過包膜進入周圍組織,侵襲能力、轉移能力均較強,不利于預后[17-18];(2)在免疫系統中,AFP可通過改變CD4+/CD8+T淋巴細胞亞群比例誘導淋巴細胞死亡,降低機體免疫功能,而免疫功能低下可促進腫瘤復發、轉移,即AFP水平越高,肝癌TACE術后復發風險越大[19]。
列線圖基于個體預測變量的數值計算總分,根據總分評估某事件發生風險或生存概率。有研究報道,基于淋巴細胞與血小板評分評估列線圖模型預測肝細胞癌肝切除術后預后的效能,結果顯示該模型擬合度較高,預測效能良好[C-index:0.732(95%CI:0.691~0.774)][20]。本研究基于logistic多因素回歸分析篩選出的CT定量參數建立經TACE治療肝癌患者預后預測列線圖模型,Calibration驗證結果顯示,實測值與預測值結果基本一致,表明該模型預測性能良好;C-index為0.908(95%CI:0.787~0.968),提示該模型區分度及準確度較好。
4 結論
包膜不完整、AFP水平高、HBF高、HAP高、HAI高、MTT低是TACE后肝癌患者預后不良的獨立危險因素,基于上述CT定量參數構建的經TACE治療肝癌患者預后列線圖模型預測效能較高。本研究為單中心研究、選取樣本量有限,可能降低檢驗效能,后續需進一步擴大樣本量、開展多中心試驗以提高本研究相關結論論證強度。

