結構性心臟病介入治療2023 年度報告精要
中國醫師協會心血管分會結構性心臟病學組
結構性心臟病(structural heart disease,SHD)是近年來心血管領域發展最快速的方向,隨著SHD治療新技術的不斷研發及推廣,SHD這一概念逐步被公眾所熟知[1]。2023年國內外在SHD介入治療領域取得較大突破,高質量基礎和臨床研究層出不窮,值得總結、思考和展望。本報告將過去1年主動脈瓣介入治療、二尖瓣反流(mitral regurgitation,MR)介入治療、三尖瓣反流(tricuspid regurgitation,TR)介入治療、左心耳封堵術(left atrial appendage closure,LAAC)及先天性心臟病(congenital heart disease,CHD)介入治療等方面取得的關鍵性成果進行了深度的梳理,內容涵蓋了國內外的器械研發、臨床診療、指南共識等方面的最新進展,并展望未來行業發展趨勢,以期進一步推動SHD領域更好地發展。
1 經導管主動脈瓣置換
1.1 研究進展
PARTNER 3研究[2]是一項前瞻性、多中心、隨機對照試驗,納入1 000例外科手術風險較低的重度主動脈瓣狹窄(aortic stenosis,AS)患者,1∶1隨機接受SAPIEN 3球囊擴張式瓣膜經導管主動脈瓣置換術(transcatheter aortic valve replacement,TAVR)或外科主動脈瓣置換術(surgical aortic valve replacement,SAVR)。在5年隨訪期間,TAVR組和SAVR組的臨床事件發生率均較低且相似(全因死亡率10.0%比8.2%;腦卒中發生率5.8%比6.4%;再入院率13.7%比17.4%)。TAVR和SAVR均可有效改善瓣膜血流動力學,兩組的主動脈瓣口面積、生物瓣膜衰敗發生率(3.3%比3.8%)與結構性瓣膜退化發生率(4.2%比3.8%)比較,差異均無統計學意義。Evolut Low Risk研究[3]旨在比較TAVR和SAVR在外科手術低危的重度AS患者中的結局,TAVR組4年時全因死亡率和致殘性腦卒中的總體發生率明顯低于SAVR組(10.7%比14.1%,HR0.74,P=0.05),TAVR組的復合終點事件(全因死亡、致殘性腦卒中或主動脈瓣再入院)發生率較低(18.0%比22.4%,HR0.78,P=0.04),心房顫動(房顫)發生率更低(14.0%比40.8%,P<0.0 0 1),新植入永久起搏器的比率更高(24.6%比9.9%,P<0.001),瓣膜再干預發生率相似(1.3%比1.7%,P=0.63),表明在低危人群中采用Evolut系列的TAVR可能優于SAVR,但永久起搏器植入風險或是年輕患者需要考慮的重要因素。該兩項研究證明,外科手術低危的AS患者行TAVR的長期效果不劣于SAVR。
傾向性評分匹配研究納入783對中危重度AS患者,比較了接受SAPIEN 3球囊擴張式瓣膜TAVR與SAVR手術的5年結局。SAPIEN 3 TAVR和SAVR的5年主要終點(死亡率和致殘性腦卒中)差異無統計學意義(40.2%比42.7%,HR0.87,95%CI0.74~1.03,P=0.10)。SAPIEN 3 TAVR展現出了更為優異的長期血流動力學結果,有效瓣口面積大于SAVR(1.6 cm2比1.4 cm2),P<0.0001),兩組平均跨瓣壓差[11.2 mmHg比10.6 mmHg(1 mmHg=0.133 kPa),P=0.59]相近[4]。對接受CoreValve/Evolut R TAVR和SAVR治療的中高危AS患者的預后分析發現,與SAVR相比,TAVR組在30 d隨訪或出院時的有效瓣口面積更大[(1.1±0.3)cm2比(0.9±0.3)cm2,P<0.001],平均跨瓣壓差更小[(8.8±3.9)mmHg比(12.3±5.8)mmHg,P<0.001],而這些數據在隨后的5年隨訪中基本保持不變[5]。上述研究顯示,TAVR長期血流動力學表現優于SAVR,該趨勢在自膨脹式瓣膜中更明顯。
小瓣環AS患者的瓣膜選擇和手術方式尚無定論,Swiss TAVI登記研究5年隨訪結果[6]顯示,在小瓣環患者中自膨脹式瓣膜在血流動力學方面優于球囊擴張式瓣膜[平均壓差(8.0±4.8)mmHg比(12.5±4.5)mmHg,P<0.001;有效瓣口面積(1.81±0.46)cm2比(1.49±0.42)cm2,P<0.001],但死亡率差異無統計學意義(50.4%比39.6%,P=0.269)。此外,自膨脹式瓣膜也帶來了更高的致殘性腦卒中發生率(6.6%比0.6%,P=0.030),自膨脹式瓣膜的血流動力學優勢并未轉化為臨床獲益。VIVA研究顯示,在小瓣環AS患者中,TAVR或SAVR的2年全因死亡、腦卒中或心臟再入院率差異無統計學意義[7]。對于小瓣環AS患者,最佳治療方式仍有待長期隨訪或更大型研究證實。
TAVR的社會經濟學效益顯著,其廣泛應用不僅挽救了眾多外科手術高危或禁忌的AS患者,降低了全球多個國家AS患者的總體死亡率,而且帶來了顯著的社會經濟學效益[8-9]。磁共振成像(magnetic resonance imaging,MRI)指導與CT引導的TAVR之間在器械成功率方面差異無統計學意義,對無法接受增強CT檢查的患者,MRI可能是TAVR術前評估的替代選擇[10]。隨著TAVR適應證向低齡、低危人群拓展,該人群的預期壽命較長,可能需要不止一次的干預治療,因此,TAVR瓣膜衰敗后的再次TAVR治療成為目前的研究熱點,冠狀動脈風險、血流動力學及冠狀動脈通路評估是當下面臨的關鍵問題[11-12]。
1.2 器械研發
DurAVR THV仿生瓣膜由單片天然形狀的組織制成,一體式瓣膜設計與天然主動脈瓣膜極為相似,理論上可提供更好的血流動力學性能和預期壽命。首次人體試驗(first in man,FIM)研究[13]表明,DurAVR THV仿生瓣膜具有良好的安全性,預期可在1年內維持血流動力學性能,并恢復接近正常的血流動力學[30 d和1年的有效瓣口面積(2.00±0.17)cm2比(1.96±0.11)cm2;平均跨瓣壓差(9.02±2.68)m mHg比(8.82±1.38)m m H g]。作為主動脈瓣反流(a o r t i c regurgitation,AR)領域備受關注的一款瓣膜,ALIGN-AR研究[14](NCT04415047)27例初步觀察性結果表明,對于單純AR且手術風險過高的患者,JenaValve置換似乎是手術的安全有效替代方法。2 0 2 3 年美國經導管心血管治療學術會議(Transcatheter Cardiovascular Therapeutics,TCT)上公布的ALIGN-AR的1年隨訪結果[15]令人鼓舞,30 d主要安全性終點發生率為26.7%,1年主要有效性終點發生率為7.8%,關鍵試驗結果已于2024年3月正式在Lancet上發表,有望成為美國首個批準用于治療嚴重癥狀性AR的TAVR產品。體外聚焦超聲震波技術作為一種創新的無創性治療AS的方法,一經面世就備受學術界關注,研究納入了2019至2022年期間接受無創性超聲治療的40例嚴重癥狀性AS患者,無手術相關死亡、危及生命或腦血管事件發生,6個月隨訪證實瓣膜功能改善,平均主動脈瓣面積增加10%,平均跨瓣壓差降低7%,96%患者紐約心臟病協會心功能分級(New York heart association functional classification,NYHA-FC)改善或穩定,堪薩斯城心肌病問卷調查評分改善了33%[16]。在TAVR輔助器械方面,國外推出了一款兼具起搏和壓力檢測功能的TAVR專用導絲SavvyWire,研究證實其效果良好,未來的應用值得期待[17]。
1.3 指南共識
2023年,我國相繼發布了《經導管主動脈瓣置換術臨床實踐指南》[18]、《心尖入路經導管主動脈瓣植入手術操作規范》[19]、《心尖途徑經導管主動脈瓣置換術圍術期管理規范專家建議》[20]、《經皮主動脈瓣置入患者冠狀動脈粥樣硬化性心臟病管理專家共識》[21]以及《體外膜肺氧合輔助循環崩潰高風險經導管主動脈瓣置換術技術要點專家共識》[22],有望進一步推動TAVR技術的推廣和規范應用,提高醫療質量。值得一提的是,TAVR最初用于治療AS,隨后逐漸擴展至AR,國內外學者探索使用已上市的經股動脈TAVR瓣膜以“超適應證”方式治療AR患者,與AS相比,AR在解剖結構、瓣膜選擇、操作方式以及并發癥等方面具有不同的特點,已上市的經股動脈TAVR瓣膜治療AR手術難度大、成功率更低。為促進我國經股動脈TAVR治療AR安全、規范、健康發展,中國醫師協會心血管內科醫師分會結構性心臟病學組牽頭制定了國內外首部針對單純AR的指導文件《單純主動脈瓣反流經股動脈主動脈瓣置換中國專家共識2023》[23],為該技術的臨床使用提供了重要技術支持和指導。
1.4 國內動態
截至2023年11月30日,2023年度國內已完成13 572例TAVR手術,而2023年1—10月TAVR置入量排名前五的分別是北京、四川、廣東、上海和浙江。根據國家經導管瓣膜治療數據庫,全身麻醉(89%)是我國TAVR手術的主要麻醉方式,而最常用的入路方式仍是經股動脈(76.8%),其次是經心尖入路(21.7%)。隨著TAVR適應證的拓寬,中低風險TAVR患者逐漸增多,在2010年至2023年接受TAVR手術的患者中,中低風險TAVR患者占比82.61%。TAVR圍術期不良事件發生率持續下降,新發左束支傳導阻滯(8.60%)、新發房室傳導阻滯(6.96%)和永久起搏器植入(6.54%)是目前圍術期不良事件的前三位。
2023年,TAVR器械在中國發展迅速,目前國內已有多款瓣膜上市應用(圖1),包括VenusA/VenusA Plus、TA J-valve、VitaFlow/VitaFlow Liberty、Sapien 3、Taurus One/Elite和Evolut Pro等。同時,眾多瓣膜蓄勢待發,逐步進入臨床研究階段,其中單純AR經股TAVR器械的研發成為新熱點,器械包括HanChorValve、TF J-Valve、TF JenaValve、DOCS valve、PioneerValve等。PrizeValve、MuguetA和Renatus等球囊擴張式瓣膜已完成臨床試驗入組或已提交上市審批材料,即將填補市場空白。新型自膨脹式瓣膜如ALLEGRATMPlus、Venus Power X等將對目前上市瓣膜進行升級。世界首個聚合物TAVR瓣膜TRISKELE已完成FIM研究,初步臨床研究結果極佳,聚合物瓣膜或將引領未來[24]。

圖1 2023 年中國經導管主動脈瓣置換術瓣膜匯總Figure 1 Summary of transcatheter aortic valve replacement valves in China in 2023
我國主動脈瓣領域的基礎和臨床研究也取得了較大突破。王建安院士團隊揭示了二葉式主動脈瓣形成的新機制,吳永健教授團隊開發出TAVR術前主動脈瓣復合區CT評估及解剖風險因子檢測全自動算法,基于深度學習實現了TAVR術前影像評估的關鍵突破。Hanchor Valve是中國首款經股動脈治療單純AR的球囊擴張式瓣膜器械,復旦大學附屬中山醫院潘文志教授代表中山團隊在2023年TCT大會報告了Hanchor Valve器械的創新設計及早期臨床結果,單中心27例確證性臨床試驗30 d的隨訪顯示手術成功率為100%,術中無不良事件發生,所有患者術后即刻反流降至無或微量,左心室舒張末期內徑明顯改善。此外,潘教授通過1例超大瓣環單純天然AR病例,向全球同行展示了其與周達新教授發明的“三明治”置入法,關鍵操作技巧及早期經驗已發表[25-26]。因此“三明治”瓣中瓣置入技術可能是治療高危手術風險AR患者的一種重要選擇。
1.5 年度展望
2023年TAVR領域取得了顯著進展,新器械的研發如火如荼,新型自膨脹式瓣膜和球囊擴張式瓣膜可能于2024年獲批上市。TAVR技術日趨成熟,手術量逐年增加,適應證逐步拓寬,但仍面臨諸多挑戰,主要集中在小瓣環、耐久性、冠狀動脈入路等方面。雖然我國在器械研發上取得了令人滿意的成績,但總體上仍缺乏高質量的前瞻性、隨機對照研究。隨著共識的發布及技術的提高,單純AR經股動脈TAVR手術量將顯著增加,診斷和治療可能更加規范。
2 經導管MR介入治療
2.1 經導管二尖瓣修復術
2.1.1 MitraClip系統 MitraClip經導管二尖瓣夾系統是目前應用最廣泛的M R 介入治療器械。COAPT試驗[27]5年隨訪顯示使用MitraClip系統經導管緣對緣修復(transcatheter edge-toedge repair,TEER)能持續給心力衰竭合并MR患者帶來獲益。研究共納入614例心力衰竭合并中重度或重度功能性MR患者,隨機分為MitraClip+指南指導的藥物治療(guideline-directed medical therapy,GDMT)組和單純GDMT組。在5年隨訪期間,MitraClip+GDMT組因心力衰竭年再入院率明顯低于單純GDMT組(33.1%比57.2%,HR0.53,95%CI0.41~0.68),全因死亡率分別為57.3%和67.2%(HR0.72,95%CI0.58~0.89),心力衰竭再入院或死亡的發生率分別為73.6%和91.5%(HR0.53,95%CI0.44~0.64)。在接受TEER治療的患者中,僅1.4%患者在5年內發生器械特異性安全事件,且均發生在術后30 d內。然而,隨著隨訪時間延長,兩者生存曲線有接近趨勢,提示這些患者除了解決MR外,其原發疾病的治療仍是根本。
STS/ACC TVT隊列研究[28]分析了19 088例接受MitraClip器械進行TEER手術的單純中重度或重度退行性MR患者,在術后30 d內NYHA-FC顯著改善,死亡、腦卒中、二尖瓣再介入發生率分別為2.7%、1.2%和0.97%。隨訪1年時,死亡率為15.4%,二尖瓣再介入發生率為3.4%,與手術不成功的患者相比,成功患者的死亡率(14.0%比26.7%,HR0.49,95%CI0.42~0.56)、因心力衰竭再入院率(8.4%比16.9%,HR0.47,95%CI0.41~0.54)和二尖瓣介入發生率(2.1%比13.5%,HR0.15,95%CI0.12~0.19)均顯著降低。在手術成功的患者中,殘余MR≤1+且平均二尖瓣壓力梯度≤5 mmHg的患者死亡率(11.4%比26.7%,HR0.40,95%CI0.34~0.47)和因心力衰竭再入院率(6.2%比16.9%,HR0.35,95%CI0.30~0.41)最低,證實在真實臨床實踐中,MitraClip能為退行性MR患者帶來獲益,同時也提示要盡量使得患者達到最優手術效果(殘余MR≤1+且平均二尖瓣壓力梯度≤5 mmHg),患者的臨床獲益才會最大。
EXPA ND G4研究[29]納入了1 164例接受MitraClip G4系統治療的器質性或功能性MR患者,在從基線到一年的配對分析中,92.9%的患者在治療后實現了MR≤1+,術后30 d和1年的MR≤1+的比例無顯著變化。與基線相比,患者的NYHA-FC顯著改善,生活質量得到顯著提高,隨訪1年時總人群全因死亡率、因心力衰竭再入院率、復合終點發生率分別為12.3%、16.9%和24%。該大樣本前瞻性研究證實了MitraClip G4系統在真實世界中治療MR安全有效,超過90%的患者MR嚴重程度持續降低,功能狀態和生活質量均得到改善。
OCEAN-Mitral日本注冊研究[30-31]共納入2018年4月至2021年6月接受MitraClip TEER治療的2 150例MR患者,新舊型號的TEER器械均具有良好的手術成功率(MitraClip G2 94.7%比G4 94.6%,P=0.961),證實了MitraClip TEER系統用于癥狀性原發性和繼發性MR患者的良好短期結局。
2.1.2 PASCAL系統 CLASP IID隨機對照研究[32]納入了來自57家中心300例退行性MR 3+或4+且有外科手術禁忌的患者,2∶1隨機分配至PASCAL組和MitraClip組。1年隨訪時,PASCAL組和MitraClip組的全因死亡率(8.8%比8.4%,P=0.953)、因心力衰竭再入院率(8.1%比3.3%,P=0.146)和主要不良事件發生率(15.3%比11.7%,P=0.471)相比,差異均無統計學意義。PASCAL組術后1年時MR≤2+的患者比例不劣于MitraClip組(95.8%比93.8%)。在MR情況、超聲心動圖結果、NYHA-FC和生活質量方面也有持續的總體改善,證實PASCAL系統是手術風險過高的癥狀性重度退行性MR患者有效的治療方法,基于該研究PASCAL系統也獲得美國食品藥品監督管理局(Food and Drug Administration,FDA)批準上市。
2.1.3 ValveClamp和DragonFly系統 世界首個經心尖TEER器械V alveClamp的上市前多中心研究(CLAMP-2研究)[33]結果顯示,急性手術成功率為97%,88%的患者僅需置入1枚夾合裝置即可達到治療目標,術后1年的有效終點率為87.3%,不劣于國外同類產品。基于此研究,ValveClamp于2023年9月8日在我國上市,成為國產首個上市的MR介入治療器械。2023年歐洲心血管介入醫學(EuroPCR)大會公布了DRAGONFLY-DMR確證性臨床試驗結果[34],目前已正式發表于EuroIntervention。該研究旨在評價DragonFly系統治療MR的安全性和有效性,共納入來自中國27家中心120例癥狀性MR≥3+合并外科手術高危的退行性MR患者。術后即刻手術成功率和器械置入成功率均為99.2%,術后12個月治療成功率為87.5%,MR≤2+占比92.0%,NYHA-FC和生活質量均顯著改善,證明了DragonFly經導管二尖瓣瓣膜夾系統具有良好的安全性和有效性,或為外科手術高危的退行性MR患者提供更多的治療選擇。基于此研究,Dragonfly于2023年11月29日獲國家藥品監督管理局(National Medical Products Administration,NMPA)批準正式上市,成為國產首個上市的經股靜脈TEER器械。
2.2 經導管二尖瓣置換術
根據自體二尖瓣的類型,經導管二尖瓣置換術(transcatheter mitral valve replacement,TMVR)可分為4種方式:(1)生物瓣損毀后的瓣中瓣(ViV),針對既往外科二尖瓣生物瓣衰敗的患者;(2)成形環中瓣(ViR),針對既往外科瓣膜成形術置入人工二尖瓣瓣環的患者;(3)鈣化環中瓣(ViMAC),針對自身二尖瓣瓣環嚴重鈣化或關閉不全的患者;(4)自體瓣中瓣,針對二尖瓣瓣環無明顯鈣化的患者。
2023年EuroPCR會議展示了MITRAL試驗[35]5年隨訪結果,研究納入嚴重二尖瓣狹窄或MR且NYHA-FC Ⅱ級以上的患者或心臟團隊評估為高危手術風險的患者,平均分配至ViV(N=30)、ViR(N=30)以及ViMAC(N=31)3種治療策略中。5年全因死亡率分別為21.4%、65.5%和67.9%,二尖瓣再介入發生率分別為3.6%、10.3%和17.9%,生活質量評分與基線相比持續改善,各組二尖瓣人工瓣膜功能保持穩定。ViV、ViR和ViMAC TMVR是高危手術風險患者的合理選擇。
CHOICE-MI研究[36]將接受TMVR治療的262例功能性MR患者和EuroSMR注冊研究中接受TEER治療的1 065例功能性MR患者進行傾向性匹配分析發現,盡管TMVR術后30 d(6.8%比3.8%)與1年(25.8%比18.9%)的全因死亡率均略高于TEER,但組間比較,差異均無統計學意義。在30 d界標分析中,兩組的1年死亡率比較,差異無統計學意義(TMVR 20.4%比TEER 15.8%,P=0.21)。與TEER相比,TMVR術后出院時MR≤1+的患者比例(95.8%比68.8%,P<0.001)以及1年時NYHA-FC≤Ⅱ級的患者比例(77.8%比64.3%,P=0.015)均更高,提示TMVR與更好的MR減少和更好的癥狀改善相關。另一項與COAPT試驗中接受GDMT治療的功能性MR患者傾向性匹配分析[37]表明,TMVR組的2年因心力衰竭再入院率明顯低于GDMT組(32.8%比54.4%,HR0.59,95%CI0.35~0.99,P=0.04)。在1年和2年時,TMVR組所有患者的殘余MR均≤1+,而單純接受GDMT的患者分別為6.9%和7.7%,TMVR組NYHA-FCⅠ/Ⅱ級的患者比例均高于GDMT組(1年時78.2%比59.7%,P=0.03,2年時77.8%比53.2%,P=0.09)。兩組的2年死亡率相似(TMVR 36.8%比GDMT 40.8%,HR1.01,95%CI0.62~1.64,P=0.98),表明TMVR與GDMT相比可顯著降低MR、改善臨床癥狀、減少因心力衰竭再入院率,但未能降低死亡率。
二尖瓣生物瓣衰敗后再次外科二尖瓣置換(redo surgical mitral valve replacement,Redo SM V R)或T M V R 預后的證據有限,一項傾向性評分匹配分析[38]納入了4 293例患者(Redo SMVR:64%;TMVR:36%),匹配隊列的3年主要不良心血管事件(major adverse cardiovascular e v e n t s,M A C E)風險相當(校正H R0.9 2,95%CI0.80~1.04,P=0.2),界標分析顯示前6個月TMVR的MACE風險較低(校正HR0.75,95%CI0.63~0.88,P<0.001),6個月后風險較高(校正HR1.28,95%CI1.04~1.58,P=0.02)。這表明在二尖瓣生物瓣衰敗患者中,Redo SMVR和TMVR在3年時具有相似的結局,TMVR的初始風險較低,但6個月后MACE的風險較高。
Tendyne TMVR系統是一款經心尖入路的二尖瓣介入治療器械,于20 20年2月獲得歐盟(Conformite Europeenne,CE)認證,是全球首個獲批上市的介入二尖瓣置換裝置。其在美國上市關鍵臨床試驗SUMMIT(比較Tendyne與MitraClip的安全性和有效性)正在進行中。HighLife TSMVR是一款經房間隔穿刺入路的二尖瓣置換系統,采用獨特的“Valve in Ring”設計理念,具有自適應、自同軸的特點,目前已在超過30家國際中心完成超100例以上研究性臨床置入,在中國的上市前臨床研究也在進行中。2023年EuroPCR大會公布的HighLife歐洲/澳洲臨床試驗的1年主要終點結果顯示,52例患者的整體HighLife技術成功率為88%,100%患者安全離開手術室,術后30 d全因死亡和全因死亡+大出血復合終點發生率均為13.5%,術后30 d至1年患者維持了良好的血流動力學改善。Intrepid瓣膜也是一款臨床置入最多的TMVR瓣膜之一,新一代的Intrepid瓣膜采用經股靜脈置入,其早期可行性研究評估了中重度MR患者經股靜脈置入Intrepid瓣膜30 d和1年的結果,共納入33例患者,31例(93.9%)患者成功置入,30 d時未發生死亡或腦卒中,8例(24.2%)患者發生重大血管并發癥,無需外科干預,4例患者發生了靜脈血栓栓塞,均成功治療無后遺癥,1年全因死亡率為6.7%,所有患者均無/微量瓣周漏,91.7%的生存者NYHA-FC處于Ⅰ/Ⅱ級,生活質量評分改善,顯示出良好的安全性和持久的瓣膜功能[39]。
2.3 指南共識
TEER已被2020年美國心臟病學會(American College of Cardiology,ACC)/美國心臟協會(American Heart Association,AHA)瓣膜指南及2021年歐洲心臟病學會瓣膜指南列為外科手術高危的MR患者的重要治療方式,目前已成為心臟介入手術領域最熱門的技術之一[40-41]。我國在該領域起步較晚,因缺乏規范的臨床路徑,2023年3月中國醫師協會心血管內科醫師分會結構性心臟病學組基于目前的循證醫學證據以及臨床應用經驗,發布了《中國經導管二尖瓣緣對緣修復術臨床路徑(2022版)精簡版》[42],針對TEER團隊建設、患者臨床評估、影像評估、手術規范流程、復雜病變處理、圍術期管理、全生命周期康復和隨訪等關鍵問題進行梳理,以推動TEER技術在我國安全、規范地開展和推廣。為規范TEER患者的心臟康復,2023年4月《經導管二尖瓣緣對緣修復術患者心臟康復中國專家共識》[43]發布,對個體化康復評估、康復教育、運動康復、藥物治療,營養、心理、睡眠和戒煙等相關問題干預提供建議,為TEER患者提供從住院到居家的綜合康復管理方案。
2.4 國內動態
2020年6月,MitraClip系統在中國獲批上市,為我國MR患者提供了微創治療選擇,已在全國近百家醫院開展,2023年12月,新一代的MitraClip G4系統在我國獲批上市。我國2021年、2022年開展的TEER分別為182例、355例,但在2023年,我國TEER猛增至1 274例。隨著近年來該技術在我國的快速發展,涌現出一批國產創新TEER器械,2023年,捍宇醫療ValveClamp二尖瓣夾系統和德晉醫療DragonFly經導管二尖瓣夾系統已經獲批,國內自主研發的TEER器械,如NovoClasp(應脈醫療)、ValveClasp(捍宇醫療)、SQ-Krine(申淇醫療)、ValveClip(紐脈醫療)、NeoNova(臻億醫療)、KokaClip(科凱醫療)、JensClip(健世醫療)等,正在進行上市前臨床研究,有望為TEER領域提供更多的選擇。
2.5 年度展望
MR介入治療發展迅猛,近年來在適應證上不斷拓展,多項臨床試驗表明,TEER技術可以有效降低MR的嚴重程度,改善患者的癥狀和預后。二尖瓣創新修復器械的研發方興未艾,多種TMVR系統已進入臨床試驗階段,或將為MR患者提供更微創、更安全有效的治療方案。二尖瓣介入治療同時也存在諸多挑戰,由于二尖瓣解剖結構復雜,人工瓣膜的定位和固定困難,且易引起各種并發癥,二尖瓣介入治療器械仍需進一步優化,需要進一步開展大規模的隨機對照試驗,探究TMVR的時機和安全性,為臨床決策提供更有力的證據支持。
3 經導管三尖瓣介入治療
3.1 經導管三尖瓣置換
EVOQUE瓣膜系統由鎳鈦合金自膨脹框架、瓣膜內環密封圈以及牛心包瓣葉組成,于2023年10月19日獲得CE認證,用于對符合條件的TR患者進行經導管治療。2023年11月,TRISCEND研究1年結果[44]公布,研究納入了176例經藥物治療后仍有≥中度癥狀性TR患者,經股靜脈EVOQUE三尖瓣置換術后1年全因死亡率為9.1%,因心力衰竭再入院率為10.2%,97.6%的患者TR減輕至輕度或微量,心功能和生活質量明顯改善,93.3%的患者NYHA-FC改善至Ⅰ/Ⅱ級,生活質量評分較基線提高25.7分,6分鐘步行距離較基線增加56.2 m。2022年11月,Topaz經導管三尖瓣置換系統首次被報道用于治療重度功能性TR患者,取得了良好的短期效果[45],2023年TCT會議上公布了Topaz經導管三尖瓣置換系統早期臨床試驗結果,研究共納入11例患者, 隨訪30 d時,1例患者死亡,90%患者TR降低至無/微量,患者NYHA-FC均恢復至Ⅰ/Ⅱ級。TricValve經導管雙腔瓣膜系統由兩個自膨脹式生物瓣膜組成,用于治療TR和腔內反流患者,TRICUS研究和TRICUS EURO研究旨在探究NYHA-FC Ⅲ/Ⅳ級的嚴重TR患者置入TricValve瓣膜的安全性和有效性[46],42例(95.5%)患者術后1年臨床癥狀改善,死亡率(6.8%)和因心力衰竭再入院率(29.5%)較低,所有患者均未發生支架斷裂、傳導系統紊亂及有臨床意義的小葉血栓,63.8%患者肝靜脈回流消失,初步證實了TricValve經導管雙腔瓣膜治療腔靜脈回流且不宜接受外科手術的嚴重癥狀性TR患者具有良好的安全性和有效性。
3.2 經導管三尖瓣修復
經導管三尖瓣修復包括TEER、瓣環成形、反流口填充等類型。TEER是國際上使用最為廣泛的三尖瓣介入修復技術,TriClip和PASCAL系統均已優先取得了CE認證,另一款三尖瓣環縮器械Cardioband系統也獲得CE認證。其他修復器械仍處于早期臨床應用階段,例如Trialign、TriCinch。FORMA系統利用填充物的形式占用三尖瓣瓣口以減少TR,處于研究之中。
bRIGHT研究[47]納入511例有癥狀的重度TR患者,主要終點為急性手術成功率,次要終點為全因死亡率或1年后三尖瓣再干預發生率。99%的受試者成功置入TriClip器械,77%的患者在30 d時TR降至中度以下。NYHA-FC和生活質量評分均顯著改善。14例(2.5%)受試者在術后30 d內出現嚴重不良事件。TRILUMINATE Pivotal研究[48-49]旨在評估TriClip經導管三尖瓣修復系統治療重度癥狀性TR患者的安全性和有效性,納入來自全球多中心350例癥狀性重度TR患者,1年隨訪結果表明,TriClip能夠安全有效地減少TR程度,并與患者1年后生活質量的改善相關。與藥物治療相比,TriClip TEER并未增加患者的死亡率、重大不良事件發生率或因心力衰竭再入院率,為重度TR患者提供了一種新的治療手段。
PASCAL修復系統是用于治療MR的TEER器械,2017年首次應用于TR治療,于2020年5月獲得三尖瓣介入治療的CE認證。CLASP TR[50]是一項單臂、多中心、前瞻性研究,旨在評估PASCAL經導管瓣膜修復系統用于TR患者的安全性和有效性,共納入65例TR患者,97%為重度以上的TR,隨訪1年時發現受試者TR嚴重程度顯著降低,31例患者TR程度降至中度以下,且所有患者TR程度均至少降低1個等級。1年內免于全因死亡和因心力衰竭再入院的比例分別為87.9%和78.5%。所有患者NYHA-FC均顯著改善,92%患者NYHA-FC改善至Ⅰ/Ⅱ級,6分鐘步行距離和生活質量評分均顯著提高。
Mistral是一種經皮三尖瓣修復裝置,通過抓住和向內拉動三尖瓣的腱索達到減少瓣膜反流的效果。2022年9月,Mistral治療嚴重功能性TR患者的FIM研究[51]發表,30 d研究結果顯示,Mistral可減少TR并改善右心室功能和運動能力。6個月和1年隨訪結果均提示基于Mistral的三尖瓣修復具有良好的安全性和有效性[52-53]。
3.3 指南共識
2023年4月,國家心血管病專家委員會微創心血管外科專業委員會牽頭發表了全球首部聚焦于左心瓣膜術后TR診療的專家共識,圍繞左心瓣膜術后TR的發病機制、術前評估、手術干預指征、外科手術、介入手術、術后管理等方面進行了全面總結和討論,以推動TR的規范化診治[54]。2023年12月,歐洲心力衰竭協會(Heart Failure Association,HFA)聯合歐洲經皮心血管介入學會(European Association of Percutaneous Cardiovascular Interventions,EAPCI)共同發布《2023 HFA/EAPCI臨床共識聲明:慢性右心衰竭和三尖瓣反流的流行病學、病理生理學、診斷和管理》[55],總結了目前關于右心衰竭TR的流行病學、病理生理學和治療的知識,為患者的識別和診療管理提供實用的建議。
3.4 國內動態
LuX-Valve是我國自主研發的經導管人工三尖瓣瓣膜置換系統,采用非徑向支撐力錨定的方式,不影響患者心臟收縮功能及三尖瓣周圍重要解剖結構。LuX-Valve Plus是LuX-Valve第二代產品,對輸送系統進行了改造和升級,采用經頸靜脈置入,2023年2月,LuX-Valve Plus FIM研究[56]結果發表,90%的TR患者在術后30 d隨訪時處于NYHA-FC Ⅰ/Ⅱ級,全部患者TR分級降低至無/輕微,無患者死亡;1例(10%)患者需要植入起搏器,未發生其他嚴重不良事件,證實LuX-Valve Plus系統在嚴重TR患者中手術成功率高、安全性好,臨床效果顯著。目前,我國已有2款經導管三尖瓣修復器械進入臨床研究階段,包括經導管三尖瓣瓣膜夾系統DragonFly-T和K-Clip三尖瓣修復系統。DragonFly-T是一款經股靜脈TR修復系統,2020年12月15日完成中國大陸首例人體臨床應用。K-Clip是我國自主研發的一款基于夾子的三尖瓣環修復設備,動物實驗表明K-Clip系統可顯著縮小豬模型的三尖瓣瓣環面積并降低TR程度[57],FIM研究進一步證實了K-Clip系統良好的手術成功率、可接受的安全性和顯著的臨床改善效果[58]。我國經導管三尖瓣器械研發呈蓬勃發展之勢,NeoBlazar、DragonFly-T、Koka Clam p、Cardiovalve、MonarQ等新器械必將極大促進經導管三尖瓣治療技術的發展。
3.5 年度展望
TR是一種曾被忽視的右心系統疾病,既往藥物及外科手術治療效果均不理想,經導管三尖瓣介入治療技術展現出良好的有效性和安全性,并逐漸改寫了三尖瓣治療的策略和指南。盡管我國在這一領域起步較晚,但在器械的研發上勢頭強勁,未來將根據TR患者的病因和解剖特征,基于多模態影像和AI輔助等技術為患者制定個性化的治療策略。預計在未來幾年,我國將有商業化三尖瓣介入產品上市,有望為我國TR患者提供更多的選擇。
4 經導管LAAC
4.1 研究進展
NCDR研究[59]基于美國國家心血管數據探究了WATCHMAN左心耳封堵器置入術后的長期臨床結局,共納入2016年1月至2019年12月期間的34 975例患者,41.8%為女性,平均年齡77.5歲,平均CHA2DS2-VASc評分4.7分,平均HAS-BLED評分3.1分,33.1%患者存在充血性心力衰竭、21.3%患者存在腦卒中,盡管入組患者基線血栓栓塞風險較高,但置入WATCHMAN后長期腦卒中發生率較低,術后1年、2年、3年、3.7年腦卒中發生率分別為0.013%、0.027%、0.04%和0.05%,生存曲線分析顯示,置入WATCHMAN封堵器術后1年、2年、3年、4年生存率分別為91.4%、82.6%、74.4%、63.8%,提示WATCHMAN對高齡、高危房顫患者具有良好的保護性。
SURPASS研究[60]是迄今為止最大樣本量的WATCHMAN FLX真實世界研究,共納入2020年8月至2022年8月期間743家中心接受置入治療的66 894例患者,共18 233例患者接受1年隨訪。WATCHMAN FLX置入密封性高,術后45 d復查殘余分流<3 mm的患者比例高達96%,術后1年隨訪顯示,84%的患者術后未出現任何殘余分流。隨訪1年后,接受WATCHMAN FLX置入的患者的全因死亡、腦卒中、大出血、缺血性腦卒中風險分別為8.3%、1.6%、6.7%和1.2%,證明了WATCHMAN FLX置入安全有效,在預防腦卒中方面效果良好。
Amulet IDE研究[61]是一項前瞻性、多中心、開放標簽的隨機對照研究,共納入108家中心的1 878例房顫患者,隨機分至Amulet和Watchman兩組進行LAAC。術后隨訪3年,Amulet組未使用口服抗凝劑的患者比例顯著高于Watchman組(96.2%比92.5%,P<0.01),兩組缺血性腦卒中、體循環栓塞和心血管死亡的復合事件發生率分別為11.1%和12.7%(HR0.87,95%CI0.66~1.14,P=0.31),組間差異無統計學意義,且Watchman組患者在發生缺血性腦卒中和心血管死亡前的器械相關事件(器械相關血栓或器械殘余漏≥3 mm)比Amulet組患者更常見,或有利于Amulet封堵器在臨床的進一步推廣。
SWISS-APERO研究[62]預先指定分析結果表明,術后13個月CT檢查隨訪時,WATCHMAN Gen2.5/FLX封堵器與Amulet封堵器相比,在對比劑通過率、對比劑分流類型及器械相關血栓事件發生率上均相似。在臨床終點事件方面,兩組心原性死亡、腦卒中及系統性栓塞復合終點事件(P=0.829)及各亞組事件發生率(心原性死亡P=0.671、腦卒中P=0.706、系統性栓塞或肺栓塞P=0.341、出血事件P=0.098)差異均無統計學意義。
WATCH-TAVR是一項前瞻性、多中心隨機對照試驗[63],旨在評估與TAVR+藥物治療相比,TAVR+LAAC在合并嚴重AS的房顫患者中的可行性、安全性與有效性。研究納入2017年12月至2020年11月美國34家中心的349例患者,以2年內全因死亡、腦卒中或重大出血事件作為研究復合終點。結果顯示,TAVR+LAAC組的主要終點事件發生率更低,不劣于TAVR+藥物治療(22.7個事件/100患者年比27.3個事件/100患者年,HR0.86,P<0.001),證實了合并房顫的嚴重AS患者行TAVR+LAAC聯合手術的可行性。
4.2 器械研發
動物實驗表明,帶有表面涂層的WATCHMAN FLX Pro封堵器較無涂層封堵器具有更好的內皮化程度,表現出較少的血栓形成和炎癥,或可明顯縮短患者服用抗栓藥物的時間[64]。2023年9月6日,波士頓科學公司宣布,WATCHMAN FLX Pro左心耳封堵器獲得美國FDA的正式批準,采用新型聚合物涂層減少器械相關血栓,實現更快內皮化,增加可視化標記點以提高置入器械的精確度,器械尺寸范圍更大可用于處理大心耳。Laminar LAA是一個球鎖結合的裝置,通過旋轉來關閉左心耳,而并非封堵,有望規避傳統左心耳封堵器存在的血栓形成、殘余漏等弊端。動物研究顯示,在45 d和150 d的所有Laminar LAA受試犬中均未發現殘余漏或器械相關血栓形成,組織學檢查顯示完全閉合的左心耳覆有新生內膜。15例房顫患者順利置入了Laminar LAA裝置,術后12個月內未發生任何安全事件[65]。Laminar LAA展現出不錯的有效性與安全性,未來或在左心耳封堵領域有一席之地,正因如此,2023年11月強生醫療科技宣布完成了對Laminar醫療器械公司的收購。
4.3 指南共識
2 0 2 3 年3 月,《心血管造影和介入學會(Society f or Cardiovascular Angiography and Interventions,SCAI)/美國心律學會(Hea r t R h yt hm Societ y,HRS)經導管左心耳封堵專家共識》[66]再次更新,重點強調了L A A C 術中的“七大”技術細節,包括盡量通過右股靜脈進行,根據術者習慣決定肝素化與房間隔穿刺的先后順序,根據經食管超聲心動圖9 0°時的心耳軸向決定穿刺點高低,多數建議使用雙彎鞘管,強調鞘管進入左心房后的排氣與肝素鹽水沖洗,建議將左心房平均壓提至12 mmHg以上正確測量左心耳,應在釋放前仔細評估封堵器尺寸、錨定穩定性、心耳內定位及殘余分流情況。2023年11月30日,ACC/AHA/美國胸科醫師學會(American College of Chest Physicians,ACCP)/HRS聯合發布了《2023 ACC/AHA/ACCP/HRS心房顫動診斷和管理指南》[67],對LAAC給出了更高級別的推薦,對于CHA2DS2-VASc評分≥2分且有長期口服抗凝禁忌證的患者,經皮LAAC被認為是合理的選擇(Ⅱa級)。對于中高度腦卒中風險且在抗凝治療下有嚴重出血風險的患者,LAAC可能是口服抗凝的合理替代方案(Ⅱb級)。《心房顫動診斷和治療中國指南 2023》[68]建議,有長期抗凝絕對禁忌證的房顫患者,應考慮LAAC(Ⅱa C),有長期抗凝相對禁忌證的腦卒中高風險房顫患者,可考慮行LAAC(Ⅱb C),對于充分抗凝后仍發生腦卒中的房顫患者,排除明確腦血管狹窄相關腦卒中后,可考慮行LAAC(Ⅱb C)。
4.4 國內動態
2023年,我國LAAC完成例數約為26 000例。全國目前有超過700家中心開展LAAC,年置入量大于100臺的有30余家中心,全國LAAC手術呈增長趨勢,總置入量相較于2022年增長超過30%,超過1 000位術者能獨立完成LAAC,以電生理專家為主要術者,其次為冠狀動脈介入專家。Bio-Lefort生物可降解左心耳封堵器上市前臨床試驗進展順利,2023年2月1日,全球首枚Bio-Lefort生物可降解左心耳封堵器于合肥高新心血管病醫院順利置入人體。SimuLock為全球首款仿生型且可組裝式左心耳封堵器,2023年11月8日,復旦大學附屬中山醫院葛均波院士團隊完成SimuLock的前瞻性、多中心、隨機對照確證臨床試驗的全國首例入組和成功置入。普實醫療在LACbes的基礎上不斷創新,正研發分體式結構和仿生設計封堵器,可根據心耳尺寸自由組裝內外盤,在更大程度上匹配不同形態心耳的手術需求,近期將啟動全國上市前臨床試驗。消融聯合LAAC“一站式”手術預防非瓣膜性房顫患者腦卒中的療效和安全性被進一步證實[69-73],心腔內超聲可作為指導LAAC手術操作的潛在工具[74-76]。
4.5 年度展望
LAAC在過去的1年中得到了迅猛發展,器械的結構和功能得到進一步優化,針對器械相關血栓和器械周圍殘余漏的新器械研發和臨床試驗穩步進行,可吸收封堵器逐步嶄露頭角。新型影像和技術手段如3D打印、虛擬現實等使得LAAC手術更快、更安全,讓患者更舒適。然而,目前國內關于LAAC的高質量臨床研究屈指可數,隨著指南推薦等級的提升,期待有更多中國本土高質量研究成果產出。
5 CHD介入治療
5.1 研究進展
2 0 2 3 年3 月,中國醫學科學院阜外醫院閆朝武教授團隊首次揭示了卵圓孔未閉(patent f oramen ovale,PFO)相關腦卒中的新機制[77],研究發現,腦卒中組、偏頭痛組和無癥狀組分別有8 3.7%、5 7.1%和0 例患者通過光學相干斷層成像技術檢測到原位血栓(P<0.001),原位血栓與腦卒中風險顯著相關(OR4.59)。71.9%原位血栓患者合并內膜異常,但在無血栓患者中并未發現內膜異常,提示原位血栓和內膜異常可能在PFO相關腦卒中或偏頭痛患者中發揮重要作用。PFO相關偏頭痛的隨機對照研究如COMPETE-2研究、RELIFE研究、SPRING研究均順利完成入組。多項從不同角度探索PFO與偏頭痛相關性的研究正在進行中,如動態腦血流自動調節功能評估、血小板衍生生長因子-BB差異、偏頭痛PFO篩查率差異、右向左分流量與偏頭痛程度相關性、PFO患者頭痛患病率、偏頭痛有無PFO的MRI區別等,有望為PFO相關偏頭痛的介入治療提供更多的理論依據。
異常血管栓塞與異常缺損漏口封堵是復雜先心介入治療領域的核心問題。異常血管栓塞包括體肺側支、肺動靜脈瘺、冠狀動脈瘺、異常血管、人工血管閉合,微血管塞在CHD介入領域已廣泛應用,使用造影導管或微導管釋放相對更具操作優勢,然而,目前除Amplatzer 4代血管塞外,其余產品均尚未進入國內。異常缺損漏口封堵囊括瓦氏竇瘤破裂、假性動脈瘤/瘺、殘余漏、瓣周漏、開窗口、分流口等情況,先健Konar-MFO已在印度地區成功應用于左冠狀動脈異常起源于肺動脈、室間隔破裂、瓣周漏等[78]。對于先天性血管狹窄性疾病,如主動脈縮窄、肺動脈狹窄、肺靜脈狹窄、腔靜脈狹窄、人工管道狹窄、體肺側支狹窄等,血管支架成形介入治療在2023年也取得顯著進步,Cheatyam Platinum支架和PulStent肺動脈支架置入量均顯著增長。
因新生兒血管細小的特點,介入器械的治療與選擇相對困難且局限。2023年全國多家中心已在新生兒介入治療方面取得諸多突破,經導管肺動脈瓣打孔術是治療新生兒室間隔完整型肺動脈閉鎖的安全、有效措施,中期隨訪療效確切[79]。動脈導管支架置入術也被證實可作為室間隔完整型肺動脈閉鎖和室間隔缺損(ventricular septal defect,VSD)型肺動脈閉鎖患兒的一期治療方法[80]。經導管右心室流出道支架置入術對低出生體質量、伴有嚴重合并癥的法洛四聯癥患兒具有良好的手術效果[81-82]。新生兒和低齡嬰幼兒主動脈縮窄首選外科手術治療,但對危重患兒,主動脈支架介入治療或是有效的補充手段[83]。
2023年PADN-5和PADN-CFDA臨床研究正式發表,為經皮肺動脈去神經術在肺動脈高壓患者中的應用提供重要的數據支撐,而環形肺動脈射頻消融導管和肺動脈射頻消融儀獲NMPA批準上市,將極大促進經皮肺動脈去神經術在國內的開展和推廣[84-86];房間隔分流相關臨床試驗也正處于開展階段,反向分流術也成為終末期肺動脈高壓患者與CHD術后肺動脈高壓患者的新選擇[87]。肺動脈高壓靶向藥物的聯合使用已被證實明顯改善艾森曼格綜合征患者的生活質量和遠期預后[88-89]。
5.2 指南共識
基于國內外PFO領域的最新進展,2023年《卵圓孔未閉超聲診斷中國專家共識》[90]與《卵圓孔未閉相關非卒中性疾病防治中國專家共識》[91]順利發布,將進一步規范PFO診斷和治療流程,更好地指導臨床實踐。《肺靜脈狹窄診治中國專家共識》[92]概述了肺靜脈狹窄介入的適應證、治療原則、操作建議、治療策略、并發癥的處理、術后隨訪等,有望規范該疾病臨床診療,優化全程管理。2023年AHA發布了CHD中肺動脈高壓的科學聲明[93],國家心血管病中心肺動脈高壓專科聯盟發布了《中國肺動脈高壓診治臨床路徑》[94],均為我國肺動脈高壓患者的臨床診療提供了可靠的參考與依據。
5.3 國內動態
2020年至2023年國內10家封堵器廠家的CHD封堵器置入數據分析表明,CHD封堵器置入數量呈逐年遞增趨勢,亞組分析提示2023年VSD封堵器置入量與2022年基本持平,但均明顯高于2021年;動脈導管未閉(patent ductus arteriosus,PDA)封堵器、房間隔缺損(atrial septal defect,ASD)封堵器和PFO封堵器置入量均逐年增加,其中PFO封堵器每年以近2萬例次的“井噴式”速度增長,儼然提示PFO封堵術已成為CHD介入領域的熱點之一,或許得益于心原性腦卒中概念的普及以及介入診療技術的推廣(圖2)。
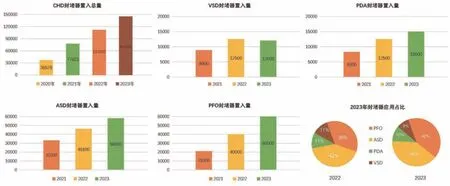
圖2 國內CHD 介入封堵器械置入量年度統計Figure 2 Annual statistics of interventional occlusion device implantation for CHD in China.Note: The data comes from ten occlusion device manufacturers in China
我國新型介入封堵器的研發應用呈百花齊放的蓬勃態勢。樂普可降解VSD封堵器上市后應用數量已超160例、可降解PFO封堵器上市后應用數量超140例;樂普可降解ASD封堵器、錦葵可降解PDA/ASD/VSD/PFO封堵器仍處于臨床研究中;新一代PDA Amplatzer Piccolo封堵器上市后正逐步開始推廣;捍宇醫療可穿刺房間隔封堵器ReAces研究患者入組已完成;國產Konar-MF治療急性室間隔穿孔及瓣周漏已在中東、南亞、東南亞地區開展相關應用。其中,PFO作為當前CHD領域中的熱點,在2023年取得了諸多發展和進步。國內新型PFO封堵器研發方向分為可降解、可穿刺、減少金屬與無置入縫合四大類,其中Amplatzer Talisman、MemoSorb已正式商用,D-Shufo已獲批上市,此外Ceraflex、脈搏PFO、NeoSorb、TriFlower、瀚芯PFO縫合、德諾電生理、Omniseal、無憂跳動等多種PFO封堵器均處于在研階段,或為未來PFO患者提供新的個體化選擇(圖3)。
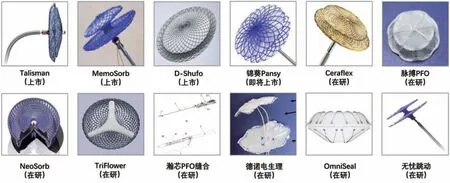
圖3 國內新型PFO 封堵器Figure 3 Diagram of novel PFO occlusion devices in China
5.4 年度展望
總體而言,我國CHD負擔仍然較重,ASD與PFO封堵器置入量持續上升,CHD的診療已向低齡化、復雜化方向不斷發展,介入無置入的理念逐步深入人心,生物可降解封堵器、射頻消融和機械損傷、經皮導管縫合等可能成為未來PFO介入治療的新熱點。5G遠程醫療、VR技術、AI學習、多模態影像融合、3D打印[95]及計算機仿真技術等可能為未來國內CHD領域提供新的技術指導和研究方向。
6 結語
SHD領域近年來得到了迅猛發展,雖然我國在二尖瓣、三尖瓣、主動脈瓣等領域起步較晚,但發展勢如破竹,中國SHD領域的創新之路,正不斷開創嶄新局面。我國在較短時期內已積累了豐富的SHD介入治療經驗,同時眾多自主研發的器械涌入臨床,多個符合中國國情的診療指南和共識重磅發布,總體進步比較明顯。然而,需要清晰認識到的是,國內原創性、大規模、高質量的基礎和臨床研究較為匱乏,但相關臨床研究數據庫的建立和中心認證等工作正在有條不紊地進行之中,有望縮小與西方國家之間的差距。砥礪奮進正當時,繼往開來鑄華章,相信在眾多領域專家學者的努力和推動下,SHD患者能迎來更加燦爛的明天。
寫作組成員:潘文志(復旦大學附屬中山醫院),金旗(復旦大學附屬中山醫院),宋光遠(首都醫科大學附屬北京安貞醫院),劉先寶(浙江大學醫學院附屬第二醫院),陸方林(上海交通大學附屬第一人民醫院),白元(海軍軍醫大學第一附屬醫院),尚小珂(華中科技大學同濟醫學院附屬協和醫院),周達新(復旦大學附屬中山醫院),吳永健(中國醫學科學院阜外醫院)
協同作者組成員:李捷(廣東省人民醫院),張曉春(復旦大學附屬中山醫院),張源(復旦大學附屬中山醫院),張戈軍(中國醫學科學院阜外醫院),曾杰(四川省人民醫院),姜小飛(珠海市人民醫院)
利益沖突 所有作者均聲明不存在利益沖突

