微米花狀NiFe-LDH的制備及其析氧性能研究
焦宇鴻,吳 方,葛金龍,秦英月
(1.蚌埠學院材料與化學工程學院,安徽 蚌埠 233030; 2.安徽省硅基新材料工程實驗室,安徽 蚌埠 233030)
目前,非再生化石能源(如石油和天然氣)是當今世界上最重要的能源之一,然而化石能源的大規模利用帶來了嚴重的環境問題以及越來越嚴峻的能源危機。氫能是一種新型的、清潔的二次能源。在各種制氫的方法中,電解水制取氫氣是目前最有前景的一種方法。電解水制氫分為陽極析氧反應(OER)和陰極析氫反應(HER)。然而OER反應涉及復雜的四電子轉移過程,存在動力學遲緩問題,其所需過電位較高,嚴重降低了電解水制氫的效率[1-3]。探尋開發高活性的析氧催化劑成為推動電解水規模應用的關鍵。析氧催化劑分為貴重金屬催化劑和非貴重金屬催化劑兩大類。貴金屬催化劑包括單質Ru、單質Ir及其合金、氧化物等[4-6],然而它們價格昂貴、儲量稀少。目前,已報道的非貴重金屬催化劑包括過渡金屬硒化物[7-8]、硫化物[9-11]、氮化物[12-13]、磷化物[14-15]、氫氧化物等[16-18]。
氫氧化物由于其具有特殊的層狀結構、制備簡單、析氧活性可調等優點,受到廣泛關注。然而LDH的導電性差,嚴重影響析氧過程中的電子轉移,常將其與導電基底或導電材料結合,提高其電荷轉移能力,從而增強析氧活性[16-18]。此外,鑒于鎳鐵雙金屬耦合作用,使得NiFe-LDH的析氧活性優于單一的氫氧化物,可調節雙金屬鎳鐵比例,進而改變優化其電子結構,進而增強其析氧活性。
基于上述,本研究以泡沫鎳為導電基底,采用簡單的水熱方法,通過調節雙金屬鎳鐵的比例,制備出系列二元NiFe-LDH催化劑,并優選出具有最佳析氧活性的催化劑。這為構筑LDH催化劑提供了實驗依據。
1 實驗部分
1.1 儀器與試劑
KQ-100B型超聲波清洗器,DHG-9140A型電熱恒溫鼓風干燥箱,上海越平FA1004C型電子分析天平,CHI760E型上海辰華電化學工作站。
尿素,乙醇,六水合硝酸鎳,九水合硝酸鐵。所有試劑均來自上海阿拉丁試劑有限公司。所有試劑均直接使用,沒有經過其他處理。實驗所用超純水均由實驗室純水系統Eco-S15(上海和泰儀器有限公司)制備。泡沫鎳來自深圳科晶智達科技有限公司。
1.2 泡沫鎳的清洗
剪取泡沫鎳(NF, 3 cm×1 cm),為去除NF表面的雜質和油污,將其先后置于3 mol·L-1HCl、丙酮和乙醇中,超聲清洗15 min,隨后置于真空烘箱中,干燥備用。
1.3 Ni(OH)2的制備
將5.0 mmol尿素,3.2 mmol Ni(NO3)2·6H2O溶于30 mL超純水。用磁力攪拌器攪拌均勻,隨后將混合液轉移至50 mL的高壓反應釜內膽中,將清洗后的泡沫鎳放入反應釜內膽。將反應釜內膽放到高壓反應釜中,密封,120 ℃下反應12 h。反應結束后,自然冷卻至室溫。將負載于反應產物的泡沫鎳取出,并用無水乙醇和去離子水清洗數次,并置于烘箱中干燥,將產物標記為Ni(OH)2。
1.4 不同鎳鐵比例的NiFe-LDH的制備
將5.0 mmol尿素,1.6 mmol Fe(NO3)2·9H2O,1.6 mmol Ni(NO3)2·6H2O溶于30 mL超純水。用磁力攪拌器攪拌均勻,隨后將混合液轉移至50 mL的高壓反應釜內膽中,將清洗后的泡沫鎳放入反應釜內膽。將反應釜內膽放到高壓反應釜中,密封,120 ℃下反應12 h。反應結束后,自然冷卻至室溫。將負載于反應產物的泡沫鎳取出,并用無水乙醇和去離子水清洗數次,并置于烘箱中干燥,將產物標記為NiFe-LDH-1。重復這一實驗步驟,不同的是改變硝酸鐵和硝酸鎳的物質的量之比,使比例分別為1∶3、1∶10,產物分別命名為NiFe-LDH-2,NiFe-LDH-3。
1.5 催化劑的表征
利用X射線粉末衍射儀(日本理學Smart Lab型)表征催化劑的晶體結構。利用掃描電子顯微鏡(SEM,FEI Quanta 400 FEG型)表征催化劑的微觀形貌。采用拉曼光譜分析儀(iHR550型)來表征催化劑表面組分。
1.6 電催化析氧活性測試
利用辰華CHI760E型電化學工作站搭建三電極體系測試系列催化劑的析氧活性。以Hg/HgO電極(內參比溶液為1 mol·L-1KOH)為參比電極,石墨棒作為對電極,負載有催化劑的泡沫鎳為工作電極。利用能斯特方程E(RHE)=E(Hg/HgO)+0.921 V,將測試所得的電極電位轉換為標準氫電極電勢。電解液為1 mol·L-1KOH。利用線性掃描伏安法(LSV)測試極化曲線,掃描速率為1 mV·s-1。利用電化學阻抗譜(EIS)測試溶液電阻和電荷傳輸電阻,測試頻率范圍0.01 Hz~100 kHz,振幅5 mV。在非法拉第區間,利用雙電層電容(Cdl)評估催化劑的電化學活性面積(ECSA)。用循環伏安法(CV)以40、60、80、100、120和140 mV·s-1的掃速測試,獲取催化劑的雙電層電容。采用計時電位法在10 mA·cm-2的電流密度下測試催化劑的穩定性。
2 結果與討論
2.1 XRD衍射圖譜
圖1是所制備的系列催化劑的XRD圖。
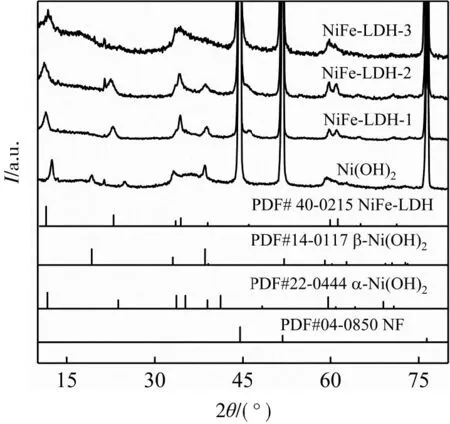
圖1 Ni(OH)2、NiFe-LDH-1、NiFe-LDH-2和NiFe-LDH-3的XRD圖
由圖1可以看出,所有催化劑的基底泡沫鎳的衍射峰出峰位置與NF標準卡片(PDF#04-0850)相對應。所制備的Ni(OH)2的衍射峰與α-Ni(OH)2標準卡片(PDF#22-0444)和β-Ni(OH)2標準卡片(PDF#14-0117)相匹配。NiFe-LDH-1、NiFe-LDH-2、NiFe-LDH-3的衍射峰與NiFe-LDH標準卡片(PDF#40-0215)相匹配,說明成功制備出NiFe-LDH催化劑。單一的鎳鹽可以水熱制備Ni(OH)2,而添加鐵鹽之后水熱合成NiFe-LDH,說明改變原料中鎳鐵比例,可以調控催化劑的晶體類型。
2.2 SEM圖
為了表征Ni(OH)2和NiFe-LDH-1的微觀尺寸和形貌,對其進行SEM測試。由圖2(a)可以看出,Ni(OH)2是由納米線構成的海膽狀結構,其中海膽狀結構的直徑約2 μm。這種獨特的海膽狀結構可提供更大的比表面積,增加活性位點的數目;有助于氣體產物的釋放。NiFe-LDH-1呈現出微米花狀三維分級結構,且該分級結構是由納米片構筑而成。這種由納米片構筑的三維分級結構顯著增大了催化劑的活性面積,有利于暴露更多的活性位點,利于氣體溢出,從而提高析氧活性。對比Ni(OH)2和NiFe-LDH-1的微觀形貌可以得出,保持金屬鹽的總量不變,改變鎳鐵鹽的比例,可以調控氫氧化物的形貌。

圖2 Ni(OH)2和NiFe-LDH-1 SEM圖
2.3 拉曼圖譜
為進一步表征NiFe-LDH-1的結構,對其進行拉曼光譜分析,如圖3所示。在拉曼位移為528 cm-1和682 cm-1分別歸屬于鎳氧振動和鐵氧振動[18],這與文獻報道的NiFe-LDH的相關數據相一致,表明生成了NiFe-LDH。
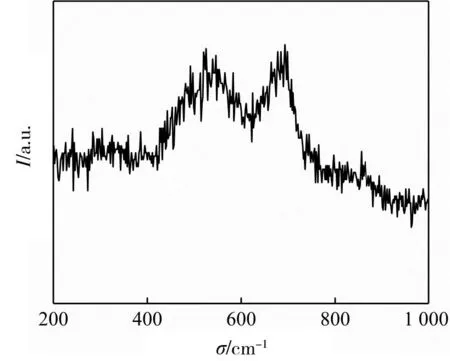
圖3 NiFe-LDH-1的拉曼光譜圖
3 電催化析氧性能
圖4為NiFe-LDH-1、NiFe-LDH-2、NiFe-LDH-3、Ni(OH)2、NF在1.0 mol·L-1KOH溶液中的LSV測試曲線。10 mA·cm-2的電流密度,NiFe-LDH-1、NiFe-LDH-2、NiFe-LDH-3、Ni(OH)2和NF所需要的過電勢分別為218、219、245、297和536 mV。達到100 mA·cm-2的電流密度,NiFe-LDH-1、NiFe-LDH-2、NiFe-LDH-3和Ni(OH)2,所需的過電勢分別為264、277、294和410 mV。由此可以看出相比于單一的Ni(OH)2,優化制備的NiFe-LDH-1具有最優秀的OER性能;其析氧活性要顯著優于已報道的某些貴金屬催化劑[19]和非貴金屬基催化劑[7,13]。相比于Ni(OH)2,雙元NiFe-LDH的析氧活性要顯著增強,這可能歸結于Ni/Fe雙金屬效應,優化了氫氧化物的電子結構,增強了其本征催化活性。
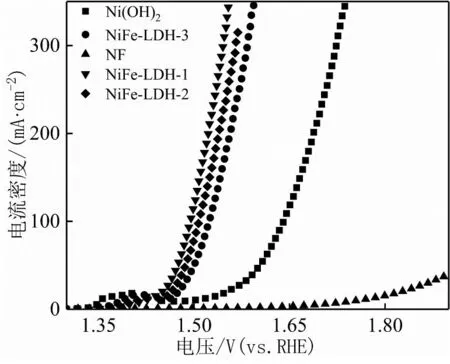
圖4 Ni(OH)2、NiFe-LDH-1、NiFe-LDH-2、NiFe-LDH-3和NF的LSV曲線
為了研究系列催化劑的析氧動力學特性,對不同催化劑進行塔菲爾斜率分析,如圖5所示。從圖中可以看出NiFe-LDH-1、NiFe-LDH-2、NiFe-LDH-3、Ni(OH)2、NF的塔菲爾斜率分別為36.3、32.2、35.2、86.8、183.7 mV·dec-1。可以看出系列NiFe-LDH催化劑與Ni(OH)2、NF相比,擁有更小的塔菲爾斜率,表明其具有較快的反應動力學特性。NiFe-LDH催化劑的塔菲爾斜率相差并不大,其中NiFe-LDH-2的塔菲爾斜率最小。
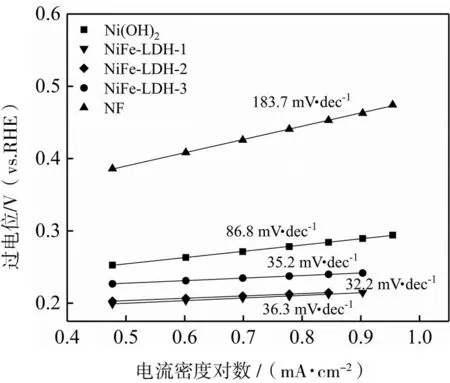
圖5 Ni(OH)2、NiFe-LDH-1、NiFe-LDH-2、NiFe-LDH-3和NF的Tafel曲線圖
圖6為NiFe-LDH-1、NiFe-LDH-2、NiFe-LDH-3、Ni(OH)2和NF的阻抗圖譜。從圖中可以看出NF具有最大的曲線半徑,說明其電荷轉移電阻最大。相比于Ni(OH)2,系列NiFe-LDH催化劑擁有更小的曲線半徑,其中NiFe-LDH-1擁有最小的曲線半徑,說明NiFe-LDH-1具有最小的液接電阻,表明其具有優異的電子傳輸能力,這與其較好的OER活性相對應。
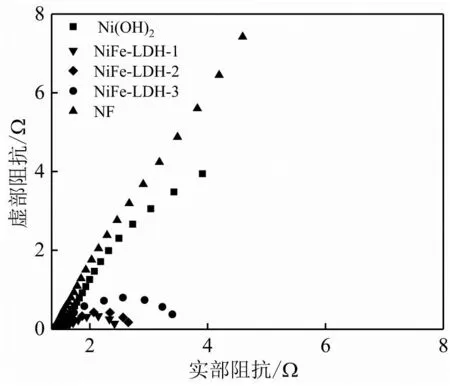
圖6 Ni(OH)2、NiFe-LDH-1、NiFe-LDH-2、NiFe-LDH-3和NF的電化學阻抗圖譜
為了進一步探究NiFe-LDH-1具有優異催化活性的原因,對系列催化劑進行了電化學活性面積測試,并利用雙電層電容來表征ECSA的大小。由圖7(e)可以看出Ni(OH)2的Cdl為1.07 mF·cm-2,NiFe-LDH-1的Cdl為0.80 mF·cm-2,NiFe-LDH-2的Cdl為0.96 mF·cm-2,NiFe-LDH-3的Cdl為0.73 mF·cm-2。雖然Ni(OH)2的Cdl要大于系列NiFe-LDH的Cdl,然而其析氧活性較差,說明電化學活性位點的數目并不是導致其具有較高析氧活性的原因。NiFe-LDH-1具有優異的OER活性,這可能與其具有較高的本征析氧活性有關[20]。
(a)Ni(OH)2 (b)NiFe-LDH-1
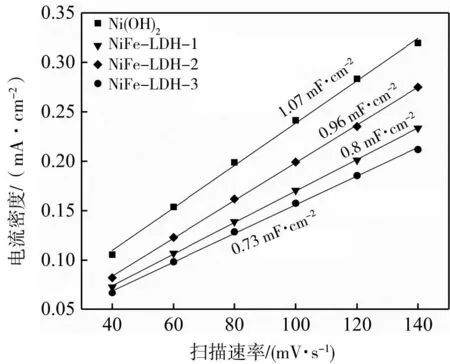
(e)系列催化劑的Cdl
催化穩定性是評估催化劑性能的重要指標之一。本研究采用計時電位分析法測試NiFe-LDH-1的催化穩定性。由圖8所示,在1 mol·L-1KOH電解液中,在10 mA·cm-2的電流密度下,NiFe-LDH-1催化劑持續進行14 h的恒電流穩定性測試,其電勢基本沒有變化,進一步證明該催化劑的穩定性良好。
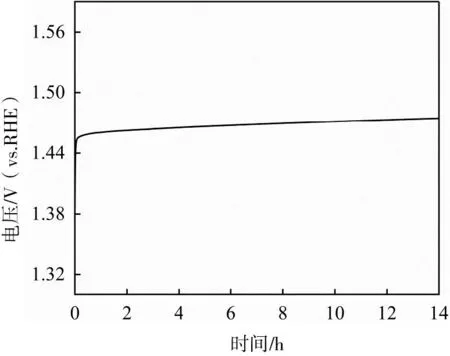
圖8 NiFe-LDH-1的計時電位曲線
4 結語
本研究以泡沫鎳為基底,采用簡單的水熱方法,通過改變鎳鹽鐵鹽比例合成系列Ni(OH)2、NiFe-LDH-1、NiFe-LDH-2和NiFe-LDH-3催化劑。相比于單一的Ni(OH)2,系列NiFe-LDH催化劑具有較好的OER活性,其中NiFe-LDH-1具有最佳的OER活性。獲得10 mA·cm-2和100 mA·cm-2的電流密度NiFe-LDH-1所需的過電勢分別為218 mV和264 mV,塔菲爾曲線斜率是36.3 mV·dec-1,此外該催化劑具有較好的催化穩定性。該催化劑具有優異析氧活性的原因是:(1)以泡沫鎳為基底,有助于提高催化劑的導電能力。(2)這種在泡沫鎳上原位生長NiFe-LDH,避免了Nafion試劑的使用,使泡沫鎳與催化劑之間的接觸更為緊密,有利于提高其催化穩定性。(3)Ni/Fe雙金屬效應有效地優化了催化劑的電子結構,提供更多的活性位點,增強了其本征析氧活性。

