苦杏仁抑菌肽的篩選富集及結構鑒定
張 濤,馬 杰,年國芳,周芷夷,張 婷,周建中
(新疆農業大學食品科學與藥學學院,新疆烏魯木齊 830000)
在20 世紀初,第一種合成抗菌劑砷凡納明問世[1]。隨著抗菌藥物的深入開發和廣泛使用,這些藥物的局限性也逐漸顯露出來。其中最主要的是抗生素的生物利用率低,部分抗生素具有毒性以及過度依賴抗生素藥物帶來的抗微生物耐藥性(Antimicrobial resistance,AMR)危機[2]。除了傳統的小分子藥物外,世衛組織還建議研究非傳統和替代療法,重點關注不同的細菌靶標的抗菌肽和噬菌體療法[3]。
抗菌肽(Antimicrobial peptides,AMPs)又稱宿主防御肽,是生物機體用來抵抗入侵病原體的天然免疫屏障[4]。它們廣泛存在于動物的免疫細胞中,如吞噬細胞、各種臟器的粘膜、皮膚以及植物的花、果、葉,甚至存在于微生物自身體系中[5-7]。與傳統的抗生素不同,除了不易產生耐藥性和交叉抗性外[4],還具有對環境友好,對人類和動物無害的特點,對細菌、病毒、真菌以及原生動物等都表現出廣泛的抑制作用[8-9]。不同抗菌肽在與細胞作用時表現的作用方式和作用機制也各不相同。帶正電荷的抗菌肽結合細胞膜中帶負電荷的磷脂是一種殺菌機制;抗菌肽結合細胞壁或胞內組分的非膜靶點也可殺死病原體[10]。關于抗菌肽的作用機理有兩種觀點:膜靶向機制和非膜靶向機制。研究人員采用了聚集體模型、環狀孔模型、桶板模型和毯式模型等不同作用模型對兩種作用機制作進一步闡述[4]。
我國杏資源非常豐富,主要分布在東北、華北、西北地區,是“三北”生態脆弱區發展經濟林產業的適生樹種[11],其中新疆杏栽培歷史悠久,培植了諸多優質的品種[12]。作為傳統的中藥原料,苦杏仁能夠顯著降低血清中膽固醇、動脈粥樣硬化指數[13],且杏仁油具有提高免疫力、預防心血管疾病等多種生理功能。苦杏仁市場需求呈不斷上升趨勢,尤其是在食品[14]、醫藥[15]、化工[16]等領域。杏仁皮多酚類化合物具有抗菌抗病毒活性[17],崔海燕等[18]對其主要活性成分進行了研究。Salih 等[19]從杏仁中提取苦杏仁苷并研究其對綠膿桿菌、沙雷氏菌等病原菌的抑制作用。王麗芳等[20]提取龍井茶葉粗提物,研究茶葉抗菌肽對細菌的作用機制,劉東偉等[21]將壓榨提油后的核桃粕酶解制備核桃粕蛋白,發現核桃粕蛋白對金黃色葡萄球菌、大腸桿菌、枯草芽孢桿菌均有抑制效果,對于杏仁蛋白的抗菌效果目前暫無研究。前期研究發現苦杏仁蛋白具有抗菌性,本實驗以榨油后的杏仁粕為研究對象并探究其蛋白的抑菌特性,優化水解及純化條件,富集其中的抗菌肽組分并解析其結構,以期為苦杏仁活性肽的開發和杏仁副產品的再利用提供理論基礎。
1 材料與方法
1.1 材料與儀器
苦杏仁 新疆烏魯木齊市沙依巴克區北園春市場采購;金黃色葡萄球菌、大腸桿菌、枯草芽孢桿菌和沙門氏菌 北京永澤浩嘉生物技術發展中心購入;堿性蛋白酶(酶活:200 U/mg)、酸性蛋白酶(酶活:50 U/mg)、中性蛋白酶(酶活:100 U/mg)、復合蛋白酶(酶活:120 U/mg)、胰蛋白酶(酶活:130 U/mg)、木瓜蛋白酶(酶活:800 U/mg)、葡聚糖凝膠G-25、考馬斯亮藍G250 上海源葉生物科技有限公司;LB 肉湯、瓊脂粉 北京奧博星生物技術有限責任公司;其余化學試劑均為分析純 天津鑫鉑特化工有限公司。
ZYJ-7090 單螺桿榨油機 東莞市方太電器有限公司;SF-GL-16A 高速冷凍離心機 上海菲恰爾分析儀器有限公司;ALpha 2-4 LSCplus 凍干機 德國Christ 公司;UV-1200 型紫外可見分光光度計上海美譜達儀器有限公司;滅菌鍋LDZF-50L-I 上海申安醫療器械廠;HD-21-1 核酸蛋白檢測儀、HL-2S 恒流泵、HD-A 電腦采集器 上海滬西分析儀器廠;Agilent Zorbax 300SB-C18美國安捷倫公司;超分辨液質聯用儀Q Exactive HF-X 美國Thermo Fisher Scientific 公司。
1.2 實驗方法
1.2.1 苦杏仁蛋白的制備 挑選顆粒飽滿的苦杏仁熱燙去皮后,在60 ℃烘干2 h 去除表面水分,使用榨油機對杏仁進行初步脫脂,工藝設置為溫度50 ℃,榨軸轉速30 r/min。冷榨后的杏仁粕用石油醚按照1:10 的比例浸提12 h 進行進一步脫脂處理,重復2 次,在60 ℃條件下烘干5 h 后過60 目篩,得脫脂杏仁粉,于4 ℃保存。
采用堿溶酸沉法[22]提取脫脂苦杏仁粉中的杏仁蛋白,以1:25 比例加入蒸餾水,NaOH 調pH 至10.0,連續攪拌浸提60 min,4000 r/min 轉速下離心20 min,沉淀物重復堿提1 次,合并上清液加HCl 調至pH4.4,4000 r/min 轉速下離心20 min 棄去上清液,用蒸餾水洗滌沉淀3~5 次,冷凍干燥后得到苦杏仁粗蛋白。
1.2.2 蛋白酶的篩選 選擇堿性蛋白酶、酸性蛋白酶、中性蛋白酶、復合蛋白酶、胰蛋白酶、木瓜蛋白酶在各自最適條件下對苦杏仁蛋白進行水解,并測試其酶解物對枯草芽孢桿菌、大腸桿菌金黃色葡萄球菌及沙門氏菌的抑制效果,以水解度和抑菌圈直徑為衡量指標,篩選出一種較優的蛋白酶用于后續苦杏仁抑菌肽的制備。不同蛋白酶適宜酶解條件如表1所示。
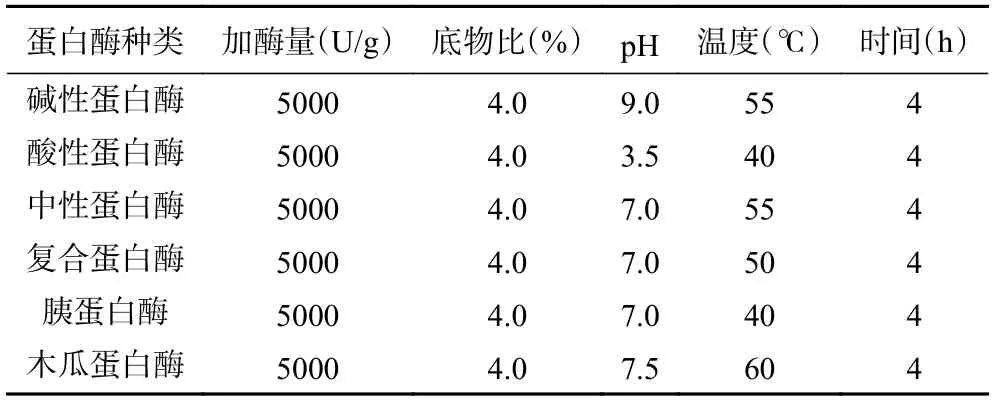
表1 不同蛋白酶適宜酶解條件Table 1 Suitable enzymatic conditions for different proteases
1.2.3 水解度測定 蛋白含量的測定采用考馬斯亮藍法[23],水解度的測定采用甲醛滴定法[24],按下式計算水解度DH:
式中:V1為酶解液消耗的NaOH 溶液體積(mL);V0為蛋白溶液消耗的NaOH 溶液體積(mL);V 為所用離子水體積(mL);C 為滴定消耗的NaOH溶液濃度(mol/L);M 為所加蛋白質質量(g);pro 為蛋白質濃度(%)。
1.2.4 抑菌活性的測定 采用濾紙片法測定抑菌活性[25]。在整個實驗過程中,為保持微生物活力,所有待測菌株需每2 周在瓊脂培養基上傳代培養,并于4 ℃保存。待測菌在使用前,在37 ℃ LB 液體培養基中搖床培養18 h。吸取菌懸液在5000 r/min 轉速下離心15 min,用無菌生理鹽水連續稀釋調整至105CFU/mL 菌落形成單位。
在超凈工作臺內,吸取活化完成的試驗菌液100 μL 均勻涂于LB 平板培養基上。使用打孔器制作直徑6 mm 的濾紙圓片,在苦杏仁酶解液中浸泡2 h,將浸泡過的濾紙片貼于平板培養基上,37 ℃條件下培養12 h,采用十字交叉法測量抑菌圈直徑。試驗重復3 次,以水作空白對照。
1.2.5 最小抑菌濃度測定 采用二倍稀釋法測定最小抑菌濃度[26]。將由酶解制備的苦杏仁抑菌肽樣品做濃度遞減稀釋,分別為100、50、25、12.5、6.25、3.125、1.5625、0.78125 mg/mL,對所選指示菌進行抑菌試驗,具體操作同1.2.4,以抑菌圈大于8 mm 為依據確定最小抑菌濃度,重復3 次,取平均值。
1.2.6 單因素實驗 以苦杏仁蛋白水解度及酶解物抑菌活性為評價指標,考察酶解時間、pH、酶底比、酶解溫度和底物比對抑菌肽酶解及抑菌性的影響,每組實驗重復3 次,結果取平均值。
酶解時間:固定酶解pH6.5,酶底比為3%,溫度為60 ℃,底物比為4%,以水解度和抑菌圈直徑的大小為評價指標,考查不同酶解時間(1、2、3、4、5 h)對杏仁蛋白酶解的影響。
酶解pH:選擇酶解時間3 h,酶底比為3%,溫度為60 ℃,底物比為4%,以水解度和抑菌圈直徑的大小為評價指標,考查不同酶解pH(4.5、5.5、6.5、7.5、8.5 h)對杏仁蛋白酶解的影響。
酶底比:設置酶解時間3 h,酶解pH6.5,溫度為60 ℃,底物比為4%,以水解度和抑菌圈直徑的大小為評價指標,考查不同酶底比(1%、2%、3%、4%、5%)對杏仁蛋白酶解的影響。
酶解溫度:選擇酶解時間3 h,酶解pH6.5,酶底比為3%,底物比為4%,以水解度和抑菌圈直徑的大小為評價指標,考查不同酶解溫度(40、50、60、70、80 h)對杏仁蛋白酶解的影響。
底物比:確定酶解時間3 h,酶解pH6.5,酶底比為3%,溫度為60 ℃,以水解度和抑菌圈直徑的大小為評價指標,考查不同底物比(2%、3%、4%、5%、6%)對杏仁蛋白酶解的影響。
1.2.7 響應面法優化酶解工藝 通過單因素實驗,研究酶解時間、pH、酶底比、酶解溫度、底物比對苦杏仁蛋白水解程度以及酶解物抑菌效果的影響,采用Plackett-Burman 設計試驗,因素水平設計見表2,篩選3 個影響酶解物抑菌效果的主要因素,并用響應面法中的Box-Behnken 設計三因素三水平試驗,因素水平設計見表3,確定苦杏仁蛋白酶解制備抑菌肽的最優工藝條件。

表2 Plackett-Burman 試驗設計因素及水平Table 2 Factors and levels of Plackett-Burman test
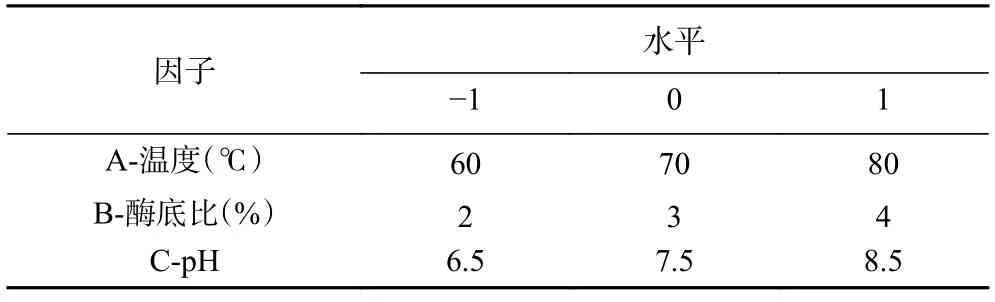
表3 響應面試驗因素水平設計Table 3 Factors and levels of response surface test
1.2.8 抑菌肽的超濾分離 參考徐楊林等[27]的方法。將酶解制備的苦杏仁抑菌肽與去離子水進行1:20 溶解,在常溫條件下經不同分子截留量的超濾膜將酶解液分離成大于30 kDa(A-Ⅰ)、30~10 kDa(A-Ⅱ)、10~3 kDa(A-Ⅲ)和小于3 kDa(A-Ⅳ)的四組不同分子量的濾液,通過二次循環收集截留液,凍干后-20 ℃保存備用,并用濾紙片法測定各部分酶解物的抑菌活性,重復3 次,取平均值。
1.2.9 Sephadex G-25 層析純化條件的優化 經超濾后得到抑菌效果較好的肽粉,用超純水溶解為不同濃度肽液準備上樣。借鑒胡二坤等[28]的實驗方法,采用280 nm 紫外檢測波長,在Sephadex G-25 柱上(1.6 cm×60 cm)層析分離,考察上樣濃度、洗脫速度、洗脫劑3 個因素對苦杏仁抑菌肽的分離效果的影響。用自動接收器接收樣品,冷凍干燥后測量各級組分的抑菌圈直徑大小。
1.2.9.1 上樣濃度的選擇 設置洗脫速度為0.68 mL/min,以純水為洗脫液,上樣量為2 mL,探究樣品濃度為50、25、12.5、9.38、6.25 mg/mL 時的純化效果。
1.2.9.2 洗脫速度的選擇 設置樣品濃度為9.38 mg/mL,以純水為洗脫液,上樣量為2 mL,探究樣品洗脫速度在0.96、0.93、0.74、0.68、0.41 mL/min 時的純化效果。
1.2.9.3 洗脫劑的選擇 設置樣品濃度為9.38 mg/mL,洗脫速度為0.68 mL/min,上樣量為2 mL,探究樣品洗脫劑含NaCl 量為0.25、0.1、0 mol/L 時的純化效果。
1.2.10 LC-MS/MS 鑒定肽結構 多肽的一級結構通過LC-MS/MS 測定[29],凝膠層析得到的組分脫鹽后用純水溶解,配成質量濃度為1 mg/mL 的溶液。
液相條件:液相色譜柱(0.15 mm×150 mm,RPC18,Column Technology Inc);A 液為0.1%甲酸水溶液,B 液為0.1%甲酸-乙腈水溶液(乙腈為84%)。以95%的A 液進行平衡,樣品用0.45 μm 的濾膜過濾,再經過液相色譜柱梯度洗脫分離。
質譜鑒定:酶解產物經毛細管高效液相色譜分離后用質譜儀進行質譜分析,分析時長:60 min;檢測方式:正離子。按照每次全掃描后采集10 個碎片圖譜(MS2 scan)的方法采集多肽和多肽碎片的質荷比。該質譜圖經軟件MaxQuant 1.5.5.1 檢索相應的蛋白數據庫,最后得到蛋白質鑒定及定量分析結果,使用在線軟件APD3 推斷出抗菌肽段。
1.3 數據處理
每個樣品重復3 次實驗,數據為平均值±標準偏差數據,使用Excel 2019 統計數據、SPSS 26 進行差異檢驗及方差分析,用Origin 2021 繪圖。
2 結果與分析
2.1 不同蛋白酶種類的篩選及抑菌效果驗證
不同蛋白酶水解苦杏仁蛋白的水解度如圖1 所示,水解初期,水解程度隨著水解時間的增長越來越高,反應進行一段時間后,水解程度趨于穩定,這是由于底物以及酶切位點開始變少,反應也逐漸變得平穩。堿性蛋白酶的水解度在本實驗的六種蛋白酶中最高,木瓜蛋白酶的水解度比堿性蛋白酶略低一些,在水解反應4 h 之后,水解度趨于平緩,達到16.98%±0.42%。而復合蛋白酶在水解反應3 h之后的水解度趨于平緩,最高不到15%,相當于木瓜蛋白酶水解1 h 時的水解度;中性蛋白酶的水解度雖然與時間近似正比,但在水解反應6 h 之后仍然未超過14%,除此之外,胰蛋白酶和酸性蛋白酶的水解能力接近,在水解反應6 h之后,它們的水解度甚至小于10%。在本試驗中,6 種蛋白酶水解苦杏仁蛋白的水解度排序為:堿性蛋白酶>木瓜蛋白酶>復合蛋白酶>中性蛋白酶>胰蛋白酶>酸性蛋白酶。不同種類的蛋白酶即使在條件類似的水解度下,苦杏仁蛋白的水解度會有差異,是因為不同的蛋白酶的水解位點不同[4]。
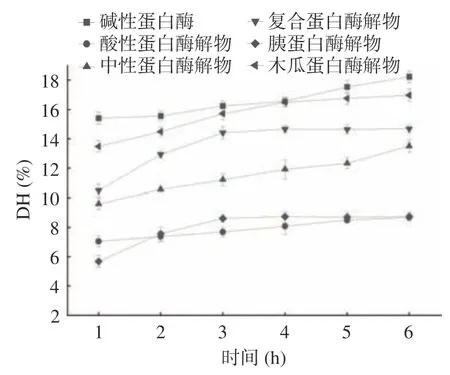
圖1 不同蛋白酶水解苦杏仁蛋白的水解度Fig.1 Hydrolysis degree of bitter almond protein by different proteases
不同種類的蛋白酶水解苦杏仁蛋白所得酶解物的抑菌效果如表4 所示,木瓜蛋白酶和酸性蛋白酶的酶解物對2 種革蘭氏陽性菌均有抑制活性,且木瓜蛋白酶酶解物對2 種細菌抑菌圈直徑都大于8.0 mm,尤其是金黃色葡萄球菌,抑菌圈直徑接近20 mm,表現出較強的抑菌效果。空白對照組沒有出現抑菌圈,說明水對金黃色葡萄球菌的生長并未產生任何抑菌的作用。苦杏仁蛋白的酶解物對金黃色葡萄球菌有明顯的抑制作用,這可能與木瓜蛋白酶具有在較短時間內切割疏水區域氨基酸的特異性識別切割特征有關[30]。以抑菌效果為主,綜合考慮抑菌圈直徑和水解度2 個因素,本實驗選用木瓜蛋白酶作為后續制備抑菌肽的蛋白酶,并以金黃色葡萄球菌作為指示菌,對酶解法制備苦杏仁抑菌肽的工藝進行優化。

表4 不同蛋白酶酶解物的抑菌活性Table 4 Antibacterial activities of different protease hydrolysates
2.2 木瓜蛋白酶酶解制備苦杏仁抑菌肽單因素實驗
前期的實驗中木瓜蛋白酶表現出最好的酶解效果和抑菌效果,為了便于后續實驗的開展,實驗選定時間、pH、酶底比、溫度、底物比5 個單因素,研究它們對苦杏仁蛋白水解度及酶解物抑菌活性的影響。
由圖2A 可知,隨著酶解時間的不斷增加,水解度隨著酶解時間增加整體呈現上升趨勢。而酶解物對金黃色葡萄球菌的抑菌活性逐漸增強,在3 h 處達到最大,為19.76±0.58 mm,之后抑菌圈直徑呈減小趨勢。這是由于具有抑菌活性的氨基酸序列因酶解時間的延長而不斷地暴露出來[31]。由圖2B 可知,pH能直接影響酶的活力。pH 在4.5~7.5 時,酶解物的抑菌活性變化不大,但水解度迅速增大,當pH 進一步增加時,水解度卻逐漸降低,而抑菌活性增強,抑菌圈直徑達到最大值18.75±0.33 mm。可能是由于pH過低、過高都能使酶蛋白變性而失活,同時pH 的改變能影響酶活性中心上必需基團的解離程度,在合適的pH 范圍中,酶分子與底物蛋白能更容易地結合,進而使得酶解物的抑菌活性增強[32]。由圖2C 可知,隨著酶添加量的增加,抑菌圈的直徑增大,當酶底比達到2%時,抑菌活性最強,抑菌圈直徑達到18.33±0.4 mm;推測酶量的增加使水解產物具有抑菌活性的多肽片段增加[33]。再增加酶添加量,酶解物的抑菌活性反而略有下降,而水解程度隨著酶添加量的增加呈不斷增強的趨勢。可能是酶將苦杏仁蛋白水解成單個氨基酸或更小的無抑菌活性的小肽[34]。由圖2D 可知,隨著酶解溫度升高,抑菌活性和水解度都呈先增后減的趨勢,抑菌活性在溫度為70 ℃時達到最大,抑菌圈直徑為24.42±0.51 mm。這是由于溫度升高,能提高水解速度,有利于抑菌多肽的生成。當溫度過高的時候,結構遭到破壞的酶分子將喪失或部分喪失活性[35]。從圖2E 可以看出,底物濃度在2%~4%時,對水解程度的影響不大,在底物濃度達4%后水解度略有下降。抑菌活性隨底物濃度的增加呈先增后減趨勢,當底物濃度達到3%時,酶解物的抑菌活性最強,抑菌圈直徑達到24.39±0.43 mm,可能是因為當底物濃度低時有足夠的酶去酶解底物,隨著底物濃度的增加,沒有剩余的酶蛋白與之結合,且底物蛋白溶液黏度過高不利于底物蛋白與酶蛋白的接觸[36]。
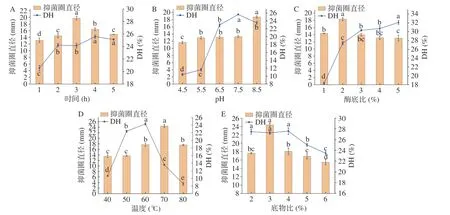
圖2 時間、pH、酶底比、溫度和底物比對苦杏仁蛋白水解度與酶解物抑菌活性的影響Fig.2 Effects of time,pH,enzyme substrate ratio,temperature and substrate ratio on the degree of hydrolysis of bitter almond protein and the bacterial inhibitory activity of enzymatic digest
2.3 Plackett-Burrman 設計篩選主效因素
由表5 可知,方差分析模型的P值為0.0038,復決定系數R2=0.9139,校正決定系數R2Adj=0.8422,表明此回歸模型相關性好。酶底比、溫度對苦杏仁抑菌肽的制備影響極顯著(P<0.01),pH 對苦杏仁抑菌肽的制備影響顯著(P<0.05),而其它兩個因素則不顯著。顯著性大小依次為:酶底比>溫度>pH>時間>底物比。因此選擇具有顯著影響的3 個因素,即酶底比、溫度、pH 作為下一步響應面模型的考察因素。
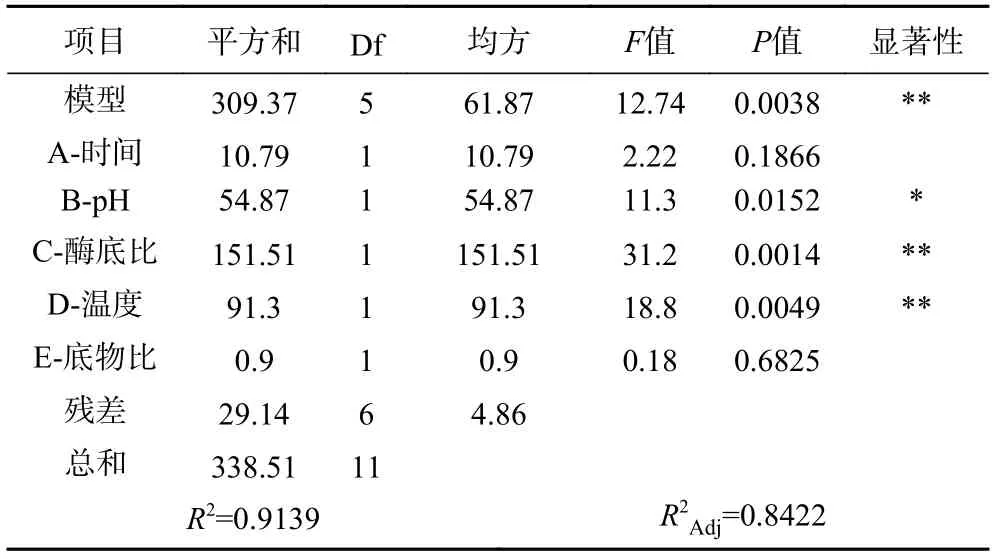
表5 Plackett-Burman 模型方差分析Table 5 Analysis of variance of Plackett-Burman model
2.4 響應面法優化試驗
對Plackett-Burrman 設計篩選出的3 個主效開展N=15 的三因素三水平的Box-Behnken 設計試驗,試驗結果見表5。利用Design Expert 8.0 軟件對試驗數據進行多元回歸擬合,得到酶解苦杏仁蛋白的多項式回歸模型如下:
由表6 可知,模型F值為8.14,P值0.0163<0.01,說明該回歸模型可靠。模型失擬項的P值為0.895,不顯著,校正決定系數R2Adj值為0.8211,表明某產量82.11%的變異分布在方程中,其相關系數R2=0.9361,表明產量的實測值與預測值之間具有較好的擬合度,該模型可用于預測對苦杏仁抑菌肽制備的實際情況。
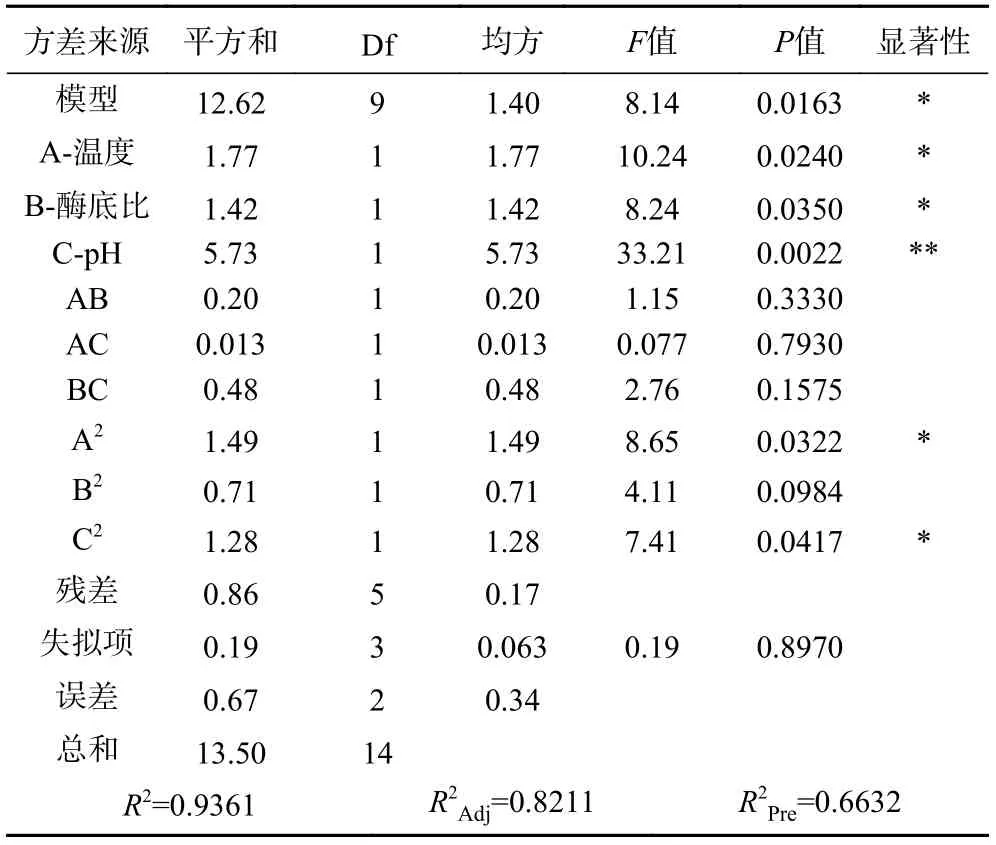
表6 二次響應面回歸模型方差分析Table 6 ANOVA for response surface quadratic model analysis of variance table
在該模型中,回歸系數的顯著性檢驗顯示,一次項A、B 對酶解液抑菌性的影響均達到顯著水平(P<0.05),C 達到極顯著水平(P<0.01)。比較A、B、C 3 個因素的F值大小可得,各因素對苦杏仁蛋白提取率影響的大小順序為:pH(C)>溫度(A)>酶底比(B)。二次項(A2、C2)對試驗結果的影響顯著(P<0.05);交互項(AB、AC、BC)對酶解物的抑菌效果影響均不顯著(P>0.05)。根據軟件程序預測,可得苦杏仁抑菌肽最大抑菌圈直徑為17.86 mm,對應的最佳方案為:酶解溫度為74.04 ℃,酶底比為2.65%,pH 為6.9。
2.5 最佳水解條件的確定和驗證
鑒于實驗的可操作性,將苦杏仁抑菌肽的制備工藝參數修正為:酶解溫度為74 ℃,酶底比為2.5%,pH 為7。在此條件下,實際測得的平均抑菌圈直徑為18.14±0.26 mm,與理論預測值相比相對誤差在1.6%左右。經測定,此條件下酶解物中蛋白質濃度為19.21%,水解度為26.21%,因此采用修正后的方法得到的提取參數準確可靠,具有實用價值。
2.6 最低抑菌濃度的測定
由表7 可知,苦杏仁抑菌肽對金黃色葡萄球菌的抑制效果活性較高,最低抑菌濃度為3.13 mg/mL,結果表示濃度較低時仍有抑菌效果,具有較高的開發價值。
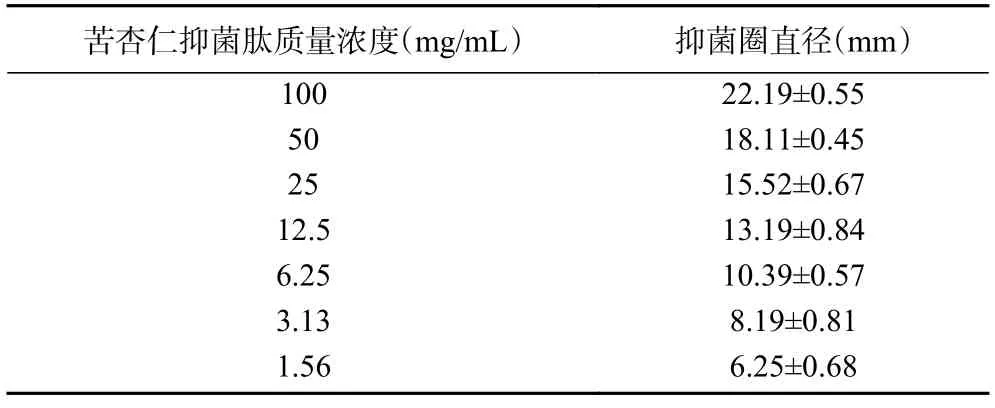
表7 不同濃度的苦杏仁抑菌肽對金黃色葡萄球菌的抑制效果Table 7 Inhibitory effects of different concentrations of bitter almond antibacterial peptide on Staphylococcus aureus
2.7 苦杏仁抑菌肽的超濾分離
將酶解制備的苦杏仁抑菌肽用截留量不同的濾膜過濾后,共得到A-Ⅰ、A-Ⅱ、A-Ⅲ和A-Ⅳ四個組分,測得各組分的抑菌活性如圖3 所示,組分A-Ⅱ的抑菌圈直徑最高達到17.34±0.38 mm,表明該組分的抑菌效果較強。其余3 個組分A-Ⅰ、A-Ⅲ和A-Ⅳ的抑菌圈直徑分別為12.17±0.36、9.71±0.77、8.11±0.51 mm。因此,選擇組分A-Ⅱ對其進行進一步凝膠層析分離。
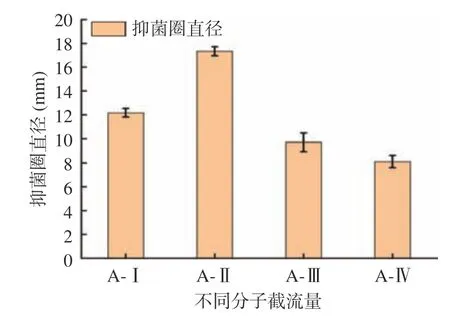
圖3 不同分子量組分的抑菌效果Fig.3 Bacterial inhibition effects of different molecular weight components
2.8 純化條件優化
在按照1.2.9.1 條件進行純化時,上樣濃度對純化效果的影響結果如圖4 所示。
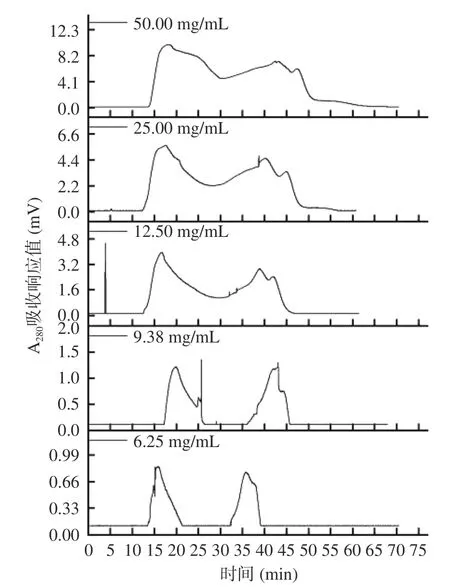
圖4 上樣濃度對組分A-Ⅱ分離效果的影響Fig.4 Effects of upper sample concentration on the separation effects of fractions A-Ⅱ
通過圖4 可知,上樣濃度過高,不僅導致組分A-Ⅱ分離時間變長,還導致樣品擴散,引起臨近峰重疊,分離效果不理想。上樣濃度偏低,實驗效率低且峰形不尖銳,含量低的部分組分無法分離。過高濃度和過低濃度均只分離出3 個組分,選擇上樣濃度9.38 mg/mL 進行層析時,分離出4 個組分,樣品得到較好的分離,且組分與組分之間較明顯。
在按照1.2.9.2 條件進行純化時,洗脫速度對純化效果的影響結果如圖5 所示。
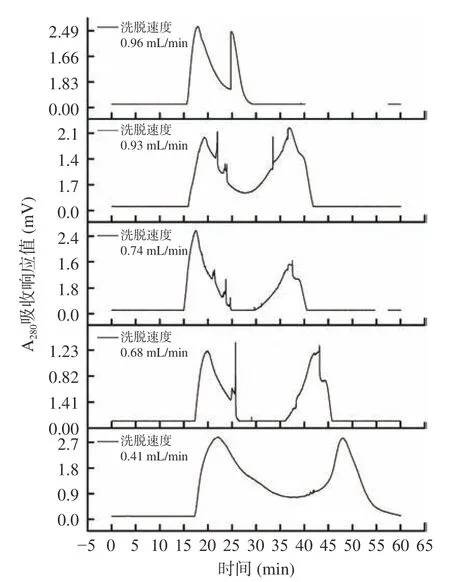
圖5 洗脫速度對組分A-Ⅱ分離效果的影響Fig.5 Effects of elution speed on the separation effects of A-Ⅱfraction
通過圖5 可知,洗脫速度太快,會使組分A-Ⅱ被洗脫液沖洗下來時還未分離徹底,分離出2 個峰。洗脫速度過慢,出峰慢且樣品由于長時間存留發生擴散,會導致分離效果不佳和峰拖尾,也只分離出2 個峰。當洗脫速度為0.68 mL/min 時分離出4 個組分,峰相對尖銳,且分離效果較佳。
在按照1.2.9.3 條件進行純化時,洗脫劑對純化效果的影響結果如圖6 所示。
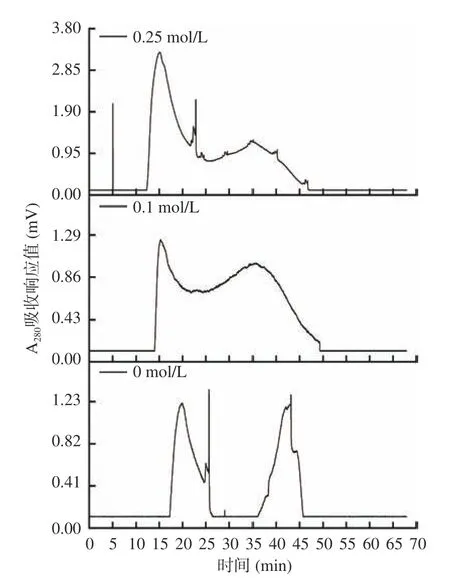
圖6 洗脫劑中NaCl 的濃度對組分A-Ⅱ分離效果的影響Fig.6 Effects of the concentration of NaCl in the eluent on the separation effect of A-Ⅱcomponent
由圖6 可知,洗脫劑為0.25 mol/L 或0.1 mol/L的NaCl 溶液時,分離所得的組分吸光值較高,可能是NaCl 具有防止蛋白在凝膠中吸附的作用[37],但分離效果欠佳,前者得到3 個峰,而后者只分離出2 個單峰。而只用純水作為洗脫液時,分離效果較含NaCl 的效果明顯,但所得組分的吸光值較低,部分組分因吸附未被洗脫出來。因此,實驗采用不含NaCl的超純水為洗脫液時,凝膠過濾色譜分離各組分的效果最佳。
2.9 純化肽的抑菌效果研究
由SephadexG-25 純化的肽對革蘭氏陽性菌的抑制效果較好,尤其是金黃色葡萄球菌,分離出的4 個組分中,組分A-Ⅱ-b 的抑菌效果最強。綜上所述,組分A-Ⅱ-b 的抑菌活性較強,為了提高該組分的產量,確定凝膠層析的純化工藝為樣品濃度9.38 mg/mL,洗脫速度0.68 mL/min、洗脫劑為純水的條件為最佳凝膠過濾條件。使用HD-A 軟件對最佳純化條件分離的4 個目標峰進行分析,得出A-Ⅱ-a、A-Ⅱ-b、A-Ⅱ-c 和A-Ⅱ-d 的峰面積比分別為38.38%、13.15%、40.52%、7.96%。多次重復試驗,收集各組分,將各組分經真空濃縮和冷凍干燥后制成粉末,備用。
2.10 LC-MS/MS 鑒定分析
采用液相色譜-質譜聯用技術對抑菌效果最強組分A-Ⅱ-b 的肽段序列進行鑒定分析,篩選潛在的抑菌肽段。組分A-Ⅱ-b 的總離子流圖如圖7 所示。將對重現性最好,相對峰面積也較高的肽段,質譜檢測到的b,y 離子匹配圖(圖8)與數據庫(uniprottaxonomy Anabantaria 2023)進行匹配,得到每個肽的準確氨基酸序列。在抗菌肽數據庫(APD3)中進行同源性分析并篩選出潛在的抗菌肽,結果如表8 所示。經篩選發現7 種肽段序列與APD 數據庫中已報道抑菌肽具有一定的的同源相似度。多肽序列平均為10~20 個氨基酸序列長度,分子量在1500~2500 Da 的抑菌肽段含有大量的堿性氨基酸殘基與疏水性殘基,使用在線軟件APD3 對肽段序列的電荷數和疏水率進行計算,其凈電荷數從-1~+2,疏水率范圍從23%~50%。這與以往學者的研究結果基本一致[36],由此,推斷出這7 種苦杏仁肽序列具有潛在的抗菌活性。具有疏水性基團和帶正電荷是AMPs 的顯著特征。抗菌肽通常因為富含精氨酸、賴氨酸殘基而形成高度明確的陽離子結構域[36]。疏水作用體現在AMPs 通過靜電吸引被微生物膜吸附后,疏水殘基開始與脂質雙分子層的疏水段相互作用,最終導致微生物膜的破壞[38]。
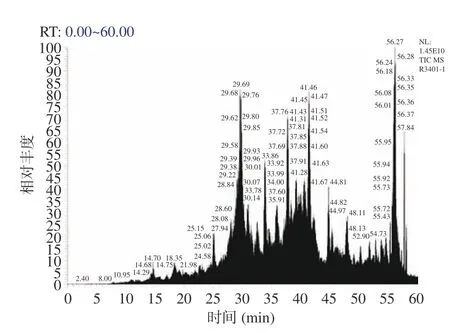
圖7 組分A-Ⅱ-b 的總離子流圖Fig.7 Total ion flow diagram of A-II-b component
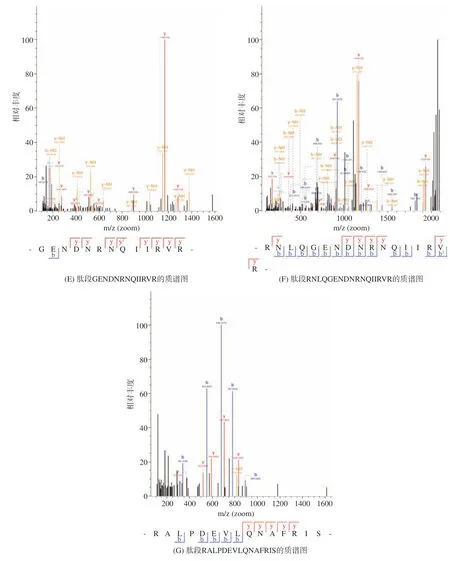
圖8 抑菌肽的質譜圖Fig.8 Mass spectra of bacteriostatic peptides

表8 LC-MS/MS 鑒定組分A-Ⅱ-b 抑菌肽段Table 8 Antimicrobial peptides identified by LC-MS/MS from A-II-a fraction
3 結論
本實驗中以脫脂苦杏仁為原料提蛋白,使用多種酶法水解提取多肽并檢驗其抑菌活性。由實驗結果得出木瓜蛋白酶水解蛋白的程度較高且酶解物的抑菌活性較強,尤其是對革蘭氏陽性菌的抑制效果。使用金黃色葡萄球菌作為后續實驗的指示菌。優化木瓜蛋白酶酶解制備苦杏仁抑菌肽的工藝為:酶解溫度為74 ℃,酶底比為2.5%,pH 為7。在此條件下酶解3 h 得該抑菌肽的蛋白濃度為19.21%,對金黃色葡萄球菌的最低抑菌濃度為3.13 mg/mL,產生的抑菌圈直徑達到18.14±0.26 mm。
通過超濾分離將苦杏仁抑菌肽分出4 個組分并對其抑菌活性進行檢測,篩選出活性較好的一個組分做進一步凝膠層析純化處理。使用SephadexG-25 進行純化洗脫出4 個峰A-Ⅱ-a、A-Ⅱ-b、A-Ⅱ-c和A-Ⅱ-d,其中A-Ⅱ-b 對革蘭氏陽性菌的抑制活性最強。采用LC-MS/MS 進行分析,質譜檢測到的b,y-離子匹配圖與蛋白數據庫進行匹配,得到每個肽的準確氨基酸序列。在抗菌肽數據庫(APD3)中進行同源性對比分析,篩選推斷出七種潛在具有抑菌活性的杏仁活性肽,分別是ALPDEVLQNAFRIS、ESWN PRDPQFQWAGVA、VAYWSYNNGEQPLVA、FLD LSNDQNQLDQVPR、GENDNRNQIIRVR、RNLQ GENDNRNQIIRVR、RALPDEVLQNAFRIS。
抑菌活性的研究是對對苦杏仁活性肽功能特性的進一步完善,有利于擴大苦杏仁蛋白的應用,對杏仁資源的深度開發也具有一定的指導意義。在面臨耐藥性和篩選新的抗生素較為困難的如今,杏仁抑菌肽的研究對培育新一代的抗菌藥物注入新的動力,提供新的思路,具有較大的市場及應用潛力。
? The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

