乳酸菌素對幽門螺桿菌感染性胃炎小鼠炎癥和腸道菌群的影響
程小英,詹 揚,周衍安,張靜文,李穎萌,劉文君,*
(1.江中藥業股份有限公司,江西南昌 330103;2.南昌大學第一附屬醫院消化內科,江西南昌 330006)
幽門螺桿菌(Helicobacter pylori,H.pylori)是一種存在于胃黏膜上皮的微需氧性革蘭氏陰性菌。據統計,我國已感染H.pylori的人群超過50%[1]。H.pylori患者幾乎均處于慢性胃炎狀態,并會進一步發展為消化性潰瘍、胃黏膜相關淋巴組織淋巴瘤,甚至胃癌[2-3]。目前,H.pylori感染的一線臨床治療主要是四聯療法,包括質子泵抑制劑、2 種抗生素(如克拉霉素和阿莫西林)和鉍劑[4-5]。然而,由于抗生素耐藥性的產生、患者依從性差以及腸道菌群紊亂引起的不良反應等原因,抗生素治療失敗的風險增加[6]。此外,盡管抗生素可以消滅H.pylori,但對炎癥反應和胃粘膜受損的作用有限。
腸道菌群在H.pylori引發的疾病進展中起著重要作用。研究表明,H.pylori通過分泌毒力因子細胞毒素相關基因A(Cag A)以及激活宿主免疫反應,導致腸道菌群失衡,從而促進炎癥和細胞增殖,進而引發癌癥等人類疾病[7-8]。此外,H.pylori感染引起的腸道菌群失衡也可能與一系列其他全身性疾病有關,比如阿爾茲海默癥[9]和動脈粥樣硬化[6]。在炎癥反應和免疫應答過程中,腸道中的有益菌發揮著重要作用[10]。例如,擬桿菌屬、梭狀芽孢桿菌屬和糞桿菌屬等微生物可增加T 調節細胞或刺激抗炎細胞因子的產生[11]。嬰兒型雙歧桿菌通過產生短鏈脂肪酸(short-chain fatty acids,SCFAs),可以通過微生物群-腸道-腦軸減少炎性細胞因子并增強免疫調節反應[12]。
嗜酸乳桿菌具有調節免疫[13]、抑制炎癥反應[14]、促進黏膜修復[15]等功能。乳酸菌素是一種由純乳酸菌代謝產生的后生元制劑,具有抑制致病菌的生長,促進有益菌繁殖并改善胃腸道生態環境的作用[16]。前期研究表明,乳酸菌素片聯合抗生素療法可提高H.pylori感染潰瘍患者的根除率,促進潰瘍愈合,并降低不良反應發生率[17-19]。然而,尚未有關于乳酸菌素在H.pylori誘導慢性胃炎中炎癥反應和腸道菌群的作用機制報道。因此,本研究旨在探討乳酸菌素對H.pylori感染性胃炎小鼠炎癥和腸道菌群的影響,為后生元治療H.pylori感染性胃炎提供新的研究方向。
1 材料與方法
1.1 材料與儀器
幽門螺桿菌PMSS1 由南昌大學第一附屬醫院消化科呂農華教授惠贈;6 周齡SPF 級雄性C57BL/6 小鼠,體重(20±2)g,許可證號:SCXK(蘇)2018-0008 購自江蘇集萃藥康生物科技股份有限公司;乳酸菌素 江中藥業股份有限公司;腦心浸液 美國BD 公司;布氏瓊脂、革蘭氏染色液 索萊寶生物科技公司;羊血 溫州市康泰生物公司;胎牛血清(FBS)美國Thermo Fisher Scientific 公司;幽門螺旋桿菌添加劑 青島海博生物技術有限公司;Helicobacter pylori抗體試劑(免疫組織化學)北京中杉金橋生物有限公司;Warthin-Starry 銀染色液南京森貝伽生物科技有限公司;iNOS 抗體、IL-1β抗體、3-Nitrotyrosine 抗體 美國Abcam 公司。
MCO-170MUVHL-PC 型三氣培養箱 上海普和希健康醫療器械有限公司;DM3000 正置熒光顯微鏡 徠卡顯微系統(上海)貿易有限公司;HFsafe-1200LC 型生物安全柜 上海力康科學儀器有限公司。
1.2 實驗方法
1.2.1H.pylori的培養 將-80 ℃凍存的H.pylori菌株取出后,37 ℃解凍,取少量混懸菌液接種于含有1%幽門螺旋桿菌添加劑和5%羊血的固體平板中,置于微需氧培養箱(5%O2,10%CO2,85%N2)中培養。72 h 后,將平板中的菌落混懸于腦心浸液肉湯中,并于600 nm 下測定OD 值,依據1 OD=1×109CFU/mL 將菌液稀釋至2×109CFU/mL。
1.2.2H.pylori感染胃炎模型構建、分組及給藥C57BL/6 小鼠適應性飼養1 周后,建立H.pylori感染小鼠模型[20]:禁食禁水12 h,灌胃給予小鼠H.pylori混懸液0.3 mL,2 h 后恢復飲食,隔日灌胃1 次,共7 次。在末次灌胃之后,從感染組和未感染組各取3 只小鼠,解剖取胃組織,采用革蘭氏染色,H.pylori免疫組化染色,Warthin-Starry 銀染色觀察評價H.pylori在小鼠胃內定植情況。所有動物實驗程序均經江中藥業股份有限公司動物護理與使用委員會批準,并根據國家實驗動物倫理審查指南進行。
H.pylori感染C57BL/6 小鼠在4 周后觀察到中性粒細胞浸潤固有層和上皮細胞[21]。造模結束一個月后,將制備成功的H.pylori感染小鼠隨機分為模型組(MC)和乳酸菌素組(LB),每組8 只,分別給予生理鹽水和1.2 g·kg-1的乳酸菌素,陰性對照組(n=8)小鼠灌胃給予生理鹽水,每日一次,持續4 周。末次給藥24 h 后,處死小鼠,剖腹取胃組織沿大彎側剪開,用生理鹽水洗凈后分為多部份,用于后續檢測。
1.2.3 銀染色 Warthin-Starry 銀染色鑒定H.pylori定植的準確性高[22],其具體操作步驟如下:將固定好的胃組織依次進行脫水、石蠟包埋、切片和脫蠟處理。然后,使用梯度乙醇溶液進行水化,再將切片依次浸入酸性硝酸銀溶液和Warthin-Starry 染色液中,于56 ℃水浴染色至切片呈淡黃棕色。最后,進行常規脫水,二甲苯透明,中性樹脂封固和拍片。
1.2.4 免疫組化檢測胃組織iNOS、3-Nitrotyrosine和IL-1β的表達 將上述制好的切片脫蠟后,進行高溫抗原修復,血清封閉,再分別加入一抗(iNOS 按1:2000 稀釋;IL-1β按1:500 稀釋;3-Nitrotyrosine按1:100 稀釋;Helicobacter pylori抗體按1:100 稀釋),4 ℃孵育過夜,再滴加二抗37 ℃孵育30 min。DAB 顯色后,于蘇木素染液中復染,脫水,透明,中性樹脂封片,于光學顯微鏡下觀察小鼠胃組織中iNOS、3-Nitrotyrosine 和IL-1β的表達情況,以及H.pylori在胃黏膜上的定植情況。每組取4 張切片于200 倍光鏡下隨機選取3 個不連續的陽性表達視野,采用Image-Pro Plus 6.0 圖像分析系統測定iNOS、3-Nitrotyrosine 和IL-1β的平均光密度[23]。
1.2.5 胃組織HE 染色 胃組織切片脫蠟后,進行蘇木素染液染色4 min,然后經伊紅染液染色5 min,脫水,透明,中性樹脂封片,拍片,觀察小鼠胃黏膜組織形態學變化。
1.2.6 腸道菌群16S rRNA 基因高通量測序 取約0.2 g 小鼠盲腸內容物樣本,使用E.Z.N.A.? Soil DNA Kit 進行DNA 抽提,利用引物338F 和806R對提取出來的腸道菌群16S rRNA 基因的V3~V4 可變區進行擴增[24]。擴增程序如下:95 ℃預變性3 min;然后進行30 個循環,每個循環包括95 ℃變性30 s,55 ℃退火30 s,72 ℃延伸45 s;最后進行72 ℃延伸10 min[25]。采用AxyPrep DNA Gel Extraction Kit對PCR 產物進行純化,并使用微型熒光計Quantus? Fluorometer 進行定量檢測。利用NEXTFLEX Rapid DNA-Seq Kit 構建測序文庫,并使用Illumina Miseq 平臺進行測序。對獲得的原始數據使用Fastp(v0.19.6)軟件進行質控,然后使用Flash(v1.2.11)軟件進行拼接,再利用Uparse 算法(v11)對優化序列進行提取,按照97%的相似度進行OTU 聚類,同時在聚類過程中去除嵌合體,以獲得OUT 代表序列。采用RDP classifier(v2.13)貝葉斯算法對97%相似度的OTU 代表序列進行分類學分析。使用Mothur(v1.30.2)和Qiime(v1.9.1)軟件計算α和β多樣性,并生成各分類學水平豐度表。使用偏最小二乘法判別分析和LEfSe 分析來進行菌群比較和組間差異分析。
1.3 數據處理
采用SPSS 20.0 統計軟件對數據進行分析,各組實驗結果以均值±標準差(±s)表示,多組間比較采用單因素方差分析,P<0.05 表示具有顯著性差異。
2 結果與分析
2.1 H.pylori 在小鼠胃黏膜組織定植情況
胃組織經Warthin-Starry 銀染色后(圖1A),H.pylori呈現棕黑色,胞內黏液及胞質顯示淺黃色。經免疫組化染色后(圖1B),H.pylori呈黃褐色,細胞核呈藍色。與陰性對照組相比,Warthin-Starry 銀染色結果顯示感染組胃組織黏液層、上皮表面和細胞間均存在棕黑色棒狀或微螺旋形菌體(箭頭處),而免疫組化染色顯示感染組胃黏膜上皮中存在棕黃色菌體(箭頭處)。圖1C 為革蘭氏染色鏡檢結果,感染組胃組織勻漿后于布氏瓊脂平板上培養3 d,取菌落進行革蘭氏染色,可見呈紅色的桿狀、微螺旋形或S 形菌體,為革蘭氏陰性菌。鑒定結果證實感染組已定植H.pylori。
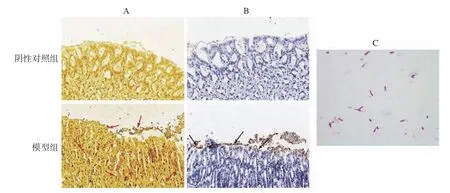
圖1 H.pylori 鑒定染色情況Fig.1 Identification staining of H.pylori colonization
2.2 各組胃黏膜組織病理學觀察
胃組織HE 染色結果顯示(圖2),陰性對照組胃黏膜上皮結構完整,細胞排列規整,腺管排列緊密有序,壁細胞及主細胞界限清晰,無明顯炎癥反應。模型組胃黏膜上皮細胞壞死脫落,腺管排列紊亂松散,腺體腔減小且數目減少,黏膜層有炎癥細胞(箭頭處)浸潤。與模型組相比,乳酸菌素組胃黏膜上皮結構趨于清晰完整,腺管排列更有序,腺體數量增加,炎癥細胞浸潤減少。
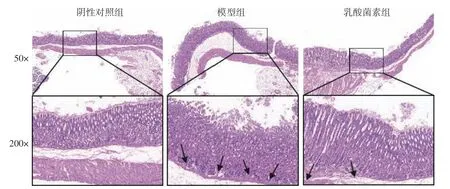
圖2 各組胃黏膜組織病理學變化(HE)Fig.2 Histopathological changes of gastric mucosa in each group (HE)
2.3 各組小鼠免疫組化結果
如圖3 所示,顯微鏡下觀察胃組織中iNOS、3-Nitrotyrosine 和IL-1β的表達情況,呈棕黃色為陽性表達,iNOS 主要在胃上皮細胞胞質中表達,3-Nitrotyrosine 和IL-1β主要在胃上皮細胞和腺體細胞胞質中表達。結果如表1 所示,與陰性對照組相比,感染H.pylori小鼠胃組織中iNOS、3-Nitrotyrosine 和IL-1β的平均光密度顯著性升高(P<0.01,P<0.001),乳酸菌素給藥后,iNOS、3-Nitrotyrosine和IL-1β的平均光密度顯著降低(P<0.05,P<0.01)。
表1 各組小鼠胃組織中iNOS、3-Nitrotyrosine 和IL-1β 的平均光密度統計結果(n=4,±s)Table 1 Mean optical density statistics of iNOS,3-Nitrotyrosine,and IL-1β in the gastric tissue of mice in each group (n=4,±s)

表1 各組小鼠胃組織中iNOS、3-Nitrotyrosine 和IL-1β 的平均光密度統計結果(n=4,±s)Table 1 Mean optical density statistics of iNOS,3-Nitrotyrosine,and IL-1β in the gastric tissue of mice in each group (n=4,±s)
注:與陰性對照組相比,##表示P<0.01,###表示P<0.001;與模型組相比,*表示P<0.05,**表示P<0.01。
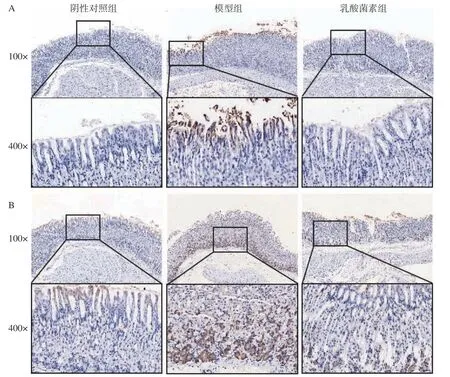
圖3 免疫組化法檢測胃組織iNOS(A)、3-Nitrotyrosine(B)和IL-1β(C)的表達Fig.3 Expression of iNOS (A),3-Nitrotyrosine (B),and IL-1β (C) in gastric tissues was detected by immunohistochemistry
2.4 乳酸菌素對H.pylori 小鼠腸道菌群的影響
2.4.1 測序質量評估 為了評估H.pylori小鼠盲腸內容物中16S rRNA 基因的測序質量和深度,繪制了Sob 指數稀釋曲線。如圖4 所示,Sob 指數曲線隨樣本測序深度的增加而逐漸增大,最終趨于平穩,表明當前測序數據量足以檢測到各樣本中絕大多數的菌群。
圖4 稀釋曲線Fig.4 Rarefaction curve
2.4.2α多樣性α多樣性采用ACE 指數、Chao 指數、Shannon 指數和Simpson 指數分析。ACE 指數和Chao 指數反映各組小鼠腸道菌群的豐度;Shannon 指數和Simpson 指數是衡量各組小鼠腸道菌群多樣性的指標。結果如表2 所示,與陰性對照組相比,模型組的ACE 指數、Chao 指數、Shannon 指數和Simpson 指數均無顯著性差異(P>0.05),說明感染H.pylori對小鼠腸道菌群α多樣性無顯著性影響。與模型組相比,乳酸菌素組的ACE 指數、Chao 指數和Shannon 指數均顯著性升高(P<0.05或P<0.01),Simpson 指數顯著性降低(P<0.01),說明乳酸菌素能顯著提高感染H.pylori小鼠的腸道菌群α多樣性。
表2 小鼠腸道菌群α 多樣性指數統計(n=6,±s)Table 2 α Diversity index of mice intestinal microflora (n=6,±s)

表2 小鼠腸道菌群α 多樣性指數統計(n=6,±s)Table 2 α Diversity index of mice intestinal microflora (n=6,±s)
注:與模型組相比,#表示P<0.05;##表示P<0.01。
2.4.3β多樣性β多樣性評價采用基于Bray_Curtis 距離的主坐標分析(Principal coordinate analysis,PCoA)。腸道菌群群落組成差異較小的樣本在圖中分布得更近。如圖5 所示,三組間樣本有明顯的分離(R2=0.2948,P=0.001)。其中,陰性對照組和模型組的樣本點完全分開(R2=0.2994,P=0.003),表明感染H.pylori的小鼠腸道菌群結構組成發生了顯著性改變。乳酸菌素組樣本點與模型組趨于分開(R2=0.2298,P=0.015),且乳酸菌素組樣本點與陰性對照組更接近,說明乳酸菌素干預恢復了感染H.pylori小鼠的腸道菌群結構組成。
2.4.4 門分類水平菌群相對豐度變化 如圖6 所示,在門水平上,三組小鼠的腸道菌群以厚壁菌門、擬桿菌門、放線菌門和疣微菌門為主。如表3 所示,與陰性對照組相比,模型組放線菌門豐度顯著性升高(P<0.01),疣微菌門豐度顯著性降低(P<0.05),擬桿菌門豐度降低但無顯著性(P>0.05),厚壁菌門/擬桿菌門比值(Firmicutes/Bacteroidete,F/B)略高(P>0.05);與模型組相比,乳酸菌素組的厚壁菌門和放線菌門豐度顯著性降低(P<0.05),擬桿菌門和疣微菌門豐度顯著性升高(P<0.05),F/B 比值降低(P<0.05)。
表3 小鼠腸道菌群門水平相對豐度(n=6,±s)Table 3 Relative abundance of mice intestinal flora phylum levels (n=6,±s)
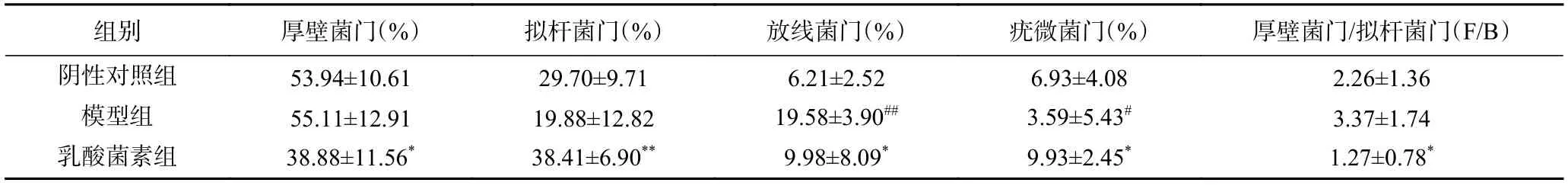
表3 小鼠腸道菌群門水平相對豐度(n=6,±s)Table 3 Relative abundance of mice intestinal flora phylum levels (n=6,±s)
注:與陰性對照組比較,#表示P<0.05,##表示P<0.01;與模型組比較,*表示P<0.05,**表示P<0.01。
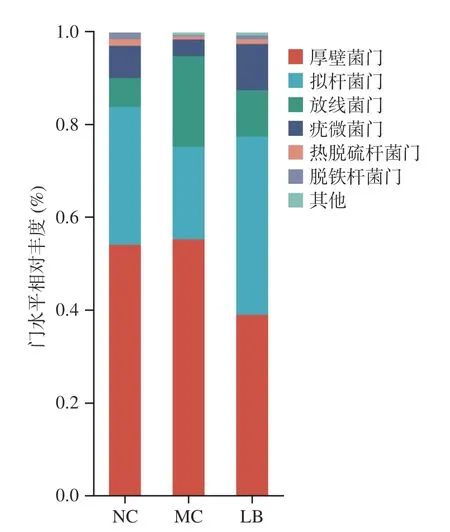
圖6 乳酸菌素對H.pylori 感染后小鼠腸道菌群門水平比較Fig.6 Comparison of the relative abundance of intestinal microflora of mice in each group after H.pylori infection under the phylum level of lacidophilin
2.4.5 屬分類水平菌群相對豐度變化 在屬水平上,各組小鼠腸道菌群組成如圖7A 所示。各組菌屬排名前10 中具有顯著性差異的菌屬如圖7B 所示,與陰性對照組比較,模型組的杜氏桿菌屬(Dubosiella),雙歧桿菌屬(Bifidobacterium),蘇黎世桿菌屬(Turicibacter)的相對豐度顯著增加(P<0.05),阿克曼氏菌屬(Akkermansia)的相對豐度顯著降低(P<0.05),g_norank_f_Muribaculaceae和另枝菌屬(Alistipes)的相對豐度呈下降趨勢,但差異無統計學意義(P>0.05)。與模型組相比,乳酸菌素組的g_norank_f_Muribaculaceae、阿克曼氏菌屬和另枝菌屬的相對豐度均顯著升高(P<0.05),杜氏桿菌屬和雙歧桿菌屬的相對豐度均顯著降低(P<0.05)。

圖7 乳酸菌素對H.pylori 感染后小鼠腸道菌群屬水平比較Fig.7 Comparison of the relative abundance of intestinal microflora of mice in each group after H.pylori infection under the genus level of Lacidophilin
2.4.6 差異菌群篩選 采用LEfSe 分析檢測組間在豐度上具有顯著性差異的菌群,以LDA>4.0 且P<0.05 為標準繪制LDA 判別柱形圖(圖8)。陰性對照組與模型組中具有顯著性差異的分類群主要屬于放線菌門,模型組與乳酸菌素組中差異顯著的分類群主要屬于擬桿菌門和疣微菌門。與陰性對照組比較,模型組中有8 種顯著差異分類群,即丹毒絲菌目(Erysipelotrichales)、丹毒絲菌科(Erysipelotrichaceae)、杜氏桿菌屬,以及放線菌門、放線菌綱(Actinobacteria)、雙歧桿菌目(Bifidobacteriales)、雙歧桿菌科(Bifidobacteriaceae)和雙歧桿菌屬。與模型組比較,乳酸菌素組具有15 種顯著差異分類群,主要包括疣微菌門、疣微菌綱(Verrucomicrobiae)、疣微菌目(Verrucomicrobiales)、阿克曼氏菌科(Akkermansiaceae)、阿克曼氏菌屬,以及擬桿菌門、擬桿菌綱(Bacteroidia)、擬桿菌目(Bacteroidales)和理研菌科(Rikenellaceae)等。
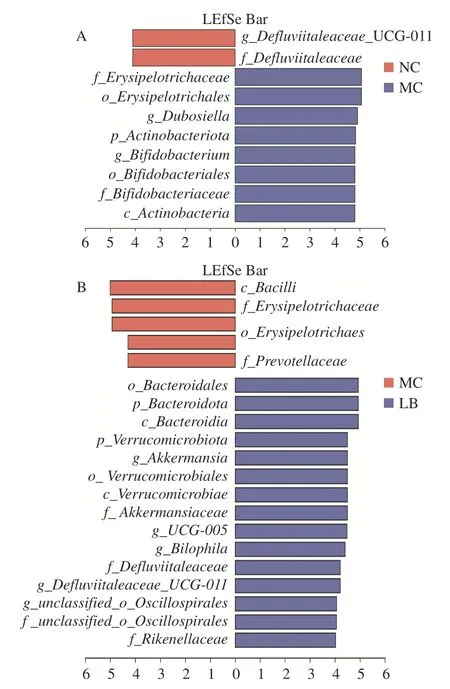
圖8 優勢生物標志分類群的線性判別分析效應大小(LEfSe)分析圖Fig.8 Linear discriminant analysis effect size (LEfSe)difference of dominant biomarker taxa
3 討論與結論
H.pylori感染與慢性胃炎的發生密切相關[26]。研究表明,H.pylori感染能夠通過多種毒力因子誘導NF-κB 信號通路的活化,從而促進iNOS 和IL-1β等多種細胞因子的上調[27]。IL-1β是一種促炎細胞因子,具有抑制胃酸分泌和增強炎癥的作用,其過表達與H.pylori感染期間炎癥反應的啟動密切相關[28]。iNOS 主要由中性粒細胞和單核細胞分泌,可通過催化NO 的合成,并在超氧化物和氧氣的作用下生成過氧亞硝酸鹽,進而引起蛋白質和核酸的硝化和氧化[29-30]。3-Nitrotyrosine 作為蛋白質硝化產物之一,是過氧亞硝酸鹽和其他活性氧或氮誘導的蛋白質損傷的生物標志物[29]。已有研究報道,H.pylori感染胃炎患者的胃黏膜炎性細胞浸潤增加,且iNOS、IL-1β和3-Nitrotyrosine 的表達顯著上調[31-33]。在本研究中,通過乳酸菌素干預后發現,H.pylori感染誘導的小鼠胃黏膜中iNOS、IL-1β和3-Nitrotyrosine 的表達顯著下降,同時乳酸菌素也顯著減少了侵入性炎癥細胞的數量,這些結果表明乳酸菌素可緩解H.pylori感染小鼠胃黏膜的炎癥反應和氧化損傷。
腸道菌群在人體的免疫系統中發揮重要作用,其動態平衡的維持與身體健康密不可分[34-35]。厚壁菌門和擬桿菌門是腸道菌群中主要的兩個優勢菌群,其組成比值的增加與免疫系統的異常激活和炎癥的產生密切相關[36-37]。據報道,H.pylori感染會增加小鼠體內厚壁菌門/擬桿菌門的比值和放線菌門的相對豐度,并降低疣微菌門的相對豐度,而補充益生菌可以恢復腸道菌群的組成[38]。與先前的研究結果一致[16],乳酸菌素可以調節厚壁菌門和擬桿菌門的相對豐度,并顯著提高腸道菌群的多樣性。本研究表明,乳酸菌素可以調節腸道菌群組成,有助于維持腸道正常生態,恢復H.pylori感染引起的腸道菌群破壞。
另外,16S rRNA 基因測序結果顯示,相較于模型組,乳酸菌素組小鼠的腸道菌群中歸屬于丹毒絲菌科的杜氏桿菌屬豐度降低,阿克曼氏菌屬、g_norank_f_Muribaculaceae和另枝菌屬豐度升高。研究發現,杜氏桿菌屬豐度的增加被認為與腸道炎癥和腸道菌群失調密切相關[39]。此外,有研究報道丹毒絲菌科與胃腸道炎癥相關疾病有關,在炎癥性腸病、結直腸癌和其他炎癥性疾病患者中發現丹毒絲菌科豐度顯著增加[40]。g_norank_f_Muribaculaceae和另枝菌屬均屬于擬桿菌門擬桿菌目。另枝菌屬可以產生乙酸鹽,一種具有抗炎作用的SCFAs[41]。SCFAs是由腸道有益菌代謝而產生的有益代謝產物,包括乙酸、丙酸和丁酸等,具有調節免疫、炎癥、氧化應激以及腸屏障功能等多種作用。g_norank_f_Muribaculaceae可通過產生SCFAs 和O-聚糖,促進有益菌定植于腸道并維持腸道菌群的動態平衡[42]。阿克曼氏菌屬屬于疣微菌門,能夠產生乙酸鹽和丙酸鹽,與腸道黏膜的通透性密切相關[43]。Deng 等[44]研究發現阿克曼氏菌屬與炎癥指標(如IL-6 和TNF-α)呈負相關,可直接黏附于腸道細胞,增強腸道黏液層的完整性,并減少在炎癥中起關鍵作用的基因的表達,從而發揮抗炎活性。
綜上所述,乳酸菌素可以改善H.pylori感染小鼠胃黏膜的炎癥反應和氧化損傷,并可恢復腸道菌群的相對豐度,促進有益菌的生長并抑制有害菌的繁殖,發揮調節腸道菌群結構的作用。本研究探討了乳酸菌素對H.pylori感染小鼠炎癥及腸道菌群的調節作用,為其臨床用藥提供有力支撐。
? The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

