光誘導基于EDA機理構建S-芳基黃原酸酯新策略
楊道山 左峻澤

主持人按語
專欄:光促進有機轉化和應用
【特約主持人】 :張志國:“河南省杰出青年科學基金”入選者
100多年前,意大利化學家G. Ciamician 和 P. Silber意識到有機光化學反應具有重要意義.十幾年前,當科學家將光氧化還原催化劑第一次應用到化學合成當中時,走向綠色化學的重大一步就這樣邁出了.普林斯頓大學化學系的David MacMillan教授認為:“光氧化還原反應不僅僅讓合成變得更快,更使以前根本不敢想的分子合成反應變為可能,而且你僅僅只需要一步反應”.光氧化還原催化劑主要包括金屬和有機光催化劑.由于金屬光催化劑當中的稀有金屬造價不菲,近年來有機光氧化還原催化劑快速興起.在對其修飾和設計之后可以達到廉價、高效催化氧化還原反應的效果,代替金屬催化劑.如今,有機光化學與多學科、多領域高度交叉融合,其核心使命是發展高效、高選擇性、高經濟性、節能又環保的方式實現物質的化學轉化.
本專欄圍繞兩種有機光催化劑促進的功能有機分子創制過程進行討論,其中《光誘導基于EDA機理構建S-芳基黃原酸酯新策略》發展了通過光誘導的硫負離子與噻蒽鹽間的電子給體受體過程實現C-S鍵構建的新策略.在溫和的、無金屬的條件下獲得了一系列S-芳基黃原酸酯類化合物并實現了克級規模的制備,證明了反應的潛在應用價值,為黃原酸酯類化合物的合成提供了一種新思路.《一鍋多組分反應合成3-(2-(芳基乙炔)苯基)喹唑啉酮》介紹了一種可用于通過自由基串聯環化反應合成含氮雜環化合物的新型自由基受體化合物的構建方法.合成了一系列3-(2-(芳基乙炔)苯基)喹唑啉酮類化合物,該系列化合物可以作為自由基受體在藍光誘導下轉化為新型膦酰化喹唑啉酮并喹啉類化合物.
期待本專欄能夠為從事有機光化學轉化領域中有機功能分子的設計、合成和應用等相關領域的研究者提供參考.
摘? 要:黃原酸酯類化合物作為藥物化學、農業化學、材料化學中重要的組成部分,一直備受化學家們的關注.尋找簡單、高效合成S-芳基取代黃原酸酯的方法引起了研究者廣泛的關注.報道了一種可見光誘導下基于硫負離子與噻蒽鹽間的EDA(電子供體受體)過程實現C-S鍵構建的新策略.在溫和無金屬的條件下,以中等至優良的收率得到了一系列S-芳基黃原酸酯,克級實驗與日光實驗證明了反應的應用潛力,為黃原酸酯類化合物的合成提供了一種新思路.
收稿日期:2023-06-27;修回日期:2023-08-13.
基金項目:國家自然科學基金(22271170).
作者簡介(通信作者):楊道山(1982-),男,山東臨沂人,青島科技大學教授,主要從事有機合成方法學研究,E-mail:yangdaoshan@tsinghua.org.cn.
引用本文:楊道山,左峻澤.光誘導基于EDA機理構建S-芳基黃原酸酯新策略[J].河南師范大學學報(自然科學版),2024,52(3):1-9.(Yang Daoshan,Zuo Junze.A new strategy for the synthesis of S-arylxanthate via electron donor acceptor complex photoactivation[J].Journal of Henan Normal University(Natural Science Edition),2024,52(3):1-9.DOI:10.16366/j.cnki.1000-2367.2023.06.27.0001.)
關鍵詞:黃原酸酯;EDA復合物;噻蒽鹽;可見光誘導;C-S鍵的構建
中圖分類號:O612????? 文獻標志碼:A文章編號:1000-2367(2024)03-0001-09
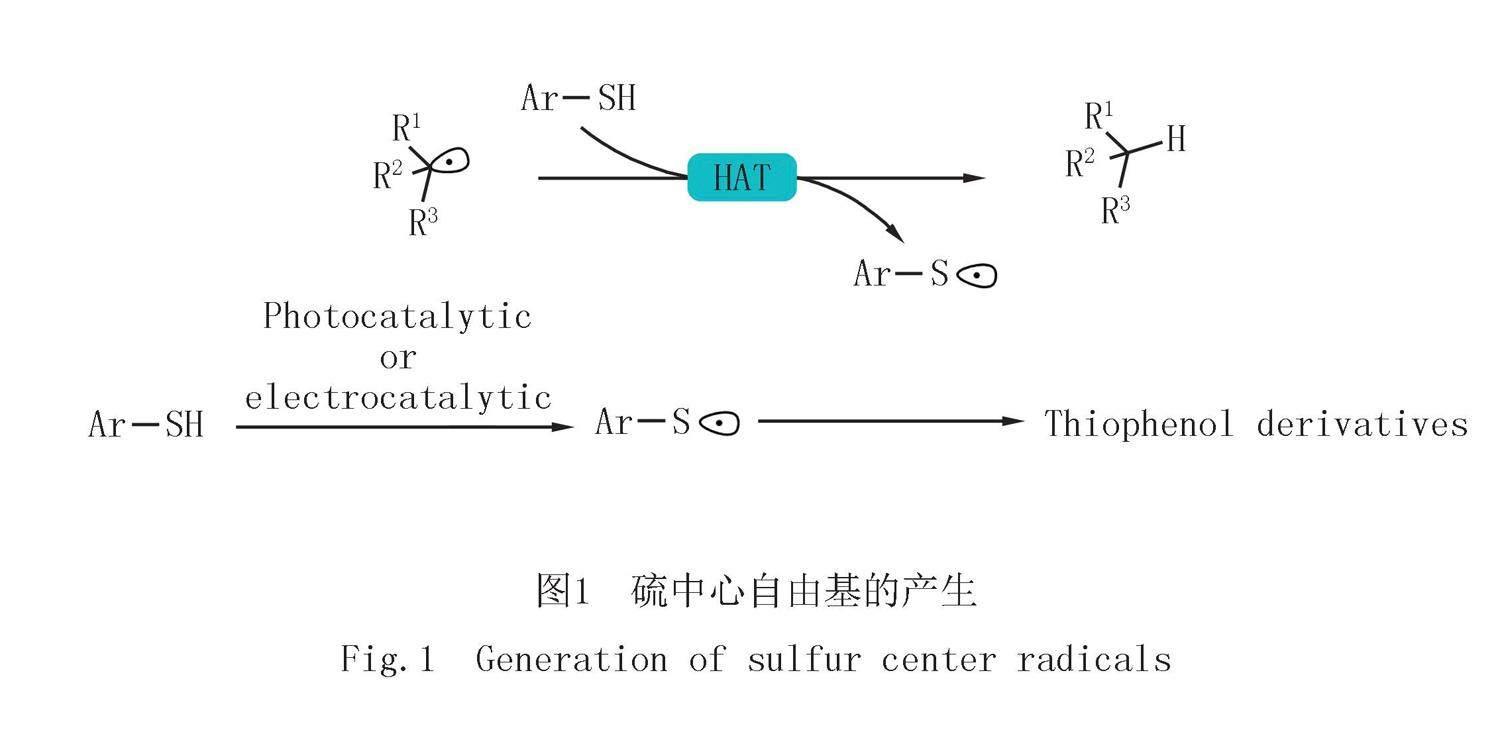
硫元素廣泛存在于天然產物及藥物分子中,構建含硫化合物在制藥工業和合成化學上具有重要意義[1-2].化學家們發現通過硫酚產生的硫中心自由基可以作為高活性中間體,用于實現復雜含硫化合物的構建,如圖1所示.硫鎓鹽是最具活性的自由基前體之一,同時由于其正電性,硫鎓鹽也是一類很好的電子受體.近年來硫鎓鹽廣泛用于EDA過程[3-5]中,具有很大的發展潛力[6-11].
黃原酸鹽是在堿性條件下由醇對CS2親核進攻生成的重要硫源試劑,在傅克反應[12]、三硫代碳酸酯的合成[13-14]、硫醇的合成[15]等過程中都有重要的應用.在有機全合成領域,黃原酸酯可以穩定活性自由基,從而提高活性自由基在高濃度介質中的存在時間,同時還可通過調節其絕對和相對濃度,使自由基加成到未活化的烯烴上[16].黃原酸酯還允許自由基添加到芳香環上,這一特性與烯烴的分子間加成結合,可用于構建3,4-二氫萘-1(2H)-酮化合物,在適當的條件下可以轉化成萘.這種通用、高效的合成手段對于制藥和農業化學工業以及材料科學來說非常重要[17-18].
由于黃原酸酯類化合物在藥物化學、農業化學和材料科學等領域中的重要作用,近年來,開發更廣泛的黃原酸酯類化合物引起了人們的廣泛關注.S-芳基的黃原酸酯類化合物作為一類重要的黃原酸酯衍生物,其高效的合成策略一直存在一定的挑戰.以往獲得S-芳基黃原酸酯的方法都不太成功,存在硫醚作為唯一產物或副產物[19-20]的問題,如圖2所示.最可靠的方法是基于1890年LEUCKART[21]提出的芳基重氮鹽的芳基化.然而,由于芳基重氮鹽存在著穩定性和安全性的問題,這種方法的應用受到限制.
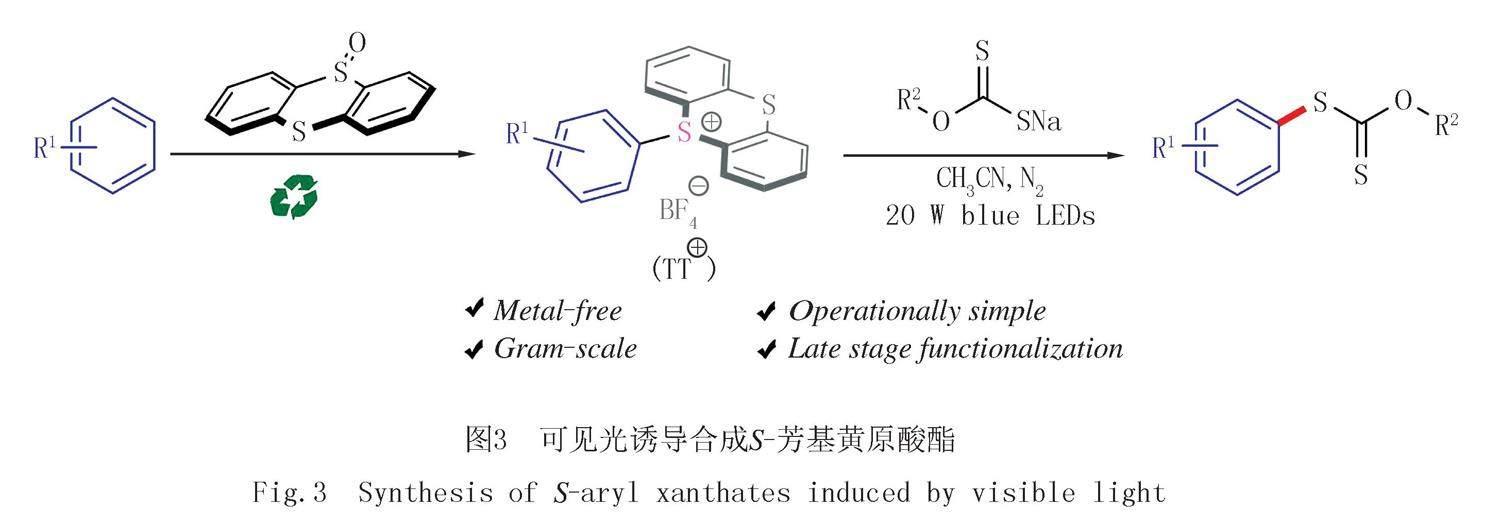
隨著可見光催化技術的發展,許多以前難以實現的反應可以在溫和的條件下進行[22-26].光誘導的EDA機理由于其無金屬性、溫和性,最近也成為光催化合成領域的一種有效策略[27-30].本文報道了一種溫和實用的方法,通過可見光激發噻蒽鹽和黃原酸鹽產生EDA復合物,從芳烴出發通過間接的C-H官能化策略實現芳基黃原酸酯類化合物的合成,如圖3所示.
1? 實驗部分
1.1? 儀器與試劑
所有溶劑與試劑(二異丙基乙胺,DIPEA;碳酸鈉,Na2CO3;碳酸鉀,K2CO3;叔丁醇鋰,tBuOLi;三乙胺,Et3N;吡啶,Pyridine;二氯甲烷,DCM;N,N-二甲基甲酰胺,DMF;N-甲基吡咯烷酮,NMP;四氫呋喃,THF;1,4-二氧六環,1,4-Dioxane;二甲基亞砜,DMSO;乙腈,CH3CN;乙醇,EtOH;乙酸乙酯,EtOAc)均為分析純,除特殊說明否則使用時未經進一步純化.核磁共振測試中所用溶劑為CDCl3(氘代氯仿)或 DMSO-d6(氘代二甲基亞砜),1H NMR所用頻率為500 MHz,13C NMR所用頻率為125 MHz.“δ”表示化學位移,“J”表示耦合常數.所有反應通過用GF254硅膠涂覆的TLC(薄層色譜)板監測.文中所有化合物均是通過使用200~300目硅膠填充的高壓快速柱色譜法分離純化.
1.2? 實驗方法
首先向烘箱干燥過的25 mL Schlenk管中加入磁力攪拌子,然后依次加入噻蒽鹽1a(0.3 mmol)、黃原酸鹽2a(0.4 mmol).加入完畢之后將Schlenk管置換氮氣至少3次.最后在氮氣保護下使用注射器加入反應所需溶劑DCM 2 mL.隨后封好管口,確保Schlenk管內體系被氮氣保護并處于封閉狀態,將Schlenk管置于藍光燈處,在室溫下進行光照并攪拌.反應一段時間后使用TLC技術對反應進行監測,直至反應結束.反應結束后,向體系中加入3~4 mL飽和食鹽水,然后加入EtOAc進行萃取,得到的有機相進行合并,無水硫酸鈉干燥后過濾并減壓旋蒸.最后將得到的體系通過柱層析法對體系進行分離純化,得到最終的產物.
1.3? 產物表征數據
O-環己基-S-(3-甲酰基-4-甲氧基)苯基黃原酸酯(3a).產物性狀:淡黃色液體;產率:85%(79 mg);洗脫劑:V(石油醚)/V(乙酸乙酯)= 20/1.1H NMR(500 MHz,CDCl3)δ: 10.45~10.43(m,1H),7.95(d,J=2.3 Hz,1H),7.65(dd,J=8.7,2.3 Hz,1H),7.05(d,J=8.7 Hz,1H),5.53~5.47(m,1H),3.98(s,3H),1.88~1.83(m,2H),1.57~1.51(m,4H),1.48~1.43(m,1H),1.39~1.33(m,2H),1.29~1.24(m,1H).13C NMR(CDCl3,125 MHz)δ: 212.10,188.64,162.68,142.47,135.69,125.34,122.40,112.55,82.97,56.01,30.56,25.13,23.10.
O-環戊基-S-(3-甲酰基-4-甲氧基)苯基黃原酸酯(3b).產物性狀:淡藍色液體;產率:85%(76 mg);洗脫劑:V(石油醚)/V(乙酸乙酯)=20/1.1H NMR(500 MHz,CDCl3)δ: 10.48(s,1H),7.96(d,J=2.4 Hz,1H),7.67(dd,J=8.7,2.4 Hz,1H),7.08(d,J=8.7 Hz,1H),5.84~5.79(m,1H),4.02(s,3H),1.94~1.88(m,2H),1.85~1.80(m,2H),1.63~1.59(m,4H).13C NMR(CDCl3,125 MHz,ppm)δ:212.14,188.65,162.66,142.42,135.66,125.32,122.47,112.51,88.14,56.00,32.46,23.74.
O-(4-苯丁基)-S-(3-甲酰基-4-甲氧基)苯基黃原酸酯(3c).產物性狀:淡黃色液體;產率:72%(78 mg);洗脫劑:V(石油醚)/V(乙酸乙酯)=20/1.1H NMR(500 MHz,CDCl3)δ:10.42(s,1H),7.95(t,J=2.6 Hz,1H),7.65(dd,J=8.7,2.4 Hz,1H),7.28(t,J=7.5 Hz,2H),7.19(t,J=7.3 Hz,1H),7.12(d,J=7.2 Hz,2H),7.02(d,J=8.7 Hz,1H),4.55(t,J=6.4 Hz,2H),3.95(s,3H),2.57(t,J=7.7 Hz,2H),1.76~1.71(m,2H),1.63~1.56(m,2H).13C NMR(CDCl3,125 MHz)δ:213.14,188.56,162.76,142.60,141.77,135.73,128.36,128.32,125.89,125.42,122.18,112.64,74.35,55.98,35.29,27.72,27.53.
O-環己基-S-對甲苯基黃原酸酯(3d).產物性狀:淡黃色液體;產率:82%(66 mg);洗脫劑:V(石油醚)/V(乙酸乙酯)=100/1.1H NMR(500 MHz,CDCl3)δ:7.38(d,J=8.0 Hz,2H),7.23(d,J=7.9 Hz,2H),5.56~5.49(m,1H),2.39(s,3H),1.88~1.79(m,2H),1.61~1.49(m,4H),1.39~1.23(m,4H).13C NMR(CDCl3,125 MHz)δ:212.78,140.16,134.89,129.87,126.79,82.42,30.48,25.13,22.94,21.38.
O-環戊基-S-對甲苯基黃原酸酯(3e).產物性狀:淡黃色液體;產率:80%(61 mg);洗脫劑:V(石油醚)/V(乙酸乙酯)=100/1.1H NMR(500 MHz,CDCl3)δ:7.36(d,J=8.1 Hz,2H),7.22(d,J=7.9 Hz,2H),5.78~5.82(m,1H),2.39(s,3H),1.89~1.76(m,4H),1.59~1.55(m,4H).13C NMR(CDCl3,125 MHz)δ:212.80,140.14,134.84,129.85,126.87,87.66,32.38,23.65,21.37.
O-4-叔丁苯基-S-(對甲苯基)黃原酸酯(3f).產物性狀:淡黃色液體;產率:70%(66 mg);洗脫劑:V(石油醚)/V(乙酸乙酯)=100/1.1H NMR(500 MHz,CDCl3)δ: 7.39(d,J=8.0 Hz,2H),7.30(t,J=7.5 Hz,2H),7.21(dd,J=12.3,7.7 Hz,3H),7.13(d,J=7.3 Hz,2H),4.56(t,J=6.3 Hz,2H),2.58(t,J=7.7 Hz,2H),2.39(s,3H),1.76~1.70(m,2H),1.62~1.56(m,2H).13C NMR(CDCl3,125 MHz)δ:213.72,141.79,140.32,134.97,129.98,128.34,128.29,126.60,125.82,73.99,35.25,27.69,27.47,21.37.
O-環己基-S-苯基黃原酸酯(3g).產物性狀:淡黃色液體;產率:80%(61 mg);洗脫劑:V(石油醚)/V(乙酸乙酯)=100/1.1H NMR(500 MHz,CDCl3)δ:7.54~ 7.49(m,2H),7.47~7.39(m,3H),5.57~5.50(m,1H),1.86~1.77(m,2H),1.59~1.53(m,2H),1.46~1.40(m,2H),1.39~1.31(m,2H),1.30~1.23(m,1H).13C NMR(CDCl3,125 MHz)δ:211.93,134.97,130.09,129.85,129.09,82.39,30.41,25.11,22.82.
O-環戊基-S-苯基黃原酸酯(3h).產物性狀:淡黃色液體;產率:75%(54 mg);洗脫劑:V(石油醚)/V(乙酸乙酯)=100/1.1H NMR(500 MHz,CDCl3)δ:7.52~7.46(m,2H),7.44~7.39(m,3H),5.82~5.77(m,1H),1.89~1.81(m,2H),1.78~1.76(m,2H),1.58~1.52(m,4H).13C NMR(CDCl3,125 MHz)δ:211.94,134.90,130.17,129.83,129.06,87.73,32.37,23.61.
O-環己基-S-(3,4-二甲氧基)苯基黃原酸酯(3i).產物性狀:淡黃色液體;產率:79%(74 mg);洗脫劑:V(石油醚)/V(乙酸乙酯)=100/1.1H NMR(500 MHz,CDCl3)δ:7.07(d,J=8.3 Hz,1H),7.00(s,1H),6.89(d,J=8.3 Hz,1H),5.56~5.48(m,1H),3.91(s,3H),3.87(s,3H),1.82~1.81(m,2H),1.59~1.48(m,4H),1.43~1.26(m,4H).13C NMR(CDCl3,125 MHz)δ:212.98,150.59,149.08,128.12,121.32,117.92,111.28,82.35,56.01,55.90,30.51,25.12,22.93.
O-環己基-S-4-(叔丁基)苯基黃原酸酯(3j).產物性狀:淡黃色液體;產率:81%(75 mg);洗脫劑:V(石油醚)/V(乙酸乙酯)=100/1.1H NMR(500 MHz,CDCl3)δ: 7.43(d,J=2.5 Hz,4H),5.56~5.53(m,1H),1.75(s,2H),1.59(d,J=6.4 Hz,2H),1.40~1.28(m,15H).13C NMR(CDCl3,125 MHz)δ:212.38,153.28,134.63,126.77,126.13,81.96,34.80,31.17,30.32,25.14,22.52.
O-環己基-S-4-(4-溴苯氧基)苯基黃原酸酯(3k).產物性狀:淡黃色液體;產率:92%(117 mg);洗脫劑:V(石油醚)/V(乙酸乙酯)=90/1.1H NMR(500 MHz,CDCl3)δ:7.47(ddd,J=8.2,5.0,1.9 Hz,4H),7.01(dd,J=8.6,1.8 Hz,2H),6.93(dd,J=8.7,1.8 Hz,2H),5.59~5.51(m,1H),1.82(s,2H),1.62~1.55(m,2H),1.52~1.32(m,6H).13C NMR(CDCl3,125 MHz)δ:212.22,158.57,155.36,136.88,132.89,124.38,121.19,118.86,116.66,82.40,30.42,25.14,22.83.
O-環己基-S-4-(1,1'-聯苯)基黃原酸酯(3l).產物性狀:淡黃色液體;產率:86%(65 mg);洗脫劑:V(石油醚)/V(乙酸乙酯)=100/1.1H NMR(500 MHz,CDCl3)δ: 7.64(dd,J=14.2,7.9 Hz,4H),7.58(d,J=8.2 Hz,2H),7.48(t,J=7.6 Hz,2H),7.40(t,J=7.3 Hz,1H),5.60~5.53(m,1H),1.89~1.81(m,2H),1.63~1.57(m,2H),1.50~1.48(m,2H),1.46~1.40(m,1H),1.40~1.34(m,2H),1.31~1.25(m,1H).13C NMR(CDCl3,125 MHz)δ:211.88,142.67,139.95,135.27,128.91,128.87,127.88,127.71,127.13,82.49,30.44,25.11,22.86.
O-(4-叔丁氧基)-S-4-(1,1'-聯苯)基黃原酸酯(3m).產物性狀:淡黃色液體;產率:66%(75 mg);洗脫劑:V(石油醚)/V(乙酸乙酯)=100/1.1H NMR(500 MHz,CDCl3)δ:7.64(d,J=8.2 Hz,2H),7.59(dd,J=12.3,8.0 Hz,4H),7.48(t,J=7.5 Hz,2H),7.40(t,J=7.3 Hz,1H),7.23(t,J=7.3 Hz,2H),7.17(t,J=7.2 Hz,1H),7.10(d,J=7.3 Hz,2H),4.58(t,J=6.3 Hz,2H),2.56(t,J=7.7 Hz,2H),1.63~1.57(m,2H),1.63~1.57(m,2H).13C NMR(CDCl3,125 MHz)δ:212.87,142.80,141.72,139.84,135.35,128.88,128.67,128.28,127.93,127.80,127.15,125.81,74.09,35.26,27.70,27.54.
2? 結果與討論
2.1? 反應條件的優化
以1a(芳基硫鎓鹽)、2a(環己基黃原酸鈉)作為反應的模板底物,對反應的最佳條件進行篩選.首先,在室溫下用455 nm藍光照射, DCM作為反應溶劑,對堿進行優化(表1,條目1~7),在使用Et3N作為堿時,反應產物的產率最高,達到了82%.同時實驗結果表明在無堿的情況下反應產物的產率沒有明顯變化,說明堿在反應中對體系沒有很大的促進作用(表1,條目8).然后對反應溶劑進行優化(表1,條目8~16),結果表明,CH3CN是反應的最佳溶劑.為了進一步提高轉化率,使用了DMSO與H2O作為混合溶劑進行探索.實驗結果表明,隨著H2O在混合溶劑中比例的提高,產物的產率并沒有提高,反而略微下降(表1,條目17~19),綜上選用CH3CN作為體系的最佳溶劑.在確定了反應體系的溶劑之后,對光照條件進行了探索:在室溫、黑暗環境中,并沒有檢測到反應產物,說明光照在反應過程中是必要的(表1,條目20).隨后探索了溫度對反應的影響,在避光的條件下,升高反應溫度,結果表明,溫度的升高會導致產率降低(表1,條目21~22).根據一系列的優化實驗,得到反應的最佳條件為以乙腈作為反應溶劑,在室溫及氮氣保護下光照,反應時間為24? h(表1,條目14).
2.2? 反應底物拓展
在確定最佳的反應條件后,為了探究反應策略對不同官能團的耐受性,對不同取代的硫鎓鹽1和黃原酸鹽2的底物適應范圍進行了探究,結果總結在表2中.實驗結果表明,不同的反應底物均能生成對應的S-芳基黃原酸酯3,并且產率良好(3a~3m).首先使用環己醇、環戊醇、1-苯基-4-丁醇合成對應的黃原酸鹽與芳基硫鎓鹽進行拓展.由鄰甲氧基苯甲醛合成對應的硫鎓鹽與黃原酸鹽生成的衍生物3a~3c,產率在72%~85%.隨后又嘗試了給電子基團的芳基合成的硫鎓鹽進行拓展.對甲基苯合成的硫鎓鹽以70%~82%的產率得到產物3d~3f.而以苯合成的硫鎓鹽與黃原酸鹽反應生成的底物3g、3h也以80%、75%的產率得到.當以其他取代苯如鄰二甲氧基苯、叔丁基苯也都分別以79%、81%的產率得到3i~3j.其他芳香化合物如4-溴聯苯醚合成的硫鎓鹽與環己基黃原酸鹽也得到對應的衍生物3k,產率為92%;聯苯合成的硫鎓鹽也得到了對應的產物3l、3m,產率為86%、66%.上述結果表明,在此策略中各種芳基取代的硫鎓鹽都表現出了良好的耐受性,證明了該策略具有良好的底物范圍,對S-芳基黃原酸酯類化合物的研究起到重要的促進作用.
2.3? 反應應用性研究
接下來,為了證明反應具有潛在的應用價值,以硫鎓鹽1a、黃原酸鹽2a為底物進行了克級轉化,以78%的收率得到了目標產物3a.此外,為了證明體系對反應條件的耐受性,還進行了日光實驗,在日光下以71%的產率得到產物3a(圖4).這些結果充分證明了該策略潛在的價值.
此外,在標準條件下處理硫鎓鹽1a與黃原酸鹽2a反應的產物后,還以94%的分離產率回收了噻蒽,可以繼續合成5-氧化噻蒽,進而合成硫鎓鹽.這證明此策略良好的原子經濟性,如圖5所示.
2.4? 反應機理研究
2.4.1? 自由基捕獲實驗
為了進一步探究反應機理,進行了自由基捕獲實驗.首先,在標準條件下,在反應體系里加入了0.6 mmol TEMPO(四甲基哌啶氧化物,一種常見的自由基捕獲劑).實驗結果表明,3a的形成被完全抑制,如圖6.這一實驗結果證明了反應轉化中涉及自由基的過程,但沒有捕獲到自由基中間體,可能是該反應體系中自由基物種過于活潑導致.
2.4.2? 可能的機理
在初步實驗結果和已有報道的基礎上,提出了一種合理的反應機理.首先,硫鎓鹽1與黃原酸鹽2通過陰離子交換過程反應生成 EDA復合物A.隨后EDA復合物A被光激發變為激發態B,并且在光誘導下進行從黃原酸鹽陰離子到硫鎓鹽1誘導的單電子轉移(SET),產生一個自由基中間體C和一個硫中心自由基D.自由基C經歷不可逆的裂解以產生芳基自由基F和可以循環利用的噻蒽E.最后,硫中心自由基D與芳基自由基F通過偶聯以產生目標產物3.
3? 結? 論
綜上所述,利用光激活EDA復合物,在溫和無金屬的條件下高效地實現了C-S鍵的構建,得到了一系列S-芳基黃原酸酯類化合物,并成功放大到克級,克服了這類化合物難以高效合成的難題.以噻蒽鹽為芳基化試劑和電子受體,再一次證明了噻蒽鹽應用的巨大潛力.此外,S-芳基黃原酸酯有望通過后期修飾,促進新的醫用藥物和農藥的出現.
參? 考? 文? 獻
[1]?? FENG M H,TANG B Q,LIANG S H,et al.Sulfur containing scaffolds in drugs:synthesis and application in medicinal chemistry[J].Current Topics in Medicinal Chemistry,2016,16(11):1200-1216.
[2]ZHAO J Y,JIANG X F.The application of sulfur-containing peptides in drug discovery[J].Chinese Chemical Letters,2018,29(7):1079-1087.
[3]XU H,LI X F,DONG Y Z,et al.Thianthrenium-enabled phosphorylation of aryl C-H bonds via electron donor-acceptor complex photoactivation[J].Organic Letters,2023,25(20):3784-3789.
[4]XU H,LI X F,MA J,et al.An electron donor-acceptor photoactivation strategy for the synthesis of S-aryl dithiocarbamates using thianthrenium salts under mild aqueous micellar conditions[J].Chinese Chemical Letters,2023,34(11):108403.
[5]CABRERA-AFONSO M J,GRANADOS A,MOLANDER G A.Sustainable thioetherification via electron donor-acceptor photoactivation using thianthrenium salts[J].Angewandte Chemie(International Ed in English),2022,61(22):e202202706.
[6]BERGER F,PLUTSCHACK M B,RIEGGER J,et al.Site-selective and versatile aromatic C-H functionalization by thianthrenation[J].Nature,2019,567(7747):223-228.
[7]ENGL P S,HRING A P,BERGER F,et al.C-N cross-couplings for site-selective late-stage diversification via aryl sulfonium salts[J].Journal of the American Chemical Society,2019,141(34):13346-13351.
[8]LI J K,CHEN J T,SANG R C,et al.Photoredox catalysis with aryl sulfonium salts enables site-selective late-stage fluorination[J].Nature Chemistry,2020,12(1):56-62.
[9]YE F,BERGER F,JIA H,et al.Aryl sulfonium salts for site-selective late-stage trifluoromethylation[J].Angewandte Chemie(International Ed in English),2019,58(41):14615-14619.
[10]XU P,ZHAO D,BERGER F,et al.Site-selective late-stage aromatic[(18)F]fluorination via aryl sulfonium salts[J].Angewandte Chemie(International Ed in English),2020,59(5):1956-1960.
[11]SANG R C,KORKIS S E,SU W Q,et al.Site-selective C-H oxygenation via aryl sulfonium salts[J].Angewandte Chemie(International Ed in English),2019,58(45):16161-16166.
[12]KAWATA T,HARANO K,TAGUCHI T.Catalytic rearrangement of xanthates to dithiolcarbonates[J].Chemical and Pharmaceutical Bulletin,1973,21(3):604-608.
[13]YOSHIDA H,OGATA T,INOKAWA S.The conversion of some alkylxanthates to the corresponding trithiocarbonates.the nucleophilic reaction of -SCSSR[J].Bulletin of the Chemical Society of Japan,1971,44(11):3106-3108.
[14]OVERBERGER C G,DRUCKER A.The preparation of meso-and DL-α,α'-stilbenedithiol,meso-and DL-2,3-butanedithiol,and DL-1,2,3,4-butanetetrathiol[J].The Journal of Organic Chemistry,1964,29(2):360-366.
[15]DJERASSI C,GORMAN M,MARKLEY F X,et al.Studies in organic sulfur compounds.VII.1 lithium aluminum hydride reduction of xanthates to mercaptans.synthesis of substituted β-mercaptoethanols[J].Journal of the American Chemical Society,1955,77(3):568-571.
[16]QUICLET-SIRE B,ZARD S Z.On the strategic impact of the degenerative transfer of xanthates on synthetic planning[J].Israel Journal of Chemistry,2017,57(3/4):202-217.
[17]ZHAO B W,LI J J,PAN X Q,et al.Photoinduced free radical promoted cationic RAFT polymerization toward "living" 3D printing[J].ACS Macro Letters,2021,10(10):1315-1320.
[18]BARTHET C,WILSON J,CADIX A,et al.Micellar RAFT/MADIX polymerization[J].ACS Macro Letters,2017,6(12):1342-1346.
[19]VOLKOV A A,BUGAENKO D I,BOGDANOV A V,et al.Visible-light-driven thioesterification of aryl halides with potassium thiocarboxylates:transition-metal catalyst-free incorporation of sulfur functionalities into an aromatic ring[J].The Journal of Organic Chemistry,2022,87(12):8170-8182.
[20]HE R F,LIU Y,FENG Y Q,et al.Access to thienopyridine and thienoquinoline derivatives via site-selective C-H bond functionalization and annulation[J].Organic Letters,2022,24(17):3167-3172.
[21]LEUCKART R.Eine neue methode zur darstellung aromatischer mercaptane[J].Journal Für Praktische Chemie,1890,41(1):179-224.
[22]YU X Y,CHEN J R,XIAO W J.Visible light-driven radical-mediated C-C bond cleavage/functionalization in organic synthesis[J].Chemical Reviews,2021,121(1):506-561.
[23]GENTRY E C,KNOWLES R R.Synthetic applications of proton-coupled electron transfer[J].Accounts of Chemical Research,2016,49(8):1546-1556.
[24]ARORA A,WEAVER J D.Visible light photocatalysis for the generation and use of reactive azolyl and polyfluoroaryl intermediates[J].Accounts of Chemical Research,2016,49(10):2273-2283.
[25]ENGL S,REISER O.Copper-photocatalyzed ATRA reactions:concepts,applications,and opportunities[J].Chemical Society Reviews,2022,51(13):5287-5299.
[26]CHANG L,AN Q,DUAN L F,et al.Alkoxy radicals see the light:new paradigms of photochemical synthesis[J].Chemical Reviews,2022,122(2):2429-2486.
[27]CHEN Z R,XUE F,LIU T X,et al.Synthesis of β-hydroxysulfides via visible-light-driven and EDA complex-promoted hydroxysulfenylation of styrenes with heterocyclic thiols in EtOH under photocatalyst-free conditions[J].Green Chemistry,2022,24(8):3250-3256.
[28]WOZ′NIAK ,MURPHY J J,MELCHIORRE P.Photo-organocatalytic enantioselective perfluoroalkylation of β-ketoesters[J].Journal of the American Chemical Society,2015,137(17):5678-5681.
[29]LIANG X,LI Y F,XIA Q,et al.Visible-light-driven electron donor-acceptor complex induced sulfonylation of diazonium salts with sulfinates[J].Green Chemistry,2021,23(22):8865-8870.
[30]YANG Z L,LIU Y T,CAO K,et al.Synthetic reactions driven by electron-donor-acceptor(EDA) complexes[J].Beilstein Journal of Organic Chemistry,2021,17:771-799.
A new strategy for the synthesis of S-arylxanthate via electron donor acceptor complex photoactivation
Yang Daoshan, Zuo Junze
(College of Chemistry and Molecular Engineering, Qingdao University of Science and Technology, Qingdao 266042, China)
Abstract: Xanthate esters have been attacting chemists' interest as an important component in medicinal chemistry, agricultural chemistry, and materials chemistry. However, the efficient synthesis of S-aryl-substituted xanthate esters has still faced challenges. Herein, we report a new strategy for the construction of C-S bonds based on the EDA(electron donor acceptor) process under light-induced conditions. A series of S-aryl xanthates were obtained in moderate to excellent yields under mild metal-free conditions. Gram-scale and sunlight experiments demonstrated the potential applications of the reaction, which will provide a new strategy for the synthesis of xanthate esters.
Keywords: xanthate esters; electron donor acceptor complex; thianthrenium salts; visible light induction; construction of C-S bond
[責任編校? 趙曉華? 陳留院]

