頸動脈磁共振血管成像對TIA病人短期并發急性腦梗死的預測價值
秦緒沛,魏金夢,張宏光
摘要目的:探討頸動脈磁共振血管成像(MRA)對短暫性腦缺血發作(TIA)病人短期并發急性腦梗死(ACI)的預測價值及意義。方法:選取2020年2月—2022年2月我院收治的187例TIA病人,根據6個月內是否并發ACI分為ACI組(90例)與無ACI組(97例),比較兩組基線資料、頸動脈MRA檢查結果(狹窄程度、斑塊內出血、壞死脂核、纖維帽破裂、最小管腔面積、最大管壁厚度),采用Spearman或Pearson分析頸動脈MRA參數與ABCD3-I評分的相關性,分析TIA短期內并發ACI風險因素,采用受試者工作特征(ROC)曲線分析頸動脈MRA參數單獨及聯合預測TIA并發ACI的價值。結果:ACI組年齡大于無ACI組,糖尿病、高血壓病人多于無ACI組,ABCD3-I評分高于無ACI組(P<0.001);ACI組狹窄程度重度、斑塊內出血、壞死脂核、纖維帽破裂病人多于無ACI組,最小管腔面積小于無ACI組,最大管壁厚度大于無ACI組(P<0.05);狹窄程度、斑塊內出血、壞死脂核、纖維帽破裂、最大管壁厚度與ABCD3-I評分呈正相關(r值分別為0.891,0.826,0.771,0.864,0.837,P均<0.001),最小管腔面積與ABCD3-I評分呈負相關(r=-0.856,P<0.001);偏相關性分析顯示,校正了年齡、糖尿病、高血壓后,狹窄程度、斑塊內出血、壞死脂核、纖維帽破裂、最小管腔面積、最大管壁厚度仍與ABCD3-I評分獨立相關(P<0.05);繪制ROC曲線顯示,狹窄程度、斑塊內出血、壞死脂核、纖維帽破裂、最小管腔面積、最大管壁厚度預測TIA并發ACI的ROC曲線下面積(AUC)分別為0.878,0.930,0.868,0.913,0.764,0.759,6項參數聯合預測的AUC為0.951。結論:狹窄程度、斑塊內出血、壞死脂核、纖維帽破裂、最小管腔面積、最大管壁厚度與TIA病人短期并發ACI獨立相關,采用頸動脈MRA可檢測以上項目,從而對TIA病人并發ACI的風險進行預測,以指導臨床干預,減少ACI的發生。
關鍵詞急性腦梗死;頸動脈;磁共振血管成像;短暫性腦缺血發作;預測價值
doi:10.12102/j.issn.1672-1349.2024.08.031
短暫性腦缺血發作(transient ischemic attack,TIA)短期內并發急性腦梗死(acute cerebral infarction,ACI)風險明顯高于普通人群,是ACI的一個超級預警信號,但臨床實踐發現,部分TIA病人臨床癥狀可完全緩解,提示不同TIA病人發生ACI風險不同,若能早期準確預測病人并發ACI風險,則對臨床綜合管理TIA,提高防治ACI的水平意義重大[1-2]。研究發現,頸動脈粥樣硬化與ACI息息相關,血管嚴重狹窄及易損斑塊破裂引發的血栓栓塞是ACI的直接誘發因素,故頸動脈被認為是反映動脈粥樣硬化的窗口和ACI的警報器[3]。目前,數字減影血管造影是判斷血管狹窄的金標準,但系有創性影像學工具,且在評估斑塊穩定性、管壁特征方面價值有限[4]。磁共振血管成像(MR angiography,MRA)具有無創、非侵入、無X線電離輻射等優點,通過多參數成像和技術,能直接顯示頸動脈粥樣硬化情況、血管狹窄程度、斑塊穩定性等特征,所以推測頸動脈MRA可能有助于預測TIA病人并發ACI的風險[5-6]。基于此本研究探討頸動脈MRA對TIA病人短期并發ACI的預測價值及意義,為預防ACI發生、促進病情良好轉歸等提供參考。
1資料與方法
1.1臨床資料
選取2020年2月—2022年2月我院收治的187例TIA病人。納入標準:符合TIA診斷標準[7];承諾可配合隨訪與研究;既往無ACI病史;簽署知情同意書。排除標準:入組時正在接受試驗性的治療者;可疑心源性卒中病人;顱內出血病人;帶有心臟起搏器者;妊娠期病人;帶有動脈瘤夾者;重度高熱病人。本研究遵循世界醫學協會《赫爾辛基宣言》要求,本研究經過醫院倫理委員會批準,全部病人均知情,自愿加入。
1.2方法
1.2.1頸動脈MRA檢查
就診時進行檢查,使用磁共振掃描儀(飛利浦Intera Archieva 3.0T),8通道頸動脈相控表面線圈,取病人仰臥位,指導其自然伸展頸部,頸動脈專用線圈參考雙側下頜角放置,掃描序列包括2D和3D時間飛躍、四反轉T1加權成像、多平面雙反轉T2加權成像、三維磁化準備快速梯度回波序列,以癥狀側血管為基準進行掃描定位。橫軸位2D時間飛躍:矩陣256×192,間隔1.0 mm,層厚2 mm,視野(FOV)14 cm×14 cm,回波時間(TE)3.9 ms,重復時間(TR)14.4 ms;3D時間飛躍:矩陣256×256,層厚1 mm,FOV 14 cm×14 cm,TE 4.0 ms,TR 20 ms;四反轉T1加權成像:矩陣256×256,層厚2 mm,FOV 14 cm×14 cm,TE 10 ms,TR 800 ms;多平面雙反轉T2加權成像:矩陣256×256,層厚2 mm,FOV 14 cm×14 cm,TE 50 ms,TR 4 800 ms;三維磁化準備快速梯度回波序列:矩陣256×256,層厚1 mm,FOV 14 cm×14 cm,TE 5.3 ms,TR 8.8 ms。
1.2.2頸動脈MRA圖像分析
在配套專用血管斑塊分析平臺評估斑塊內主要成分:斑塊內出血、壞死脂核、纖維帽破裂情況;狹窄率=(1-最狹窄處直徑/遠端正常動脈直徑)×100%,介于0~49%、50%~74%、≥75%分別為輕度、中度、重度狹窄;最小管腔面積:癥狀側血管各層面管腔面積的最小值;最大管壁厚度:癥狀側血管各層面血管壁的最大厚度。由2名從事血管影像學診斷工作>5年的副主任醫師在雙盲情況下完成閱片,2名醫師意見一致作為最終結果,若兩者意見不一致,通過協商取得一致的結果,必要時請主任醫師協助判斷。
1.2.3隨訪與分組
以門診方式隨訪6個月,根據6個月內是否并發ACI分為ACI組(90例)與無ACI組(97例)。
1.3觀察指標
1)兩組基線資料。2)兩組頸動脈MRA檢查結果:狹窄程度、斑塊內出血、壞死脂核、纖維帽破裂、最小管腔面積、最大管壁厚度。3)頸動脈MRA參數與ABCD3-I評分相關性,其中ABCD3-I評分評估項目包括年齡、血壓、合并癥、TIA持續時間等,總分13分,分值越高,表明TIA病人并發ACI的風險越高。4)分析TIA短期內并發ACI風險因素。5)頸動脈MRA參數單獨及聯合預測并發ACI的價值。
1.4統計學處理
采用SPSS 24.0軟件分析數據,符合正態分布的定量資料以均數±標準差(x±s)表示,比較采用t檢驗;定性資料采用例數、百分比(%)表示,比較采用χ2檢驗;采用Spearman或Pearson分析頸動脈MRA參數與ABCD3-I評分相關性,采用偏回歸分析TIA短期內并發ACI風險因素,采用受試者工作特征(receiver operating characteristic,ROC)曲線分析頸動脈MRA參數單獨及聯合預測并發ACI的價值。以P<0.05為差異有統計學意義。
2結果
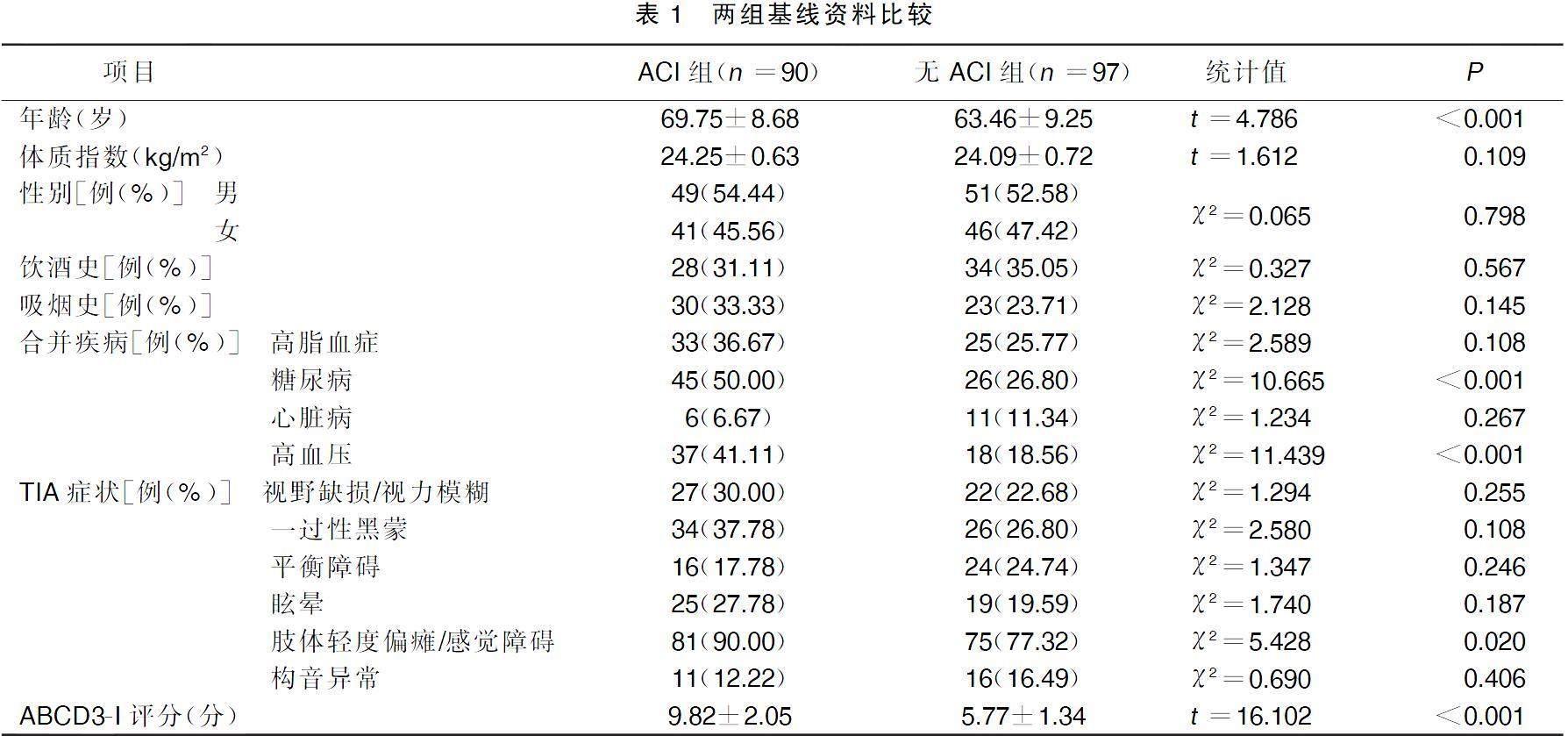
2.1兩組基線資料比較
ACI組年齡大于無ACI組,糖尿病、高血壓、肢體程度偏安全感覺障礙病人多于無ACI組,ABCD3-I評分高于無ACI組(P<0.05);ACI組體質指數、性別、飲酒史、吸煙史、高脂血癥、心臟病、TIA癥狀與無ACI組比較,差異無統計學意義(P>0.05)。詳見表1。
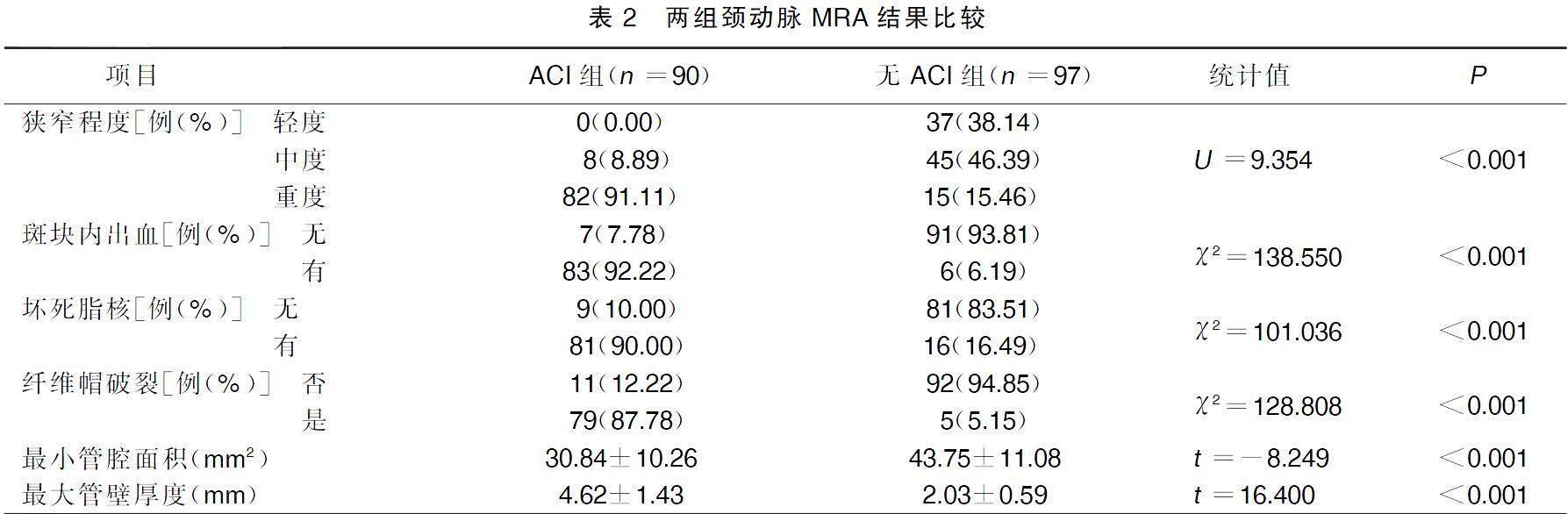
2.2兩組頸動脈MRA比較
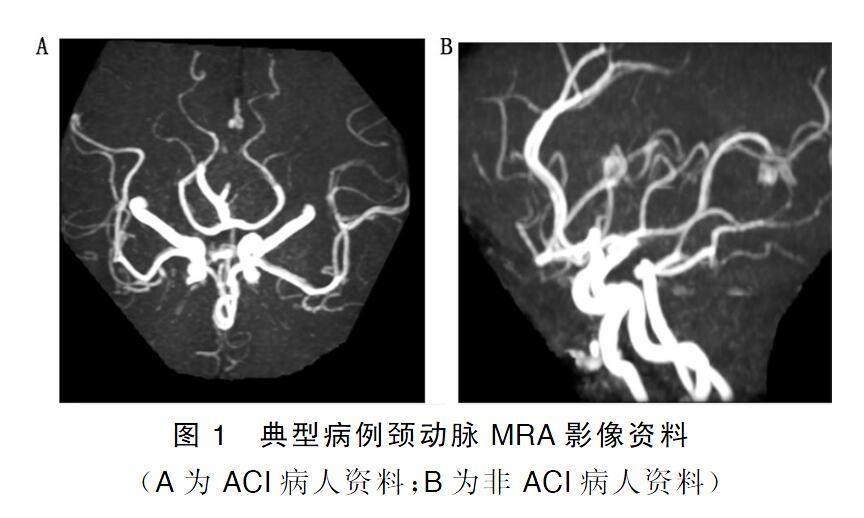
ACI組狹窄程度重度、斑塊內出血、壞死脂核、纖維帽破裂病人占比分別為91.11%、92.22%、90.00%、87.78%,高于無ACI組的15.46%、6.19%、16.49%、5.15%(P<0.001);ACI組最小管腔面積小于無ACI組,最大管壁厚度大于無ACI組(P<0.001)。詳見表2。典型病例頸動脈MRA影像資料見圖1,圖1A為ACI病人,頸動脈MRA顯示中度狹窄,斑塊內出血,有壞死脂核,纖維帽破裂,最小管腔面積38 mm2,最大管壁厚度5.32 mm。圖1B為非ACI病人,頸動脈MRA顯示無狹窄,斑塊無出血,無壞死脂核,無纖維帽破裂,最小管腔面積52 mm2,最大管壁厚度1.51 mm。
2.3頸動脈MRA與TIA短期內并發ACI風險的相關性分析
相關性分析顯示,狹窄程度、斑塊內出血、壞死脂核、纖維帽破裂、最大管壁厚度與ABCD3-I評分呈正相關(r分別為0.891,0.826,0.771,0.864,0.837,P均<0.001),最小管腔面積與ABCD3-I評分呈負相關(r=-0.856,P<0.001)。
2.4TIA短期內并發ACI風險的偏回歸分析
偏回歸分析顯示,狹窄程度、斑塊內出血、壞死脂核、纖維帽破裂、最小管腔面積、最大管壁厚度與ABCD3-I評分獨立相關(P<0.05)。詳見表3。
2.5頸動脈MRA預測并發ACI的ROC曲線分析
繪制ROC曲線顯示,狹窄程度、斑塊內出血、壞死脂核、纖維帽破裂、最小管腔面積、最大管壁厚度預測TIA并發ACI的ROC曲線下面積(area under the curve,AUC)分別為0.878,0.930,0.868,0.913,0.764,0.759,其中斑塊內出血的AUC和敏感度最大,其次是纖維帽破裂,預測特異度最高的是纖維帽破裂;利用狹窄程度、斑塊內出血、壞死脂核、纖維帽破裂、最小管腔面積、最大管壁厚度6個因素建立Logistic回歸模型,繪制ROC曲線,分析顯示,6個因素聯合預測TIA并發ACI的AUC為0.951,95%CI(0.885,0.963),敏感度為84.44%,特異度為89.69%。詳見圖2及表4。
3討論
頸動脈狹窄是ACI證據充分的可干預的危險因素,其常用篩查手段有超聲、CT血管成像、MRA等,其中超聲準確性對檢查醫師的經驗依賴性較高,導致結果差異較大,且對鈣化外的斑塊成分較難準確分辨;CT血管成像需注射造影劑,且增強后斑塊受高密度血流影響,無法準確測量斑塊密度,故對斑塊穩定性的評估價值有限,同時其具有輻射,臨床應用有限。
趙富強等[8]發現,MRA診斷血管狹窄、腦梗死范圍等與數字減影血管造影具有較高的一致性,可作為一種有效的替代工具,用于初步篩查人群ACI的風險。本研究采用頸動脈MRA檢查發現,ACI組重度狹窄病人占比為91.1%,高于無ACI組的15.46%,與未并發ACI病人相比,并發ACI病人狹窄程度更嚴重,且狹窄程度與ABCD3-I評分呈正相關,表明狹窄程度與TIA病人并發ACI有關,采用頸動脈MRA能評估狹窄程度,從而為臨床預測ACI概率提供參考。在后續的偏相關性分析中發現,校正了混雜因素后,狹窄程度仍與ACI風險相關。Osmanodja等[9]報道采用頸動脈MRA的3D時間飛躍序列掃描發現,其對頸動脈狹窄具有較高的檢出率,是評估狹窄程度的一個理想序列。本研究結果也支持這一觀點。頸動脈MRA的3D時間飛躍序列基于層塊激勵采集方法,具有信噪比高、空間分辨率高、采集范圍大等優勢,其評估管腔狹窄等級與數字減影血管造影差異無統計學意義,但檢測結果易受渦流影響,造成信號丟失,從而過度評估血管狹窄的程度[10]。本研究在該序列基礎上,還使用了三維磁化準備快速梯度回波序列,增強了對背景組織、血流信號抑制作用,從而提高對血管狹窄的評估準確度。
由于頸動脈管腔狹窄能通過血管壁正性重塑進行代償性擴張,所以能在一定程度上降低斑塊阻塞引起的管腔狹窄,維持正常的血流量,所以僅依賴頸動脈管腔狹窄對ACI進行預測具有一定局限性。除頸動脈狹窄外,動脈粥樣硬化斑塊破裂引起的管腔堵塞或斑塊內容物釋放至血流中造成的血栓形成是ACI的重要誘因,所以斑塊穩定性評估至關重要。斑塊內出血、壞死脂核、纖維帽破裂是評估斑塊穩定性和急性心腦血管事件的重要參數[11]。隨著影像學技術發展,斑塊穩定性評估方法從有創逐漸過渡到無創,從模糊逐漸過渡到準確,其中MRA具有較高的組織分辨率和多序列掃描技術,能分析斑塊負荷和組織成分,在評估斑塊穩定性中扮演重要角色。3D時間飛躍序列采用較短重復時間和回波時間、較小激發角度,輔助使用黑血技術,使血流顯示為低信號,斑塊顯示為高信號,能夠區分頸動脈的斑塊、血管管壁、血流等,且對高信號的斑塊內出血、低信號的纖維帽方面亦具有較高的價值[12-13]。黑血技術下四反轉T1加權成像、多平面雙反轉T2加權成像對管腔內血液信號抑制效果更好,是血管成像研究中廣泛使用的方法。三維磁化準備快速梯度回波序列依賴反轉恢復脈沖能很好地抑制血流信號和背景組織,對斑塊內出血的敏感性較高,可進行準確的定量測量[14]。本研究將以上序列聯合應用,發現對斑塊內出血、壞死脂核、纖維帽破裂檢出效果良好,結果顯示ACI組斑塊內出血、壞死脂核、纖維帽破裂病人占比分別為92.22%、90.00%、87.78%,高于無ACI組的6.19%、16.49%、5.15%,均與ABCD3-I評分呈正相關,且偏相關性分析顯示,校正了年齡、糖尿病、高血壓后,斑塊內出血、壞死脂核、纖維帽破裂仍與ABCD3-I評分獨立相關,可反映TIA病人并發ACI的危險度,具有作為預測征象的潛質。存在斑塊內出血、壞死脂核、纖維帽破裂病人,頸動脈粥樣硬化斑塊趨于不穩定,易受血流、情緒等影響,誘發血栓栓塞,從而導致ACI[15-16]。MRA不僅能觀察血管壁與斑塊穩定性,還能測量管壁和管腔面積,且在不同MRA醫生和MRA機型間具有良好的一致性,不易受主觀因素的影響。
最小管腔面積是評估動脈粥樣硬化病變的一個量化指標,血管面積狹窄越嚴重,斑塊負荷越大,最小管腔面積越小[17]。對同類型的血管、粥樣硬化越嚴重,管壁厚度越大[18]。顧軍等[19]報道,ACI病人最小管腔面積低于非ACI病人,最大管壁厚度高于非ACI病人,提示最小管腔面積、最大管壁厚度與ACI發病有關。本研究結果顯示,ACI組最小管腔面積小于無ACI組,最大管壁厚度大于無ACI組,與本研究結果報道相似,且在此基礎上,本研究還進行了偏相關性分析,表明校正了年齡、糖尿病、高血壓后,最小管腔面積、最大管壁厚度與TIA病人并發ACI有關,故采用頸動脈MRA檢測最小管腔面積、最大管壁厚度,有助于評估病人并發ACI的危險度。最小管腔面積反映了狹窄血管最窄區域的面積,當其到達一定程度時,可影響腦部血供,進而引起ACI;最大管壁厚度是含斑塊在內的管壁厚度,與斑塊負荷程度有關,最大管壁厚度越大,斑塊負荷程度越高。MRA為評估頸動脈狹窄程度、斑塊負荷和穩定性、高危斑塊等進行成像提供了一種有效的工具,有望降低ACI發病率及其相關的死亡率。
后續的ROC曲線顯示,狹窄程度、斑塊內出血、壞死脂核、纖維帽破裂、最小管腔面積、最大管壁厚度預測并發ACI的AUC分別為0.878,0.930,0.868,0.913,0.764,0.759,說明斑塊內出血預測價值最高,且斑塊內出血的敏感度最高,可能是斑塊內出血可引起血腫,造成斑塊進一步隆起,甚至管腔完全閉塞,導致急性供血中斷,從而誘發ACI,使其對ACI的預測敏感度最高;利用狹窄程度、斑塊內出血、壞死脂核、纖維帽破裂、最小管腔面積、最大管壁厚度6個因素建立回歸模型,繪制ROC曲線,分析顯示,6個相關因素聯合預測并發ACI的AUC為0.951,在各指標中最大,提示基于以上6個因素的聯合模型預測價值較高,可作為TIA病人并發ACI的一個預測方案,同時其預測敏感度為84.44%,特異度為89.69%,呈現出一定的預測效能,能為臨床預防性干預提供客觀的數據參考。
狹窄程度、斑塊內出血、壞死脂核、纖維帽破裂、最小管腔面積、最大管壁厚度與TIA病人短期并發ACI獨立相關,采用頸動脈MRA可檢測以上項目,從而對病人并發ACI的風險進行預測,指導臨床干預,減少ACI的發生。
參考文獻:
[1]SIKET M S,CADENA R.Novel treatments for transient ischemic attack and acute ischemic stroke[J].Emerg Med Clin North Am,2021,39(1):227-242.
[2]HACKE W,BASSAND J P,VIRDONE S,et al.Prior stroke and transient ischemic attack as risk factors for subsequent stroke in atrial fibrillation patients:a report from the GARFIELD-AF registry[J].Int J Stroke,2020,15(3):308-317.
[3]JIANG C X,ZHANG J,ZHU J B,et al.Association between coexisting intracranial artery and extracranial carotid artery atherosclerotic diseases and ipsilateral cerebral infarction:a Chinese Atherosclerosis Risk Evaluation(CARE-Ⅱ)study[J].Stroke and Vascular Neurology,2021,6(4):595-602.
[4]ZHANG J,DING S H,ZHAO H L,et al.Evaluation of chronic carotid artery occlusion by non-contrast 3D-MERGE MR vessel wall imaging:comparison with 3D-TOF-MRA,contrast-enhanced MRA,and DSA[J].European Radiology,2020,30(11):5805-5814.
[5]MORIHARA K,NAKANO T,MORI K,et al.Usefulness of rapid MR angiography using two-point Dixon for evaluating carotid and aortic plaques[J].Neuroradiology,2022,64(4):693-702.
[6]LI D Y,QIAO H Y,HAN Y J,et al.Histological validation of simultaneous non-contrast angiography and intraplaque hemorrhage imaging(SNAP)for characterizing carotid intraplaque hemorrhage[J].European Radiology,2021,31(5):3106-3115.
[7]National Institute for Health and Clinical Excellence.Stroke and transient ischaemic attack in over 16s:diagnosis and initial management[M].London:National Institute for Health and Care Excellence(NICE),2019:22.
[8]趙富強,鄭紅偉,彭曉博,等.磁共振血管成像對急性腦梗死血管病變的評估價值[J].中國CT和MRI雜志,2020,18(6):15-17.
[9]OSMANODJA F,SCHEITZ J F,FIEBACH J B,et al.Can intracranial time-of-flight-MR angiography predict extracranial carotid artery stenosis[J].J Neurol,2022,269(5):2743-2749.
[10]LI D,ZHAO H,CHEN X,et al.Identification of intraplaque haemorrhage in carotid artery by simultaneous non-contrast angiography and intraPlaque haemorrhage(SNAP)imaging:a magnetic resonance vessel wall imaging study[J].Eur Radiol,2018,28(4):1681-1686.
[11]LARSON A S,BRINJIKJI W,SAVASTANO L E,et al.Carotid intraplaque hemorrhage is associated with cardiovascular risk factors[J].Cerebrovasc Dis,2020,49(4):355-360.
[12]GWAK D S,KIM B K,CHUNG I,et al.The usefulness of Time-of-Flight MR angiography in detection of intraplaque hemorrhage in patients with acute ischemic stroke with symptomatic carotid stenosis[J].PLoS One,2020,15(2):e0229024.
[13]OGATA A,KAWASHIMA M,WAKAMIYA T,et al.Carotid artery stenosis with a high-intensity signal plaque on time-of-flight magnetic resonance angiography and association with evidence of intraplaque hypoxia[J].J Neurosurg,2017,126(6):1873-1878.
[14]ZIEGLER M,GOOD E,ENGVALL J,et al.Towards Automated Quantification of Vessel Wall Composition Using MRI[J].J Magn Reson Imaging,2020,52(3):710-719.
[15]YANG D,LIU Y,HAN Y,et al.Signal of carotid intraplaque hemorrhage on MR T1-weighted imaging:association with acute cerebral infarct[J].AJNR American Journal of Neuroradiology,2020,41(5):836-843.
[16]CUI B,YANG D,ZHENG W,et al.Plaque enhancement in multi-cerebrovascular beds associates with acute cerebral infarction[J].Acta Radiol,2021,62(1):102-112.
[17]陳彥伊,申云霞,婁明武,等.多對比動脈粥樣硬化特征序列診斷輕中度狹窄頸動脈斑塊的初步研究[J].實用放射學雜志,2020,36(9): 1402-1406.
[18]DI NAPOLI A,CHENG S F,GREGSON J,et al.Arterial spin labeling MRI in carotid stenosis:arterial transit artifacts may predict symptoms[J].Radiology,2020,297(3):652-660.
[19]顧軍,王覓,張丹鳳,等.大腦中動脈粥樣硬化性狹窄患者高分辨率磁共振成像血管壁特征與缺血性卒中風險[J].國際腦血管病雜志,2021,29(6):401-406.
(收稿日期:2022-09-28)
(本文編輯王雅潔)

