基于“證據推理與模型認知”的化學課堂教學實踐探索
李明 魯靜

電解池作為新課程“化學反應原理”的重點知識,其相關概念和原理較為抽象,需要學生結合宏觀、微觀等多個層次進行理解,具有較強的系統性和抽象性。因此,需要通過建構相關概念關系的模型以形成可視化的認知路徑去促進學生的理解、提高學生分析并解決問題的能力。該設計以電解FeCl2溶液為載體,以電解池的模型重構為主旨,依據學情設計環環相扣的探究活動,并輔以數字化實驗直觀化的展示,以期學生在解決問題的過程中建構學科知識、掌握科學方法、提升關鍵能力,為課堂上實現學生核心素養的發展做了初步探索。
一、課標與教材分析
1.課標要求
新課程標準對于“電解池”部分的內容要求為:“了解電解池的工作原理,認識電解在實現物質轉化和儲存能量中的具體應用。”而教學提示部分則細化并突出了電化學部分的教學要求,如創設真實情境,組織學生開展分析解釋、推論預測、設計評價等學習活動,加深學生對電解池工作原理的認識,轉變偏差認識,建立系統分析思路,提高學生對本質的認識。
2.教材分析
該節內容是復習人教版選擇性必修Ⅰ《化學反應原理》第四章第二節“電解池”。
從知識的角度看,該節部分將關注重點置于學生已有電解池模型的修正,提高其對電解池本質的科學認識,加強電解池模型與真實情境的有效聯系。上承原電池與電解池,有助于加深理解電化學本質,下啟金屬的腐蝕與防護,即包含電解池的應用,是分析理解電化學現象的基礎。
從方法的角度看,該部分的學習方法以實驗探究為主,承接了對于“原電池”和“電解池”的探究,且再探“電解原理”所涉及的多元化思維與方法也對后續金屬腐蝕與防護的學習具有一定的指導作用。
二、教學與評價目標
1.教學目標
(1)通過創設電解FeCl2溶液這一工業廢水處理的問題情境,分析電解過程中基本要素的變化特點,發現自身已有認知模型存在問題,并自主修正為氧化還原反應核心視角下的電解分析新模型,提高問題意識和敢于質疑的精神。
(2)通過對電解FeCl2溶液問題的解決與追問,積極探究實驗事實對理論進行證實或證偽,進一步明確電解過程中離子濃度的差異會影響離子的放電順序。
(3)通過對電解模型的修正和重構,能認識到科學的認知是不斷發展、進步的;通過離子放電能力影響因素的分析,認識到化學反應的復雜性,并能有意識地避免出現絕對化、簡單化的規律總結,明白實踐是檢驗真理的唯一標準。
2.評價目標
(1)通過對一定條件下電解FeCl2溶液的交流與點評,診斷并發展學生對于電解本質即氧化還原反應視角分析電解過程的認識水平。
(2)通過對電解FeCl2溶液陰、陽極情況的討論與點評,診斷并發展學生對于放電順序的認識水平,以及實驗探究與問題解決的能力水平。
(3)通過對已修正模型的遷移應用,診斷發展學生對重構的電解模型的認識進階和認識思路的結構化水平,以及對化學價值的認識水平。
三、教學過程
1.教學思路
教學思路如圖1所示。
2.具體教學過程
環節一:問題驅動選擇模型
[微課]通過播放微課視頻回顧電解池內容,包括電解池的反應原理、放電順序及反應類型等。
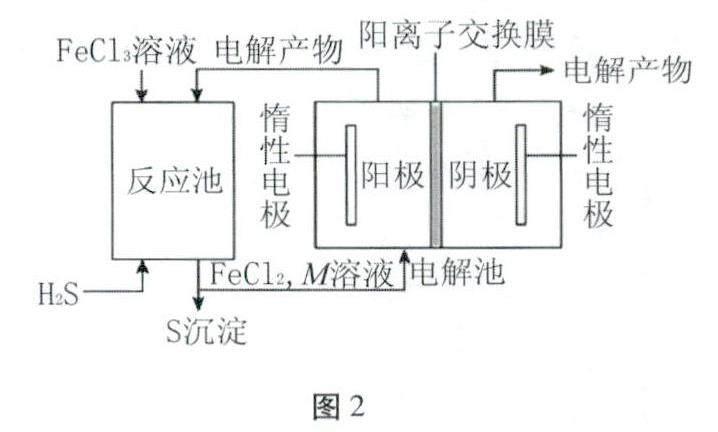
[情境創設]用FeCl3酸性溶液脫除H2S后的廢液,通過控制條件電解得以再生(如圖2所示)。
[問題1]一定條件下用石墨電極電解FeCl2溶液,可得到什么電極產物?
[設計意圖]該環節以微課展開,促進學生對于已有認知模型的調用,并嘗試以此解決后續問題,培養學生的證據推理與模型認知素養;通過高考題創設廢液再生情境,并引導學生積極思考如何解決問題,培養學生的科學態度與社會責任。
環節二:實驗探究修正模型
[過渡]同學們上述的猜想都能明確說出自己的道理,那么到底事實是如何的呢?
[問題2]基于同學們的猜想,陽極可能有哪些產物?如何驗證?
[演示實驗]用U型管盛裝一定量pH =3. 50的0.1 mol·L-1 FeCl2溶液,通過2V電壓的直流電源進行電解。一段時間無明顯現象,在陽極附近滴入KSCN溶液(考慮到Fe2+易被氧化,故選擇在陰極處也滴加等量KSCN溶液,避免因Fe2+自身氧化而帶來的顏色變化),觀察溶液顏色變化情況。
[追問1]觀察到什么現象?說明什么?
[追問2]Fe3+一定是通過放電生成的嗎?
[數字化實驗]那如何驗證呢?我們來認識一個新的實驗儀器——氯離子濃度傳感器。其可以測定一段時間內氯離子濃度的差異,通過實驗發現,氯離子濃度無明顯變化。
[總結]結合前期現象及傳感器數據,最終確定陽極的產物為Fe3+。
[設問]電解產物的結果唯一嗎?下面請看實驗(增加原演示實驗的電壓)。
[解釋說明]播放后續視頻,隨著電壓的增強,陽極開始有氣泡產生,且通過濕潤的淀粉碘化鉀試紙檢驗為氯氣。即在電壓的影響下,氯氣是可以生成的,這可能是因為電壓的增強一方面提高了放電離子的遷移速率,另一方面也提高了氯離子的失電子能力。
[追問3]如何解釋對應產物的生成?
[評價]對于正確思路給予肯定評價,鞏固學生這一認識;對于可能有學生提及“異性相吸原理”,及時以陽極現象作為引導,轉變學生的錯誤觀念。
[總結]通過以上實驗探究,充分體現電極上離子的放電順序不是絕對的或唯一的,應從氧化還原反應視角,即微粒的得失電子能力去分析電解放電過程。
[問題3]通過對陽極的分析,陰極應該有哪些產物,先得到什么?如何驗證?
[學生]可能是Fe2+被還原成Fe,可以選擇將其置于稀鹽酸中,觀察是否有氣泡產生;也可能是水電離出的H+被還原成H2。
[演示實驗]回到剛剛的電解實驗,用U型管盛裝一定量pH=3.50的0.1mol·L-1 FeCl2溶液,通過2V電壓的直流電源進行電解。
[追問1]觀察到什么現象?說明什么?
[學生]觀察到先產生微弱的金屬光澤,且將陰極石墨置于稀鹽酸中,有大量氣泡產生。
[解釋說明]根據分析,應該有體系中的H+先放電。但我們知道,當溶液中只有H+和一些金屬離子時,體系中濃度較大位于氫前面不遠的金屬(如Zn、Fe等)離子能夠先放電。如在這一體系下,Fe2+濃度為10-1mol·L-1,而H+僅為10-3.5mol·L-1,離子濃度具有較大差異,故Fe2+優先放電。換句話說,離子濃度也會影響離子在電極的放電順序。
[輔助實驗]同時,配合pH=1.00時的實驗現象,可以看到這一體系一通電即有大量氣泡產生,充分論證這一結論,即電解過程中的放電順序受離子濃度的影響。
[歸納總結]總結電解FeCl2溶液所解決的核心問題及其結論。
[設計意圖]這一環節為該節課的核心環節,通過陰、陽極分析層層遞進地探究,由實驗現象引發認知沖突,再由實驗現象分析驗證,在結合數字化實驗逐步推理的過程中,培養學生的證據推理與模型認知、科學探究與創新意識等素養。
環節三:系統分析完善模型
[情境回歸]回歸電解FeCl2溶液的廢液再生情境,呈現相應的結果。再次強調離子濃度對于放電順序的影響。
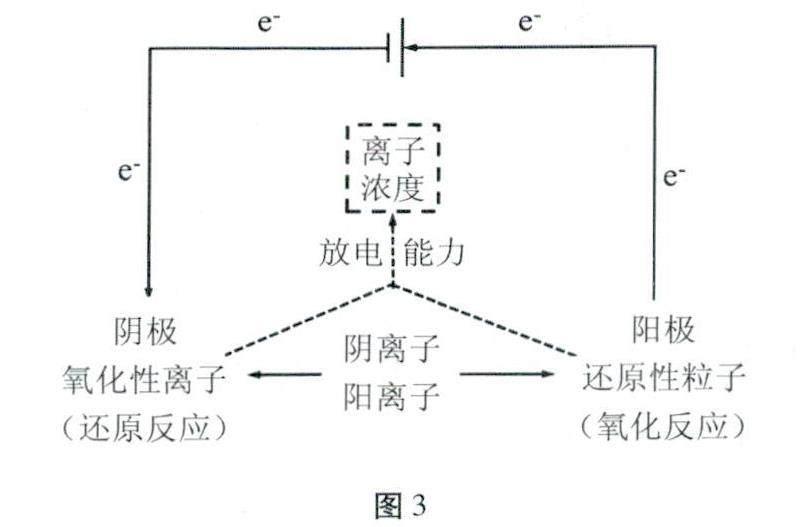
[問題4]通過本節課的學習,相信很多同學都對于電解池有r不一樣的認識,那么現在大家能否重構電解模型呢?
[學生討論與交流]畫出自己目前所認知的電解模型。
[評價]通過畫出電解模型(如圖3所示)的方式,外顯學生修正后的認知模型并進行適當評價。
[設計意圖]診斷學生該節課的思維發展情況,通過畫圖外顯學生的認知模型,并及時評價,真正意義上完善模型,充分完成模型的重構,關注課堂生成的意義,發展學生的核心素養。
環節四:情境創設應用模型
[過渡]接著,我們來應用這一模型解決一些日常生產生活中的問題。
[情境1]氯堿工業——電解飽和食鹽水
[問題5]工業上為什么選用飽和食鹽水電解制備Cl2?稀溶液是否可以?
[學生]考慮到離子濃度對于放電順序的影響,不可以。
[追問]如何影響?
[解釋說明]主要關注陽極失電子的兩大還原性粒子,即Cl-和OH-的失電子能力比較。當氯離子濃度足夠大時,其可以在陽極先放電。
[情境2]工業鍍鋅和電解制備Ca(H2PO4)2
[學生]基于該節課內容,遷移教師分析飽和食鹽水的思路,自主從氧化還原反應視角分析能夠得失電子的離子,及其放電順序較為特別的原因,關注陰極的兩大氧化性粒子,即H+與Zn2+的比較。
[總結升華]當然,影響電解放電順序的因素還有很多,我們后續可以繼續拓展,也正因如此,才讓電解真正融入到了我們的日常生活生產中,為人類所用。
[設計意圖]該環節圍繞3個非常重要的問題情境展開,前2個對于學生來說是非常熟悉但卻很少深究的情境,此處將其呈現并要求學生自主交流、深入分析,能夠有效促進學生認知模型的進階化發展,對于學生證據推理與模型認知、科學態度與社會責任素養的培養具有重大意義。電解制備Ca(H2PO4)2的出現則是在綜合應用已有認知模型,突出膜電極的基礎上,充分培養學生系統分析的思維。并通過關注電化學與生產、生活的聯系,培養學生的科學態度與社會責任。
(收稿日期:2023-10-15)

