例析氫氧化鈉變質的檢驗方法
錢曉芳

一、變質的來由
如果氫氧化鈉溶液(固體)敞口放置于空氣中,則易與空氣中的二氧化碳反應,生成了碳酸鈉和水導致其部分或全部變質。
二、變質的檢驗方法
取少量樣品于試管中,滴足量稀鹽酸,如產生氣泡,已變質;無明顯現象,則未變質。取少量樣品于試管中,滴加氫氧化鈣溶液,如果產生白色沉淀,則已變質。或取少量樣品于試管中,滴加氯化鈣溶液,如產生白色沉淀,則已變質。
例題1 實驗室有一瓶長時間存放的氫氧化鈉,小明懷疑可能變質了。小明要通過實驗檢驗該氫氧化鈉是否變質。
[提出問題]氫氧化鈉變質了嗎?若變質,是全部變質還是部分變質?
[建立假設]氫氧化鈉已經變質。
[資料查詢]氯化鈣溶液顯中性。
[設計實驗]取少量氫氧化鈉樣品于試管中,加水溶解得到溶液,進行表1所列操作。
回答下列問題:根據步驟Ⅰ的現象獲得的結論是否正確?____(填“是”或“否”),理由是____;步驟Ⅱ的結論是否正確?____(填“是”或“否”),反應的化學方程式是____。
[獲得結論]根據以上步驟的實驗現象,最終,你認為假設____(填“成立”或“不成立”)。小明要進一步探究氫氧化鈉的變質程度:另取少量溶液于試管中,滴加氯化鈣溶液,至不再產生沉淀,過濾,向濾液中滴加酚酞試液,發現溶液變紅色。根據以上操作現象確定,氫氧化鈉是____(填“全部”、“部分”)變質。
[反思與評價]氫氧化鈉容易跟空氣中的二氧化碳發生反應,也能吸收空氣中的水分,所以保存氫氧化鈉時需要____。
解析 [設計實驗]氫氧化鈉在空氣中會與二氧化碳反應生成碳酸鈉和水,碳酸鈉溶液與氫氧化鈉溶液均為堿性溶液,滴加酚酞變紅不能證明溶液中只有氫氧化鈉,藥品未變質;稀鹽酸能與碳酸鈉反因生成二氧化碳、水和氯化鈉,氫氧化鈉與稀鹽酸反應不產生氣泡。
[獲得結論]從產生氣泡的現象可知,氫氧化鈉已經變質;氯化鈣能與碳酸鈉反應生成碳酸鈣沉淀和中性的氯化鈉溶液,溶液仍呈堿性,說明除碳酸鈉以后還有氫氧化鈉,說明氫氧化鈉部分變質。
[反思與評價]氫氧化鈉會與空氣中二氧化碳反應,所以保存時要密封。
答案:[設計實驗]否;碳酸鈉溶液也能使酚酞試液變紅;是;2HCl+Na2CO3=2NaCl+H2O+CO↑
[獲得結淪]成立;部分
[反思與評價]密封
三、變質程度的檢驗
取少量樣品于試管中,滴加足量的CaCl2溶液,有白色沉淀生成;過濾,向濾液中滴加酚酞溶液,如果溶液變紅色,說明溶液部分變質;如果溶液呈無色,說明完全變質。
例題2 分析久置的氫氧化鈉固體藥品的成分:
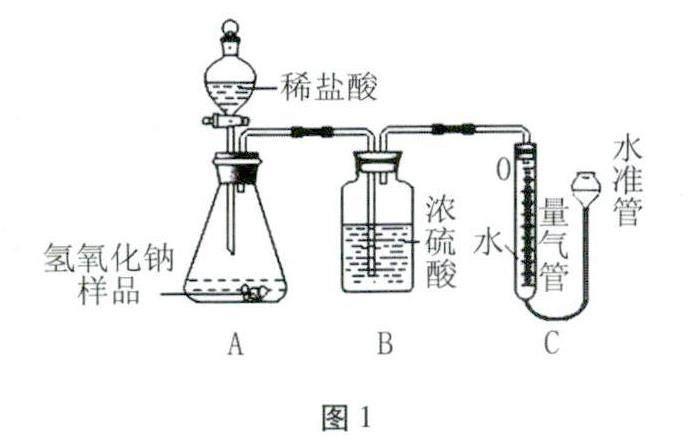
方案一 稱取2g氫氧化鈉樣品與足量稀鹽酸反應,按如圖1所示裝置通過測定產生二氧化碳的量來判斷氫氧化鈉的變質程度。通過討論同學們認為這套裝置測定的二氧化碳量不準確,改進的方法是____。
小明提出產生的二氧化碳有部分殘留在裝置中不能完全進入量氣管,從而使測定氫氧化鈉的二氧化碳不準確,你是否同意他的觀點____。
方案二 稱取ag氫氧化鈉樣品放入試管中,加蒸餾水完全溶解,然后滴加足量的BaCl2溶液,若氫氧化鈉部分變質,則產生沉淀的質量b的范圍是____。
解答 方案一 二氧化碳能溶于水,用該裝置測定二氧化碳產生的量不準確,故可以在量氣管的液面上倒入少量植物油,防止二氧化碳溶于水,測量更準確。
實驗裝置中原來有空氣,產生的二氧化碳使裝置內壓強增大,把水壓入水準管,量氣管測出氣體增加的體積即生成的二氧化碳氣體的體積,故二氧化碳有部分殘留在裝置中不影響測量。
方案二 設ag氫氧化鈉完全變質生成碳酸鈉的質量為x。
CO2+2NaOH=Na2CO3+H2O
80 106
ag x
80: 106 =a g:x,x=106a/80 g
設碳酸鈉和氯化鋇反應生成碳酸鋇的質量y。
BaCl2+Na2CO3 =BaCO3↓+2NaCl
106 197
106a/80g y
106: 197=106a/80g:y,y=197a/80g
則碳酸鈉的質量為106a/80 g;碳酸鋇的質量為197a/80g,因氫氧化鈉部分變質,所以生成的沉淀的質量6小于197a/80g,故6的范圍:0 g
答案:方案一:在量氣管的液面上倒入少量植物油;不同意;方案二:0 g
(收稿日期:2023-10-15)

