基于思維模型構建的高三電化學復習難點突破策略
馮美紅
電化學是氧化還原反應原理的重要應用之一,高三學生在復習過程中,往往容易將原電池和電解池中相似的知識點混淆,相關復習難點突破策略列舉如下。
一、打通原電池與電解池原理的隔閡
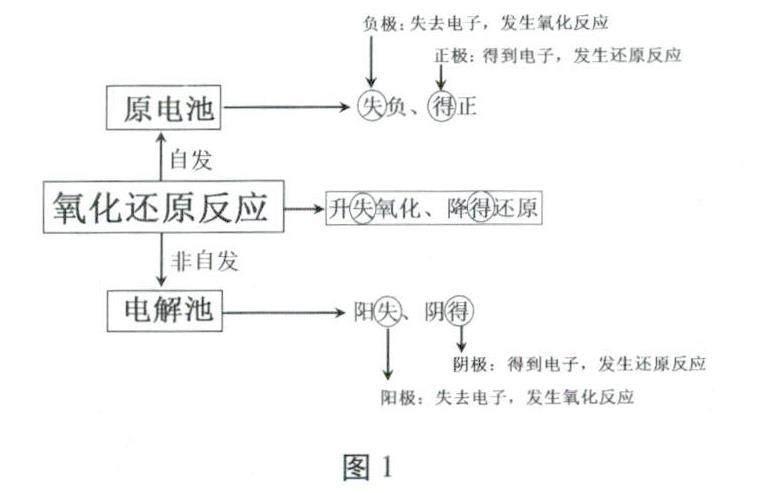
學生在高一學段已經(jīng)獲得“氧化還原反應”這一知識模型,并將其內(nèi)涵總結為“升失氧化、降得還原”;在高二學段則存化學反應與能量的相互轉(zhuǎn)化章節(jié)中分開學習了原電池和電解池知識,復習過程中若不能將新舊知識進行有效整合(如圖1所示),則容易引起思維的混亂。
二、從微觀角度探析池中離子移動方向問題
1.電子的移動方向
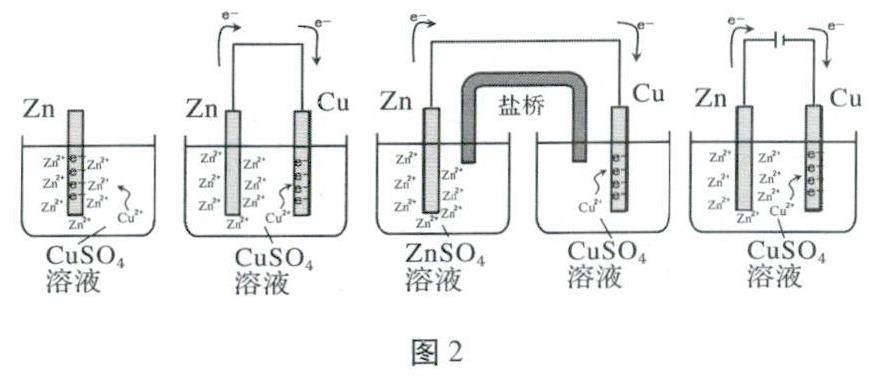
以鋅銅電池為例,根據(jù)電化學的基本原理,電子從負極或陽極流出,最終進入正極或陰極,如圖2所示:可以認為電子“布滿”了正極或陰極(即本例中的Cu電極),Cu2-則移向電子“布滿”的電極附近并得到電子變成Cu附著。因此,只要認準電子流入的電極,即可快速判斷發(fā)生還原反應的電極。
對比前兩個圖,也可以理解形成原電池可以加快反應速率的原因:Zn電極失去電子后形成Zn2+進入溶液中,若未構建原電池形成的基本條件——閉合同路,則電子依然聚集在Zn電極上,因此Cu2+需要克服Zn2+的排斥才能“艱難”得到電子;而有不同電極和閉合回路后,電子沿著導線從負極出發(fā),移動到正極,Cu2+更容易從正極上得到電子,宏觀上體現(xiàn)出來的就是反應速率加快。
2.離子的移動方向
在理清電子移動的基礎上,只要結合物理上帶電微粒的相互作用原理——“同性相斥、異性相吸”就可以簡單判斷。結合化學學科知識,離子移動方向的分為以下3類情況:
思維模型Ⅰ:離子參與某電極反應——移動到該電極
中學各版本教材中的“鉛蓄電池”就是典型例子,放電時正負極分別為:
負極:Pb+ SO42- - 2e =PbSO4
正極:PbO2+4H++SO42- +2e=PbSO4 +2H2O
由電極反應式可知,SO42-均參與正負反應,則應移動到這兩個電極附近。
思維模型Ⅱ:離子不參與電極反應——被電子吸引或排斥
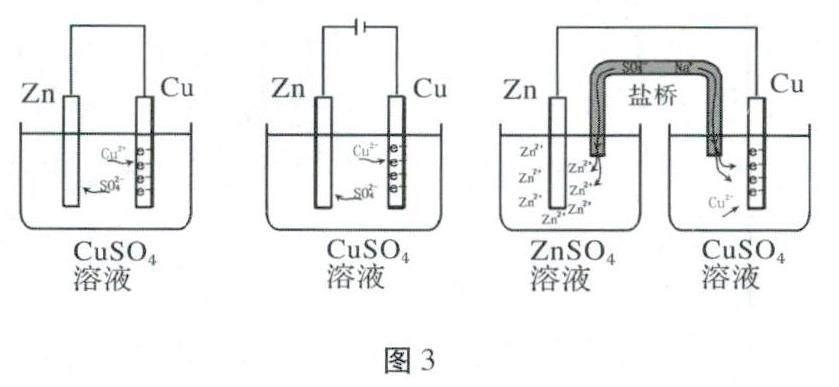
電化學中的“閉合回路”由2部分組成——電子在電極、導線上的定向移動和電解質(zhì)溶液中陰陽離子的定向移動。因此,未參與電極反應的離子的定向移動有著重要的意義,甚至為了增強溶液的導電性,會加入一些“無關”離子。判斷這類離子的移動的方向,關鍵在于看“電子在哪里?”與電子帶同種電荷的陰離子會被電子排斥,遠離電子;和電子帶異種電荷的陽離子則被吸引而朝電子方向移動。鹽橋中的離子用于維持溶液的電中性,也可以用這種方法來判斷,如圖3所示。
思維模型Ⅲ:含“膜”的裝置中離子移動方向
為了避免副反應、限定某些離子的移動,電化學中常會涉及各種離子交換膜、雙極膜等,能選擇性地允許離子通過,起到平衡電荷、形成閉合回路的作用,解題過程中往往需要根據(jù)離子的移動方向來判斷膜的種類。例如,電滲析法淡化海水的裝置如圖4所示。電解槽中陰離子交換膜和陽離子交換膜相間排列,將電解槽分隔成多個獨立的間隔室,海水充滿在各個間隔室中。通電后,一個間隔室的海水被淡化,而其相鄰間隔室的海水被濃縮,從而實現(xiàn)了淡水和濃縮海水分離,電解結果如圖5所示。
三、復雜電極反應式的書寫
對于復雜的電極,尤其是鋰離子電池、有機物參與的電極反應,元素價態(tài)較難判斷,可結合原子守恒、電荷守恒用“待定系數(shù)一配平法”來解決。
大多數(shù)鋰離子電池基于電化學“嵌入/脫嵌”反應原理,替代了傳統(tǒng)的“氧化還原反應”,其原理類似“濃差電池”,即在兩極形成的電壓的驅(qū)動下,Li+可以從電極材料提供的“空間”中“嵌入”或“脫嵌”。鋰離子電池的正極材料一般為含Li+的化合物,已商業(yè)化的正極材料有LiFePO4、LiCoO2、LiMn2O4等。
例題1 某品牌全電動汽車使用的是鈷酸鋰(LiCoO2)電池,其工作原理如圖6所示,A極材料是金屬鋰和碳的復合材料(碳作為金屬鋰的載體),電解質(zhì)為一種能傳導Li+的高分子材料,隔膜只允許特定的離子通過,電池反應為:
電極反應式的書寫思維模型:
第1步,根據(jù)總反應明確電極反應前后物質(zhì)的變化,初步寫出兩極對應產(chǎn)物:

