lncRNASLC9A3-AS1在肝細胞癌中的臨床意義及生物學功能分析
蒲俊霞 史俊豪 單杰 鄧益斌
【摘要】目的探討lncRNASLC9A3-AS1在肝細胞癌(HCC)中的表達意義和其參與HCC發生發展的潛在作用機制。
方法收集37例HCC組織及其配對癌旁組織,以及HCC細胞RNA,利用qRT-PCR檢測lncRNASLC9A3-AS1在組織和細胞中的表達水平,并分析其與患者臨床病理特征的關系。繪制lncRNASLC9A3-AS1的受試者工作特征(ROC)曲線,分析其對HCC的診斷效能。通過生物信息學方法篩選與lncRNASLC9A3-AS1結合的RNA結合蛋白,并繪制韋恩圖,分析lncRNASLC9A3-AS1與結合蛋白表達的相關性,以及蛋白表達與HCC病理分期和患者生存預后的關系。
結果lncRNASLC9A3-AS1在HCC組織和細胞中表達下調,其表達水平與患者血清甲胎蛋白(AFP)水平明顯相關(P<0.05)。lncRNASLC9A3-AS1的ROC曲線下面積(AUC)為0.849(95%CI:0.796~0.886)。韋恩圖顯示5個與lncRNASLC9A3-AS1潛在結合的蛋白:hnRNPA1、YTHDC1、RBM4、NONO和RBMx,其表達與lncRNASLC9A3-AS1表達呈明顯正相關(P<0.05)。隨著HCC分期的進展,不同分期的RNA結合蛋白表達量差異有統計學意義(P<0.05);RBM4、NONO和RBMx低表達患者總體生存期明顯長于高表達患者(P<0.05)。
結論lncRNASLC9A3-AS1在HCC中下調,有望作為HCC診斷的生物標志物,并且可能通過與RNA結合蛋白互作調控HCC進展。
【關鍵詞】lncRNASLC9A3-AS1;肝細胞癌;診斷標志物;RNA結合蛋白
中圖分類號:R735.7文獻標志碼:ADOI:10.3969/j.issn.1003-1383.2024.05.001
AnalysisofclinicalvalueandbiologicalfunctionoflncRNASLC9A3-AS1inhepatocellularcarcinoma
PUJunxia1,2,SHIJunhao2,SHANJie2,DENGYibin1,3
(1.MedicalLaboratoryCenter,theAffiliatedHospitalofYoujiangMedicalUniversityforNationalities,Baise533000,
Guangxi,China;2.GraduateSchool,YoujiangMedicalUniversityforNationalities,Baise533000,Guangxi,China;
3.KeyLaboratoryofClinicalMolecularDiagnosisResearchforDiseaseswithHighIncidenceofWestern
GuangxiinGuangxiHigherEducationInstitutes,Baise533000,Guangxi,China)
【Abstract】ObjectiveToexploretheclinicalapplicationvalueoflongnon-codingRNAs(lncRNA)SLC9A3-AS1inhepatocellularcarcinoma(HCC)anditspotentialmechanisminvolvedintheoccurrenceanddevelopmentofHCC.
Methods37casesofHCCtissuesandtheirpairedparacanceroustissues,aswellasHCCcellRNA,werecollected.qRT-PCRwasusedtodetecttheexpressionlevelsoflncRNASLC9A3-AS1intissuesandcells,anditsrelationshipwiththeclinicopathologicalcharacteristicsofpatientswasanalyzed.Areceiveroperatingcharacteristic(ROC)curvewasgeneratedtoassessthediagnosticefficacyoflncRNASLC9A3-AS1forHCC.BioinformaticsmethodswereutilizedtoidentifyRNA-bindingproteinsthatinteractedwithlncRNASLC9A3-AS1,andVenndiagramwasdrewtoanalyzecorrelationbetweenlncRNASLC9A3-AS1andbindingproteinexpression,aswellasrelationshipbetweenproteinexpressionandHCCpathologicalstagingandpatientsurvivalprognosis.
ResultsTheexpressionoflncRNASLC9A3-AS1wasdown-regulatedinHCCtissuesandcells,anditsexpressionlevelwassignificantlyassociatedwithpatients'serumalpha-fetoprotein(AFP)levels(P<0.05).TheROCareaunderthecurve(AUC)oflncRNASLC9A3-AS1was0.849(95%CI:0.796-0.886).TheVenndiagramshowed5proteinspotentiallybindingtolncRNASLC9A3-AS1:hnRNPA1,YTHDC1,RBM4,NONO,andRBMx,andtheirexpressionsshowedasignificantpositivecorrelationwiththeexpressionoflncRNASLC9A3-AS1(P<0.05).WiththeprogressionofHCCstaging,therewasastatisticallysignificantdifferenceinRNAbindingproteinexpressionlevelsamongdifferentstages(P<0.05).TheoverallsurvivaltimeofpatientswithlowexpressionsofRBM4,NONO,andRBMxwassignificantlylongerthanthatofpatientswithhighexpressions(P<0.05).
ConclusionLncRNASLC9A3-AS1isdown-regulatedinHCCandisexpectedtoserveasabiomarkerforthediagnosisofHCC,andmayregulateHCCprogressionbyinteractingwithRNA-bindingproteins.
【Keywords】lncRNASLC9A3-AS1;hepatocellularcarcinoma(HCC);diagnosticmarker;RNA-bindingproteins
肝癌在全球范圍內發病率居前列,是常見的致命癌癥之一[1]。在我國,原發性肝癌是第五位常見惡性腫瘤和第二死因,主要由慢性病毒性肝炎、酒精性肝炎、非酒精性肝炎和肝硬化等疾病導致,造成了嚴重的健康問題,需要加強預防和治療;肝細胞癌(hepatocellularcarcinoma,HCC)是原發性肝癌的主要病理類型,其所占比例最高(85%~90%)[2-3]。由于疾病復雜、發展迅速、術后復發率高,嚴重影響了患者生存[4-5]。因此,研究HCC發生發展的分子機制對肝癌的診療具有重大意義。
長鏈非編碼RNA(longnon-codingRNAs,lncRNAs)是一類保守性差且不能編碼完整的蛋白質的RNA,可通過內源競爭RNA(competingendogenousRNAs,ceRNAs)機制、表觀遺傳修飾、自噬和調節免疫微環境等多種途徑調控癌細胞增殖、轉移、侵襲、凋亡、上皮間質轉化等生物學行為,從而調控腫瘤的發生[6-8]。lncRNAs在細胞中的定位影響了lncRNAs的作用模式,而定位于細胞核中的lncRNAs多數與蛋白質相互作用[9]。lncRNASLC9A3-AS1位于5號染色體短臂上,已被證實可以通過競爭結合miR-486-5p促進鼻咽癌的發生發展,且SLC9A3-AS1表達與肺癌患者生存預后相關,其能海綿吸附miR-760增強非小細胞肺癌的發展[10-11]。但SLC9A3-AS1在HCC中的臨床應用價值和作用機制尚未見研究報道。因此,本研究旨在分析SLC9A3-AS1在HCC中的表達及臨床意義,并探討其參與調控HCC的潛在分子機制,為HCC的診斷提供新思路。
1材料與方法
1.1實驗材料
1.1.1組織標本與臨床資料收集
收集2020年12月—2023年5月于右江民族醫學院附屬醫院行手術切除患者HCC組織及其癌旁組織(距腫瘤邊緣<2cm)各37例。組織納入標準:(1)手術前影像檢查診斷為肝癌,手術切除后樣本病理學鑒定診斷為HCC;(2)術前未接受任何放化療等相關治療。排除標準:(1)患者術前接受放化療等相關治療;(2)術后經病理學診斷為良性腫瘤或合并其他部位惡性腫瘤;(3)其他類型腫瘤轉移到肝形成的轉移性癌。同時收集患者的臨床病理資料,包括年齡(29~75歲,中位年齡47歲)、性別(男33例、女4例)、血清HBsAg和甲胎蛋白(AFP)水平、肝硬化病史、腫瘤大小和數量及T分期情況。納入研究的全部患者均簽署了知情同意書。標本的獲取和患者臨床病理資料的收集均已經獲得右江民族醫學院附屬醫院醫學倫理委員會批準(協議代碼:YYFY-LL-2018-112)。
1.1.2實驗試劑
胎牛血清(浙江天杭生物科技股份有限公司)、DMEM基礎培養基(美國Gibco)、青鏈霉素雙抗溶液(北京索萊寶科技有限公司)、胰酶(北京索萊寶科技有限公司)、細胞核質分離試劑盒[英文特生物技術(北京)有限公司]、TRIzol試劑(美國賽默飛公司)、賽默飛逆轉錄試劑盒、SYBRGreenMastermix(上海翊圣生物科技有限公司)、引物[生工生物工程(上海)股份有限公司]、內參GAPDH和U6[生工生物工程(上海)股份有限公司]。
1.2細胞培養
人肝癌細胞MHCC97H、HepG2和正常肝細胞LO2購買自廣州賽庫生物科技有限公司和武漢普諾賽生命科技有限公司。在37℃,含5%CO2的細胞培養箱中,用含10%胎牛血清和1%雙抗的完全培養基培養細胞。
1.3實時熒光定量PCR(qRT-PCR)
利用TRIzol試劑提取細胞和組織總RNA。采用逆轉錄試劑逆轉錄得到cDNA,并以cDNA為模板,用SYBRGreenMastermix配制反應體系,在LightCycler?倕96(瑞士Roche)儀器上對lncRNASLC9A3-AS1進行擴增。擴增條件:95℃,5min;95℃,10s;60℃,30s;40個循環。擴增結束后,按照公式2?傆bCT計算基因相對表達量。實驗引物序列見表1。
1.4分析lncRNASLC9A3-AS1表達與HCC患者臨床病理特征的關系
采用qRT-PCR檢測HCC和癌旁組織中的SLC9A3-AS1表達,并以其在HCC組織中的相對表達量的中位數為分界值,將高于分界值的作為高表達組、低于分界值為低表達組,分析其表達與患者臨床病理特征的關系。
1.5lncRNASLC9A3-AS1的ROC曲線分析
從TCGA數據庫(https://cancergenome.nih.gov/)中下載肝細胞癌(LIHC)數據集,通過R4.1.2軟件提取374例肝細胞癌和50例正常肝組織樣本中lncRNASLC9A3-AS1的表達量,利用pROC包繪制受試者工作特征(receiveroperatingcharacteristic,ROC)曲線。
1.6數據庫預測與lncRNASLC9A3-AS1互作的RNA結合蛋白
根據購買自英文特生物技術(北京)有限公司的細胞核質分離試劑盒說明書分離細胞質和細胞核后,TRIzol試劑提取RNA,采用qRT-PCR檢測SLC9A3-AS1在細胞中的分布。通過ENCORI數據庫(starBase3.0;http://starbase.sysu.edu.cn/)、RBPDB數據庫(http://rbpdb.ccbr.utoronto.ca/)和catPAPID數據庫(http://s.tartaglialab.com/page/catrapid_group)預測可能與SLC9A3-AS1結合的RNA結合蛋白(RNA-bindingproteins,RBPs)。在DrawVennDiagram在線繪圖工具(http://bioinformatics.psb.ugent.be/webtools/Venn/)上對預測結果取交集并制作韋恩圖,篩選蛋白。
1.7肝細胞癌中SLC9A3-AS1與蛋白表達的相關性分析
選擇ENCORI數據庫中的“RNA-RNACoExpression”模塊,分析TCGA-LIHC數據中SLC9A3-AS1表達與RBP表達的相關性。
1.8蛋白表達與肝癌臨床病理分期和患者生存預后的關系分析
選擇GEPIA(http://gepia.cancer-pku.cn)數據庫中“ExpressionDIY”的“stage”和“Survival”模塊,并選擇LIHC數據集,分析基因表達水平與腫瘤分期和患者總體生存期的關系。
1.9統計學方法
采用R軟件、SPSS26.0和GraphPadPrism9軟件進行數據統計分析與作圖。計量資料用均數±標準差(±s)表示。采用配對Wilcoxon符號秩檢驗對lncRNASLC9A3-AS1在肝細胞癌及其癌旁組織的表達進行統計分析。采用Fisher確切概率法統計分析SLC9A3-AS1水平與肝細胞癌患者臨床病理特征之間的關系。檢驗水準:α=0.05,雙側檢驗。
2結果
2.1SLC9A3-AS1表達與HCC患者臨床病理特征的關系
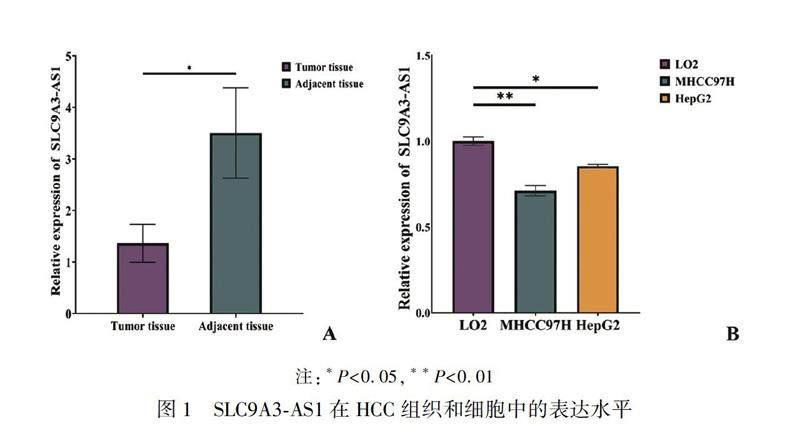
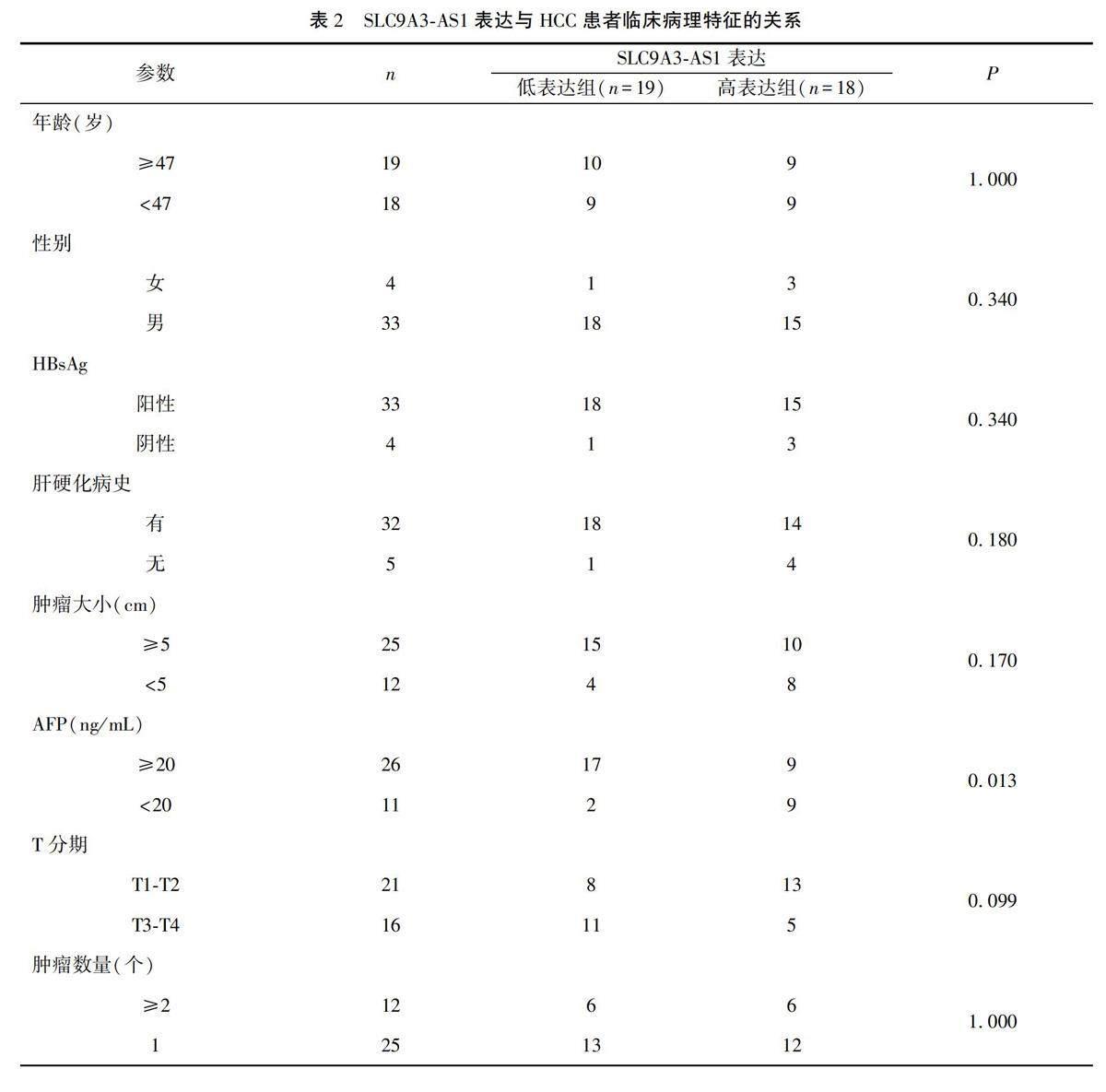
qRT-PCR檢測結果顯示,HCC組織中的SLC9A3-AS1表達水平低于癌旁組織(P<0.05)(圖1A);與LO2細胞相比,在MHCC97H和HepG2細胞中,SLC9A3-AS1表達下調(P<0.05或0.01)(圖1B)。根據HCC組織中SLC9A3-AS1的相對表達量中位數,將SLC9A3-AS1分為高表達組和低表達組,分析其與患者臨床病理特征的關系,結果顯示,SLC9A3-AS1表達水平與HCC患者年齡、性別、肝硬化病史、腫瘤大小及數量和T分期等臨床病理參數差異無統計學意義(P>0.05),但與血清AFP水平明顯相關(P<0.05)。見表2。
2.2lncRNASLC9A3-AS1對HCC的診斷效能
ROC曲線分析結果顯示,HCC組織中SLC9A3-AS1ROC的曲線下面積(AUC)為0.849(95%CI:0.796~0.886)(圖2)。
2.3篩選SLC9A3-AS1的潛在RNA結合蛋白
細胞核質分離后,qRT-PCR檢測結果顯示,SLC9A3-AS1分布于MHCC97H和HepG2細胞的細胞核(約90%)和細胞質(約10%)(圖3A)。韋恩圖結果顯示,Starbase數據庫、RBPDB數據庫和catPAPID數據庫預測結果中與SLC9A3-AS1潛在結合的RBPs分別有:81個、19個和2064個,取交集后獲得5個RBP:hnRNPA1、YTHDC1、RBM4、NONO、RBMx(圖3B)。
2.4SLC9A3-AS1與RNA結合蛋白的相關性分析
相關性分析結果顯示,在374例LIHC組織中的hnRNPA1、YTHDC1、RBM4、NONO和RBMx表達水平與SLC9A3-AS1表達呈正相關(均P<0.05)(圖4A-E)。
2.5RNA結合蛋白與肝細胞癌臨床病理分期和患者生存預后的關系
GEPIA數據庫中RNA結合蛋白表達與腫瘤病理分期關系的結果顯示,隨著肝細胞癌分期的進展,hnRNPA1[F=4.54,Pr(>F)=0.004]、YTHDC1[F=3.57,Pr(>F)=0.014]、RBM4[F=3.09,Pr(>F)=0.027]、NONO[F=5,Pr(>F)=0.002]和RBMx[F=5.62,Pr(>F)=0.001]在不同分期之間的表達量差異均有統計學意義(P<0.05)(圖5A-E)。生存分析結果顯示,其中hnRNPA1、YTHDC1表達與患者總體生存期差異無統計學意義(P>0.05)。RBM4、NONO、RBMx低表達患者總體生存期明顯長于高表達患者(均P<0.05)(圖6A-E)。
3討論
肝癌的發病率在全球范圍內仍保持持續增長[12]。由于肝癌發現和診斷較晚,且發病機制復雜,給治療帶來了相當大的困難。因此,尋找有效診斷和治療措施,是目前肝癌研究亟待解決的關鍵問題。lncRNAs廣泛參與了肝癌的發生發展過程。lncRNA通過與染色質相互作用、作為轉錄復合物的支架或影響轉錄因子的募集來調節轉錄過程[13]。通過調控自噬相關基因的表達和激活細胞保護性自噬等方式促進或抑制HCC細胞的自噬[14-15]。也可作為ceRNA分子或者與RBP互作調控HCC細胞增殖、侵襲、遷移和上皮-間質轉化等生物學行為[16-18]。既往研究表明,lncRNASLC9A3-AS1可作為預后預測因子,海綿吸附miR-760增強非小細胞肺癌的發展[11];也可通過競爭結合miR-486-5p來提高E2F6表達從而促進鼻咽癌的發生發展[10],然而,lncRNASLC9A3-AS1在HCC中的臨床價值以及參與其發生發展過程的分子機制仍待進一步研究。
本研究通過分析SLC9A3-AS1在37例HCC組織及配對癌旁組織中的表達及其與患者臨床病理特征之間的關系,發現HCC組織中SLC9A3-AS1表達下調,且SLC9A3-AS1表達與患者血清AFP水平明顯相關;ROC曲線分析結果表明SLC9A3-AS1對HCC具有良好的診斷價值。以上結果提示SLC9A3-AS1可能成為HCC診斷的有效靶標。另外,研究結果顯示SLC9A3-AS1主要分布于HCC細胞的細胞核中,提示SLC9A3-AS1可能通過與蛋白質相互結合發揮生物學作用。RBPs在多種癌癥中異常表達,參與基因表達的轉錄后調控以及細胞分化和代謝等重要細胞過程,RNA-RBP相互作用的失調通常是癌癥等疾病發生的重要原因[19]。結合蛋白IGF2BP2和EIF4A3等能與非編碼RNA相互結合形成復合體調節mRNA的穩定性,分別抑制肺腺癌和促進食管鱗癌的發生發展[20-21]。因此,本研究進一步探討了SLC9A3-AS1參與HCC發生發展的潛在分子機制。基于生物信息學數據庫篩選出與SLC9A3-AS1結合的RBP:hnRNPA1、YTHDC1、RBM4、NONO和RBMx,且相關性分析結果顯示SLC9A3-AS1表達與以上蛋白表達均呈正相關。hnRNPA1、YTHDC1、NONO、RBM4和RBMx等結合蛋白,可通過調控肝癌細胞轉移、增殖、遷移、侵襲、血管生成能力和細胞代謝等調節肝癌的發生發展[22-26]。最后,本研究通過分析hnRNPA1、YTHDC1、RBM4、NONO、RBMx表達與HCC病理分期和患者生存預后的關系,發現隨著HCC分期的進展,hnRNPA1、YTHDC1、RBM4、NONO、RBMx的表達明顯升高;RBM4、NONO、RBMx低表達患者總體生存期明顯長于高表達患者。提示SLC9A3-AS1與RBP相互作用可能作為調控HCC進展的重要分子機制,為HCC的診療提供了新思路。但本研究尚未驗證RBP在HCC組織中的表達水平,因此,后續研究將進一步驗證RBP在收集的HCC組織中的表達以及探究它們在HCC發生發展中的具體作用機制。
綜上所述,lncRNASLC9A3-AS1在HCC中低表達,有望成為HCC診斷的潛在生物標志物。
參考文獻
[1]SUNGH,FERLAYJ,SIEGELRL,etal.Globalcancerstatistics2020:GLOBOCANestimatesofincidenceandmortalityworldwidefor36cancersin185countries[J].CACancerJClin,2021,71(3):209-249.
[2]CAOW,CHENHD,YUYW,etal.ChangingprofilesofcancerburdenworldwideandinChina:asecondaryanalysisoftheglobalcancerstatistics2020[J].ChinMedJ,2021,134(7):783-791.
[3]中華預防醫學會肝膽胰疾病預防與控制專業委員會,中國研究型醫院學會肝病專業委員會,中華醫學會肝病學分會,等.原發性肝癌的分層篩查與監測指南(2020版)[J].中華肝膽外科雜志,2021,27(1):12-29.
[4]DOPAZOC,SREIDEK,RANGELOVAE,etal.Hepatocellularcarcinoma[J].EurJSurgOncol,2024,50(1):107313.
[5]MALUCCIOM,COVEYA.Recentprogressinunderstanding,diagnosing,andtreatinghepatocellularcarcinoma[J].CACancerJClin,2012,62(6):394-399.
[6]SMITHAG,MACLEODKF.Autophagy,cancerstemcellsanddrugresistance[J].JPathol,2019,247(5):708-718.
[7]YUANJ,XUXJ,LINY,etal.LncRNAMALAT1expressioninhibitionsuppressestonguesquamouscellcarcinomaproliferation,migrationandinvasionbyinactivatingPI3K/AktpathwayanddownregulatingMMP-9expression[J].EurRevMedPharmacolSci,2019,23(1):198-206.
[8]CHENGDZ,BAOCC,ZHANGXX,etal.LncRNAPRNCR1interactswithHEY2toabolishmiR-448-mediatedgrowthinhibitioninnon-smallcelllungcancer[J].BiomedecinePharmacother,2018,107:1540-1547.
[9]SALDAA-MEYERR,RODRIGUEZ-HERNAEZJ,ESCOBART,etal.RNAinteractionsareessentialforCTCF-mediatedgenomeorganization[J].MolCell,2019,76(3):412-422.e5.
[10]LIJS,LIDZ,ZHANGXH,etal.LongnoncodingRNASLC9A3-AS1increasesE2F6expressionbyspongingmicroRNA-486-5pandthusfacilitatestheoncogenesisofnasopharyngealcarcinoma[J].OncolRep,2021,46(2):165.
[11]HUANGXM,HUANGMF,CHENMB,etal.lncRNASLC9A3-AS1promotesoncogenesisofNSCLCviaspongingmicroRNA-760andmayserveasaprognosispredictorofNSCLCpatients[J].CancerManagRes,2022,14:1087-1098.
[12]VILLANUEVAA.Hepatocellularcarcinoma[J].NEnglJMed,2019,380(15):1450-1462.
[13]SHAHM,SARKARD.HCC-relatedlncRNAs:rolesandmechanisms[J].IntJMolSci,2024,25(1):597.
[14]TAOHS,ZHANGYX,LIJ,etal.OncogeniclncRNABBOX1-AS1promotesPHF8-mediatedautophagyandelicitssorafenibresistanceinhepatocellularcarcinoma[J].MolTherOncolytics,2023,28:88-103.
[15]SHENGJQ,WANGMR,FANGD,etal.LncRNANBR2inhibitstumorigenesisbyregulatingautophagyinhepatocellularcarcinoma[J].BiomedecinePharmacother,2021,133:111023.
[16]HABASHYDA,HAMADMHM,RAGHEBM,etal.RegulationofIGF2BP1bymiR-186anditsimpactondownstreamlncRNAsH19,FOXD2-AS1,andSNHG3inHCC[J].LifeSci,2022,310:121075.
[17]CHENPP,ZHANGZS,WUJC,etal.LncRNASNHG12promotesproliferationandepithelialmesenchymaltransitioninhepatocellularcarcinomathroughtargetingHEG1viamiR-516a-5p[J].CellSignal,2021,84:109992.
[18]CAIYS,LYUT,LIH,etal.LncRNACEBPA-DTpromoteslivercancermetastasisthroughDDR2/β-cateninactivationviainteractingwithhnRNPC[J].JExpClinCancerRes,2022,41(1):335.
[19]ZHAOY,MIRC,GARCIA-MAYEAY,etal.RNA-bindingproteins:underestimatedcontributorsintumorigenesis[J].SeminCancerBiol,2022,86(Pt3):431-444.
[20]TANT,MAMM,XINGSG.Effectofcirc_0000009onlungadenocarcinomaprogressionbyregulatingPDZD2inaceRNA-andRBP-dependentmanner[J].Gene,2023,877:147555.
[21]RENLH,FANGX,SHRESTHASM,etal.LncRNASNHG16promotesdevelopmentofoesophagealsquamouscellcarcinomabyinteractingwithEIF4A3andmodulatingRhoUmRNAstability[J].CellMolBiolLett,2022,27(1):89.
[22]WENZL,LIANLY,DINGH,etal.LncRNAANCRpromoteshepatocellularcarcinomametastasisthroughupregulatingHNRNPA1expression[J].RNABiol,2020,17(3):381-394.
[23]ZHANGRL,YANGR,HUANGZD,etal.METTL3/YTHDC1-mediatedupregulationofLINC00294promoteshepatocellularcarcinomaprogression[J].Heliyon,2023,9(12):e22595.
[24]KUAIJH,ZHENGLJ,YIX,etal.ST8SIA6-AS1promotesthedevelopmentofhepatocellularcarcinomacellsthroughmiR-338-3p/NONOAxis[J].DigLiverDis,2021,53(9):1192-1200.
[25]HANHX,LINT,WANGZY,etal.RNA-bindingmotif4promotesangiogenesisinHCCbyselectivelyactivatingVEGF-Aexpression[J].PharmacolRes,2023,187:106593.
[26]SONGYN,HESF,MAX,etal.RBMXcontributestohepatocellularcarcinomaprogressionandsorafenibresistancebyspecificallybindingandstabilizingBLACAT1[J].AmJCancerRes,2020,10(11):3644-3665.

