原理和思維是數字化實驗教學的根基




摘要:結合“壓強對化學平衡的影響”“對比二氧化碳在等體積飽和碳酸氫鈉溶液和水中的溶解量”“探究鎂與氯化銨溶液的反應”3個典型案例,闡述了壓強傳感器在中學化學實驗教學起重要的輔助作用,如要充分發揮數字化實驗效能,準確測量和科學解釋,師生必須明確傳感器工作原理、規范使用儀器,理解實驗原理、正確解讀數據。高效數字化實驗不僅需要技術支持,而且需要實驗者理解原理,打破慣性,創新思維。
關鍵詞:數字化實驗;壓強傳感器;創新實驗
數字化實驗教學體現了信息技術與實驗教學的深度融合。數字化實驗載入不同版本的普通高中化學教材,引發了新一輪探討實驗教學的高潮。壓強傳感器是常用的測量氣壓且相對穩定的儀器。為便于教師更加科學、準確地使用技術工具開展數字化實驗,服務課堂教學,筆者結合典型案例剖析實驗現象背后的原理或成因,指出壓強傳感器實驗教學中依賴技術而忽視原理和思維的誤區,并在分析、解讀、評價的基礎上給出對策與建議。
一、掌握壓強傳感器工作原理是實驗的前提
掌握實驗原理是教師開展實驗研究與教學的前提。目前,一些教師開展數字化實驗教學,只關注諸多傳感器的應用,忽略了傳感器的工作原理。筆者針對所在區域內高中化學教師進行調查,發現90%以上的教師并不清楚用于測定pH、溫度、壓強、氧氣的傳感器的工作原理,也未能充分重視不同傳感器在使用過程中的注意事項,導致誤讀實驗數據,影響實驗結果的可信度。甚至有學者稱“傳感器不好用,也會‘騙人’”[1]。壓強傳感器是中學教學中常用的數字化儀器,在物理、化學等學科教學中應用較為普遍。在高中化學教學中,壓強傳感器常被用于探究壓強對化學平衡的影響、鎂與鹽酸反應的速率等氣體相關性質和變化實驗。準確了解其工作原理,不僅有利于教師在教學中更好地根據原理設計實驗、解讀數據,而且有利于學生跨學科學習,綜合運用知識解決實際問題,提高創新思維能力。
在化學教學中,壓強傳感器多用于測量絕對壓力。壓強傳感器關鍵部件是壓力轉換器,它有一塊可伸縮變化的薄膜,薄膜一邊是真空,另一邊開放(連通大氣)。壓強傳感器工作原理:當薄膜受到壓力時會產生形變,根據形變量傳感器產生輸出電壓,輸出電壓與絕對壓力呈線性關系,從而輸出壓強值。此外,壓強傳感器中還包含兩個特別電路,一個特別電路用來減小溫度變化可能導致的誤差;另一個提供放大電路調整壓力轉換器信號,使輸出電壓與壓力保持線性關系。
二、基于典型案例評析壓強傳感器實驗教學
(一)壓強對化學平衡的影響
利用二氧化氮與四氧化二氮相互轉化探究壓強對化學平衡的影響是中學化學教學中的經典實驗,也是化學教師討論較多的實驗之一。隨著數字化實驗的普及,部分教師已經開始運用數字化實驗對其進行深度研究。孟茂[2]、張玉娟[3]、王春[4]均以“二氧化氮與四氧化二氮相互轉化”為例,用壓強傳感器探究壓強對化學平衡的影響,并將曲線解讀為“迅速改變壓強后,壓強的微小變化是平衡移動過程”。筆者用圖1a裝置分別對二氧化氮與四氧化二氮平衡體系、空氣進行加壓,使其體積縮小為原來的1/2,測其壓強變化量,得到曲線如圖1b、圖1c所示。由于二氧化氮與四氧化二氮相互轉化的速率極大,改變壓強,再次達到平衡的時間是微秒(1微秒=10-6秒)級別[5][6],所以BC段的出現并非平衡移動所致。根據壓強傳感器的工作原理,BC段的變化是迅速加壓時,氣體對壓強傳感器薄膜的沖擊后恢復至穩定狀態過程中產生的,而緩慢加壓未出現類似BC段的尖角。
教師借助針管開展傳統實驗,讓學生觀察顏色變化情況理解化學平衡的移動,但效果不理想。數字化實驗則可以讓學生定量分析加壓對化學平衡的影響。由圖1c可知,壓縮空氣使其體積縮小1/2時,由于體系沒有化學平衡,故壓強從103.3 kPa增至209.4 kPa,壓強增大約一倍;壓縮二氧化氮與四氧化二氮平衡體系,使其體積縮小1/2。由圖1b可知壓強從103.3 kPa只增加到190.6 kPa,比103.3 kPa的兩倍相差16 kPa。對比兩組實驗數據可知,壓強減小16 kPa,這印證了加壓時平衡向氣體體積減小的方向移動。
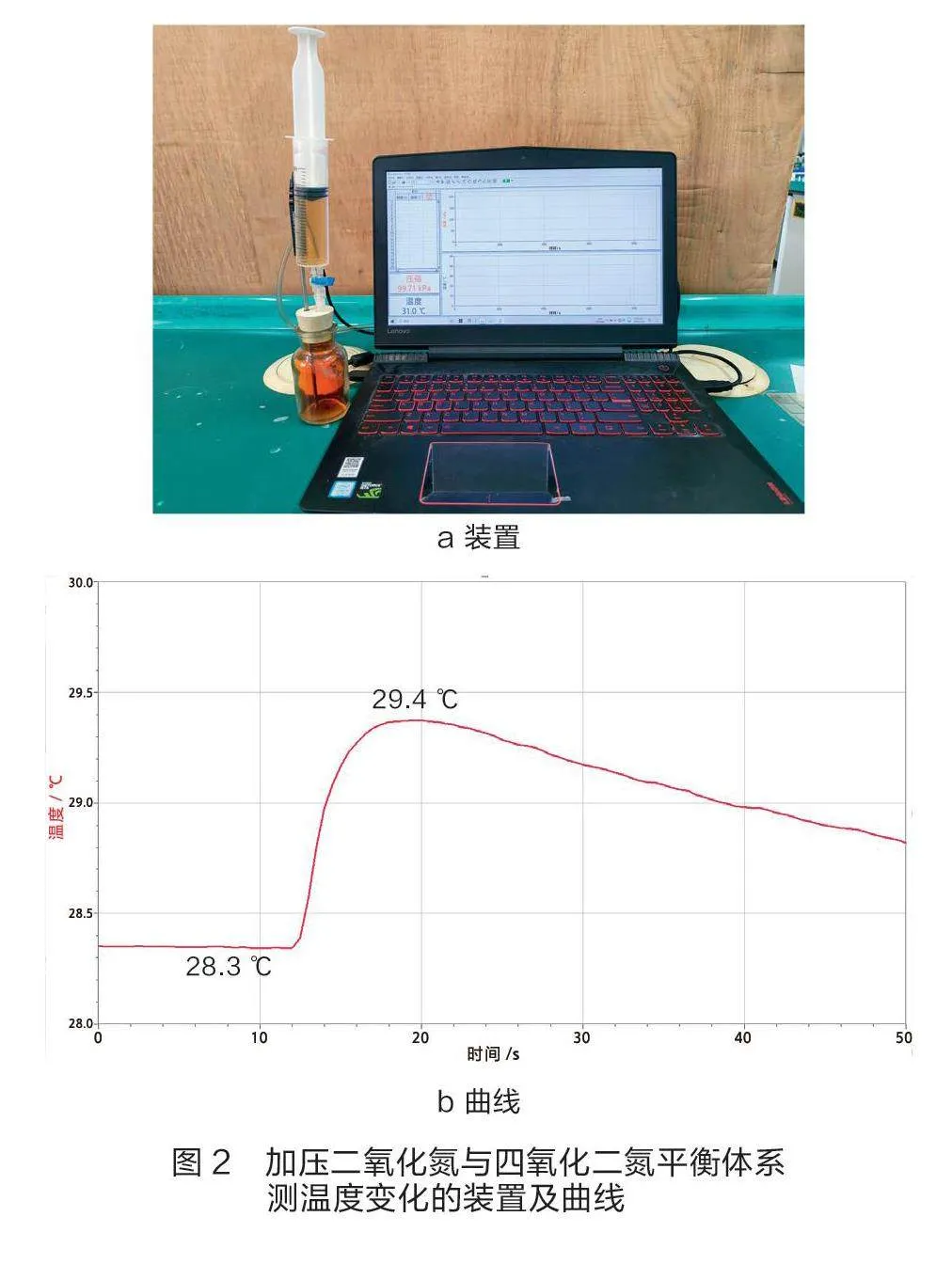
有學者認為,加壓過程是外界對體系做功,會使體系溫度升高,在降溫過程中平衡發生移動,使壓強稍有下降[7][8]。筆者用溫度傳感器測量加壓使其體積減小1/2時溫度的變化情況,裝置如圖2a所示,溫度變化曲線如圖2b所示。
迅速加壓使體積縮小1/2,理論上可使其體系溫度上升16 K[9]。由圖2b可知,在非絕熱體系中其溫度僅上升1.1 K,且溫度達到最高所需時間遠比壓強達到最大的時間要短。根據壓強傳感器的工作原理(傳感器中包含一個特別電路,用來減小溫度變化可能導致的誤差),溫度上升或下降1.1 K對壓強的影響或對平衡常數的影響均可忽略不計。
綜上所述,利用壓強傳感器研究壓強對化學平衡的影響時,當體積縮小1/2時,可忽略因體積功而使溫度升高對實驗的影響,應重視定量分析,即通過定量對比加壓后其壓強的變化量來判斷化學平衡移動的方向。
(二)對比二氧化碳在等體積飽和碳酸氫鈉溶液和水中的溶解量
用飽和碳酸氫鈉溶液除去二氧化碳中混有的氯化氫是化學教學中的常見方案。對用飽和碳酸氫鈉溶液除去二氧化碳中混有氯化氫的解釋,常見的共識性解釋為:首先,二氧化碳與水反應生成碳酸,碳酸電離出氫離子與碳酸氫根離子,在飽和碳酸氫鈉溶液中,碳酸氫根離子濃度大,抑制碳酸的電離,從而降低其在飽和碳酸氫鈉溶液中的溶解度,減少二氧化碳的損耗;其次,碳酸氫鈉與氯化氫反應生成二氧化碳,會增加二氧化碳的量。根據以上解釋不難看出,用飽和碳酸氫鈉溶液相比用水除去二氧化碳中混有氯化氫的優勢要明顯。為對比二氧化碳在等體積飽和碳酸氫鈉溶液和水中溶解的量,筆者設計了如圖3a所示的實驗裝置。兩個錐形瓶中收集滿干燥的二氧化碳氣體,兩個針筒分別加入等體積的飽和碳酸氫鈉溶液和蒸餾水,兩個壓強傳感器分別連在兩個錐形瓶中,再通過數據采集器與計算機相連。
實驗時,筆者將等體積的飽和碳酸氫鈉溶液與蒸餾水同時壓入錐形瓶中,關閉閥門,一段時間后得到壓強變化曲線,如圖3b所示。觀察曲線可知,相同條件下,相同體積的飽和碳酸氫鈉溶液與蒸餾水對比,二氧化碳在飽和碳酸氫鈉溶液中溶解的量比在等體積的水中多,即相同條件下用水除二氧化碳中的氯化氫比用等體積的飽和碳酸氫鈉溶液損耗的二氧化碳要少。如何解釋其原因?不妨換個角度思考:蒸餾水是中性,而飽和碳酸氫鈉溶液呈堿性,二氧化碳是酸性氣體,所以二氧化碳在飽和碳酸氫鈉中的溶解度大一些。
二氧化碳在飽和碳酸氫鈉溶液中的溶解問題是復雜體系中的多因素問題。學生解決這類問題需要有證據意識,要用實驗事實說話,而不是從單一角度推理得到結論。筆者借助壓強傳感器開展“對比二氧化碳在等體積飽和碳酸氫鈉溶液和水中溶解量”實驗證明,信息技術對化學實驗有推動作用,數字化僅是實驗手段,創新關鍵是深入實踐與轉變思維,增強質疑和批判意識,打破思維定式。
(三)探究鎂與氯化銨溶液的反應
鎂與氯化銨溶液的反應也是中學化學教學中常見的實驗,對其反應過程存在不同看法:一般認為是銨根離子水解呈酸性,金屬鎂與氫離子反應生成氫氣,同時促使銨根離子繼續水解;也有學者認為是鎂直接與銨根離子反應生成氫氣;還有學者認為是鎂與水反應生成氫氣和氫氧化鎂,氫氧化鎂附著在鎂表面阻止了反應,銨根離子與氫氧化鎂反應,消耗鎂表面的氫氧化鎂,從而鎂再與水反應。為探討鎂與氯化銨溶液的反應,筆者用圖4a裝置測量5 cm長的鎂條(打磨除去表面的薄膜)與10 mL 0.1 mol/L 氯化銨溶液反應的pH變化量,其變化曲線如圖4b所示。
由圖4b可知,鎂與氯化銨溶液反應開始時,溶液pH迅速升高,然后穩定在9左右(形成氯化銨與氨水的緩沖溶液),整個過程中溶液始終產生大量氣泡,可持續24小時,最終溶液的pH升到10。筆者引導學生從熱力學的視角通過計算判斷銨根離子、不同濃度的氫離子與鎂反應的可能性。
查得相關物質的標準吉布斯(Gibbs)生成自由能Δf G mθ如下[10]:NH4+、NH3和H2的Δf G mθ的值分別為-79、-16.4和0,單位為kJ·mol-1。
求得電極反應2NH4++2e-=2NH3+H2的Δr G mθ=125.2 kJ·mol-1。
根據Δr G mθ=-zE θF,求得電對NH4+/H2的E θ= -0.65 V。
已知NH3·H2O的Kb=1.77×10-5。0.1 mol·L-1氯化銨溶液中銨根離子發生水解:
NH4++H2ONH3·H2O+H+
則 ,解得[H+]=
7.52×10-6 mol·L-1。
假設氣體均處于標準狀態,根據能斯特方程可求0.1 mol·L-1氯化銨溶液中氫離子和銨根離子的電極電勢:
lg(7.52×10-6)2=-0.303 (V)
×lg0.01=-0.71 (V)
隨后計算pH=9時的電極電勢:
×lg(1×10-9)2=-0.533 (V)
Mg2++2e-=Mg的電極電勢為-2.372 V。
計算可知,pH=9時,氫離子也可以氧化鎂,而0.1 mol/L氯化銨溶液中銨根離子也可以氧化鎂生成氫氣。為了進一步證明銨根離子可以氧化鎂,筆者用乙醇作溶劑,用打磨后的鎂條與氯化銨乙醇溶液反應,用壓強傳感器測氣壓變化量,得到壓強逐漸增大的變化曲線。
再做一組對比實驗,將打磨后的鎂條加入乙醇中,無明顯現象,由此可知,鎂與氯化銨乙醇溶液的反應是鎂直接與銨根離子反應。因此,鎂與氯化銨溶液反應的三種觀點均無法反駁。此實驗可能是在不同階段主導的因素不同,如起始階段鎂與氯化銨溶液反應主要是銨根離子水解生成的氫離子與鎂反應,當溶液為堿性時,銨根離子與鎂反應可能是主導因素。
三、化學數字化實驗教學思考
(一)明確傳感器工作原理,嚴格規范儀器使用
教師借助數字化工具開展實驗可以直觀、實時監控反應過程中的微觀變化,并以曲線的形式表征其變化過程,相對于傳統實驗,更易固化證據反映變化過程,聚焦復雜情境中的關鍵問題,促進學生對概念、原理的理解[11]。筆者列舉的案例證明,在使用技術工具開展化學實驗前,要理解傳感器的工作原理,即要了解通過測量什么物理量并將其怎么轉化為輸出信號的過程與原理,才能有效減小實驗測量誤差,對實驗測量值進行正確解讀。除文中提到的壓強傳感器外,常用的還有滴數傳感器。它有一個光學通道槽孔,滴加的液體從該槽孔通過,當紅外線發射器與探測器之間被一滴液體阻攔時,就記錄一個信號,再根據一滴液體的體積求出滴加溶液的總體積。因此,實驗前校準一滴液體的體積是使用滴數傳感器精確測量滴加液體體積的關鍵。又如,氧氣傳感器的工作原理是根據電化學反應來測量氧氣濃度,即利用氧氣的氧化性,通過電化學反應的數據來表征氧氣的含量。如果測量對象中混有其他氧化性氣體,測量就可能存在誤差。此外,有些傳感器同時使用時會相互干擾。例如,一般有線的離子濃度傳感器與pH傳感器不能同時使用。
(二)深度理解實驗原理,準確解讀實驗數據
教師要正確解讀實驗曲線,必須深度理解實驗原理,否則難以正確取舍和解釋實驗曲線。數字化實驗不僅能表征其反應過程,而且比較精確和靈敏,因此外界環境對其實驗結果影響較大。目前部分傳感器技術不成熟,也會影響實驗結果的精準性。對此,教師除開展多組重復實驗外,還需要對實驗原理有深刻理解,這樣才能更好選擇應用曲線變化的趨勢還是測量的數據。例如,在使用電導率傳感器測溶液電導率時,就要理解在一定范圍內的稀溶液,電導率隨溶液濃度增大而增大,但濃溶液的電導率是隨著濃度增大而減小的。電導率隨溶液濃度的增大一般是先增大后減小。電導率的大小不僅取決于離子濃度,還與其活度有關,對于濃溶液其離子活度減小占主導因素,所以電導率不升反降。總之數字化實驗僅是化學實驗的有益補充,不能忽視實驗原理和儀器工作原理,同時要基于原理正確解讀數據,敢于質疑,挖掘實驗數據隱含的科學思維培養功能,這樣才能充分發揮數字化實驗的功能和價值。
注:本文系2022年安徽省教育科學研究項目“基于‘教、學、評’一體化的高中化學數字化實驗教學實踐研究”(項目編號:JK22142)研究成果之一。
參考文獻
[1] 唐增富.傳感器有時也會“騙人”[J].中學化學教學參考, 2020(11):60-62.
[2][9]孟茂.用壓強傳感器展示壓強對二氧化氮與四氧化二氮平衡體系的影響[J].化學教育(中英文),2018(17):66-67.
[3] 張玉娟.傳感技術應用于壓強對化學平衡影響的研究[J].中學化學教學參考,2011(7):50.
[4] 王春.借助數字化實驗探究壓強對化學平衡移動影響[J].教學考試,2023(50):56-57.
[5][8]戴建良.對壓強影響N2O4(g)2NO2(g)平衡實驗結果的重新解釋[J].中學化學教學參考,2020(7):41-43.
[6][7]王磊,信欣,孫影.壓強對化學平衡影響的再探究:以N2O4(g)2NO2(g)為例[J].化學教與學,2023(14):86-91.
[10]張祖德.無機化學[M].2版.合肥:中國科學技術大學出版社,2014:572-579.
[11]朱成東.手持技術數字化實驗促進模型建構的化學教學:沉淀溶解平衡[J].化學教育(中英文),2023(19):41-45.
(作者朱成東系安徽省教育科學研究院化學教研員;楊濤系安徽省蚌埠第二中學教師;徐泓系安徽省宣城市教學研究室化學教研員)
責任編輯:祝元志

