人臍帶間充質干細胞對大鼠肺成纖維細胞分泌Smad2蛋白、結締組織生長因子的影響



【摘要】目的 探究人臍帶間充質干細胞(hUC-MSCs)對轉化生長因子-β(TGF-β)誘導的大鼠肺成纖維細胞向肌成纖維細胞轉化的過程及結局的影響。方法 從10只健康雌性無特定病原體級(SPF級)大鼠中提取肺成纖維細胞,用5 ng/mL TGF-β處理大鼠原代肺成纖維細胞的同時,給予不同濃度的hUC-MSCs對其共培養,其中A組(模型組,加入40 μL TGF-β)、B組(5×105 hUC-MSCs治療組,加入40 μL TGF-β和1 mL 5×105個hUC-MSCs)、C組(2×106 hUC-MSCs治療組,加入40 μL TGF-β和1 mL 2×106個hUC-MSCs)、D組[正常組,加入磷酸鹽緩沖液(PBS)40 μL],采用蛋白免疫印跡法檢測各組細胞內膠原蛋白Ⅰ(Collagen Ⅰ)、α-平滑肌肌動蛋白(a-SMA)蛋白表達量;采用實時熒光定量聚合酶鏈式反應(RT-PCR)法檢測各組細胞內結締組織生長因子(CTGF),Smad2 mRNA的相對表達量。用5 ng/mL TGF-β處理大鼠原代肺成纖維細胞48 h后,將其誘導轉化為肌成纖維細胞,再和不同濃度的hUC-MSCs共培養24 h,其中A組(模型組,加入40 μL TGF-β)、B組(5×105 hUC-MSCs治療組,加入1 mL 5×105個hUC-MSCs)、C組(2×106 hUC-MSCs治療組,加入1 mL 2×106個hUC-MSCs)、D組(正常組,不用40 μL TGF-β誘導,加入PBS 40 μL),采用蛋白免疫印跡法檢測各組肌成纖維細胞內Collagen Ⅰ、a-SMA蛋白表達量;采用RT-PCR檢測各組肌成纖維細胞CTGF、Smad2 mRNA的相對表達量。結果 在TGF-β誘導的大鼠肺成纖維細胞向肌成纖維細胞轉化過程中,A、B、C、D組大鼠Collagen Ⅰ和a-SMA的蛋白表達量均呈現降低趨勢(均P<0.05);A、B、C、D組大鼠CTGF和Smad2 mRNA的相對表達量均呈現逐漸降低趨勢(均P<0.05);大鼠原代肺成纖維細胞誘導轉化為肌成纖維細胞后與不同濃度的hUC-MSCs共培養中,A、B、C、D組小鼠Collagen Ⅰ蛋白相對表達量和a-SMA蛋白相對表達量均呈現降低趨勢(均P<0.05),但A組和B組小鼠Collagen Ⅰ蛋白相對表達量比較,差異無統計學意義(P>0.05);A、B、C、D組大鼠CTGF和Smad2 mRNA的相對表達量均呈現逐漸降低趨勢(均P<0.05),但B組和C組大鼠Smad2 mRNA相對表達量比較,差異無統計學意義(均P<0.05)。結論 hUC-MSCs可減少TGF-β誘導大鼠肺成纖維細胞轉化為肌成纖維細胞過程中表達Collagen、a-SMA蛋白及CTGF、Smad2 mRNA,降低肌成纖維細胞表達Collagen Ⅰ、a-SMA蛋白及CTGF、Smad2 mRNA,且高濃度的hUC-MSCs效果最顯著。
【關鍵詞】人臍帶間充質干細胞 ; 大鼠肺成纖維細胞 ; α-平滑肌肌動蛋白 ; 膠原蛋白 Ⅰ ; Smad2 ; 結締組織生長因子
【中圖分類號】R563.1 【文獻標識碼】A 【文章編號】2096-3718.2024.12.0018.05
DOI:10.3969/j.issn.2096-3718.2024.12.006
間質性肺病(interstitial lung disease,ILD)是指累及肺間質不同程度的炎癥和纖維化,其病理機制是活化的成纖維細胞受轉化生長因子-β(TGF-β)刺激后,通過轉換因子信號通路(TGF-β/Smad通路)向細胞內傳遞調控信號,調控成纖維細胞間充質轉化過程,致其分化為肌成纖維細胞,肌成纖維細胞是引發廣泛的膠原沉積的主要細胞[1]。因此,減輕肺成纖維細胞轉化為肌成纖維細胞的過程,減少肌成纖維細胞表達膠原蛋白Ⅰ(Collagen Ⅰ)、α-平滑肌肌動蛋白(a-SMA)對減緩ILD的病理過程有重要影響。結締組織生長因子(CTGF)是一種新發現的可刺激成纖維細胞增殖和膠原沉積的細胞因子,也是肺纖維化嚴重程度的重要指標,抑制CTGF的表達是減輕肺纖維化的新方法[2]。現有的抗肺纖維化藥物僅能緩解其癥狀,卻無法改善患者的生存質量[3]。間充質干細胞作為一種新型的治療手段,已被廣泛應用于多種炎癥及變性疾病的治療中。有研究發現,間充質干細胞能夠募集至受損部位,并發揮較強的免疫調控作用,從而促進創面上皮的修復[4]。基于此,本研究旨在研究人臍帶間充質干細胞(hUC-MSCs)對大鼠肺間質纖維化的作用及機制,現報道如下。
1 材料與方法
1.1 實驗動物、主要藥物、試劑及儀器
1.1.1 實驗動物 選擇健康雌性無特定病原體級(SPF級)大鼠10只,體質量200~250 g,大鼠均6周齡。購自北京維通利華驗動物技術有限公司,動物許可證編號:SCXK(京)2021-0006。所有動物均飼養于徐州醫科大學實驗動物中心,飼養環境為層流潔凈飼育室,適應喂養1周,觀察無不良反應后,納入實驗。本研究經徐州醫科大學倫理委員會審查(倫理審批號:202212S008)。
1.1.2 主要藥物與試劑 hUC-MSCs完全培養基由博雅干細胞科技有限公司提供;高糖DMEM培養基、牛血清白蛋白(BSA)、熒光二抗488、總核糖核酸(RNA)抽提試劑(Trizol)、乙二胺四乙酸(EDTA)、脫氧核糖核酸酶Ⅰ(DNase Ⅰ)、膠原酶Ⅰ、Ⅳ(Co Ⅰ、Ⅳ)、磷酸鹽緩沖液(PBS)均來自賽默飛世爾科技公司;重組人轉化生長因子-β干粉、a-SMA一抗、波形蛋白(Vimentin)一抗、Collagen Ⅰ一抗、3-磷酸甘油醛脫氫酶(GAPDH)一抗、二抗均來自武漢三鷹生物技術有限公司;胎牛血清(FBS)來自西瓊生物科技;抗熒光淬滅劑、細胞核染料(DAPI)、蛋白裂解液(RIPA)均來自上海碧云天生物技術研究所;反轉錄 - 聚合酶鏈反應試劑盒來自寶日醫生物技術(北京)有限公司等。
1.1.3 主要實驗儀器 聚合酶鏈式反應(PCR)反應儀(美國艾本德公司,型號:Mastercycler? nexus);電泳槽(美國伯樂公司,型號:Mini TBC);轉膜儀(美國伯樂公司,型號:Mini-Trans Blot);凝膠成像儀(德國基伊埃公司,型號:Image Quant LA);共聚焦顯微鏡(德國蔡司公司,型號:LSM 900);實時熒光定量檢測儀(德國羅氏公司,型號:LightCycler480 Ⅱ);細胞培養箱(美國賽默飛公司,型號:Heracell 150i GP)等。
1.2 研究方法
1.2.1 大鼠肺成纖維細胞的傳代培養 大鼠肺組織剪碎后置于50 mL離心管中,分別用20 mL消化液Ⅰ(高糖DMEM培養基+3% FBS+5 mmol EDTA),10 mL消化液Ⅱ(高糖DMEM培養基+2 mmol EDTA),10 mL消化液Ⅲ(0.5 mg/mL DNase Ⅰ+0.5 mg/mL Dispase+0.5 mg/mL Co Ⅰ+0.05 mg/mL Co Ⅳ+1640培養基)依次消化后。加10 mL消化液Ⅳ(1640培養基+3% FBS)終止消化。所有細胞懸液合并于50 mL離心管中,離心后重懸,鋪在大皿中,3 d后吸取上清再加入新的培養基,7 d后可正常傳代,傳代一次后可進行后續實驗。
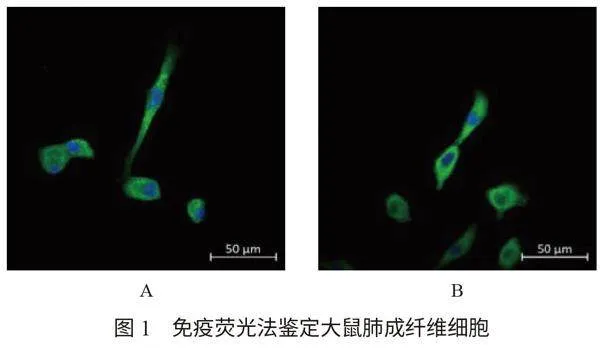
1.2.2 免疫熒光法鑒定大鼠肺成纖維細胞 接種原代肺成纖維細胞前,孔板底放入無菌蓋玻片,再鋪板;待細胞貼壁后棄去培養基,PBS慢搖浸洗,0.1% Triton-X-100(PBS配置)室溫通透20 min后PBS洗凈;BSA室溫封閉后用稀釋好的Vimentin一抗(1∶100)4 °C過夜孵育,第2天PBS緩慢搖洗后加入用PBS稀釋好的熒光二抗488(1∶500)避光室溫孵育1 h,PBS浸洗后,加入DAPI避光室溫染核完成在載玻片上滴加抗熒光淬滅劑后蓋在載玻片上,在共聚焦顯微鏡下觀察Vimmentin蛋白表達情況,若能穩定表達則表示成功提取肺成纖維細胞。
1.2.3 分組方法 ⑴將提取的肺成纖維細胞均勻鋪于6孔板中,每孔細胞密度為1×105個,每孔培養基體積為1.96 mL。實驗隨機分為4組:A組(模型組)、B組(5×105 hUC-MSCs治療組)、C組(2×106 hUC-MSCs治療組)、D組(正常組),待細胞貼壁后,A組肺成纖維細胞孔內加入40 μL TGF-β(2.5 μg/mL),誘導肺成纖維細胞轉化為肌成纖維細胞;D組孔內加入PBS 40 μL,其余2組孔內分別加入40 μL TGF-β(3.75 μg/mL)保證培養基內TGF-β終濃度為50 ng/mL處理肺成纖維細胞,同時B組嵌套小室(Transwell)加入1 mL 5×105個hUC-MSCs,C組嵌套小室(Transwell)加入1 mL 2×106個hUC-MSCs與肺成纖維細胞共培養96 h后,收取6孔板底部肺成纖維細胞。⑵將提取的肺成纖維細胞均勻鋪板于6孔板中,每孔細胞密度為1×105,每孔培養基體積為1.96 mL。實驗隨機分為4組:A組(模型組)、B組(5×105 hUC-MSCs治療組)、C組(2×106 hUC-MSCs治療組)、D組(正常組)。細胞貼壁后,除D組外,其余3組肺成纖維化細胞用40 μL TGF-β(2.5 μg/mL)誘導48 h后轉化成為肌成纖維細胞,保證培養基內TGF-β終濃度為50wVm531XELlc+AXg+KNypEQ== ng/mL,重新更換培養基后,向B組和C組Transwell嵌套小室分別加入1 mL 5×105個hUC-MSCs和2×106個hUC-MSCs與肺肌成纖維細胞共培養48 h,收取6孔板底部肌成纖維細胞,總計10個板,進行實驗。
1.3 觀察指標 ⑴通過蛋白免疫印跡法檢測hUC-MSCs對TGF-β誘導大鼠肺成纖維細胞向肌成纖維細胞轉化過程中a-SMA、Collagen Ⅰ表達量的影響。⑵通過蛋白免疫印跡法檢測hUC-MSCs對已分化的肌成纖維細胞分泌a-SMA、Collagen Ⅰ表達量的影響。⑶通過實時熒光定量聚合酶鏈式反應(RT-PCR)觀察hUC-MSCs對TGF-β誘導大鼠肺成纖維細胞向肌成纖維細胞轉化過程中肺成纖維細胞表達CTGF和Smad2 mRNA表達的影響,同時也探究hUC-MSCs對已分化的肌成纖維細胞表達的CTGF和Smad2 mRNA表達的影響。按照Trizol試劑說明書提取RNA反轉錄成互補脫氧核糖核酸(cDNA),加入相應的引物進行擴增,引物見表1。
1.4 統計學方法 運用SPSS 20.0統計學軟件分析數據,計量資料均使用S-W法檢驗證實服從正態分布,以( x ±s)表示,多組間比較采用單因素方差分析,兩兩比較采用SNK-q檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 大鼠肺成纖維細胞的鑒定 原代大鼠肺內提取的成纖維細胞胞質內能穩定表達vimentin熒光,大鼠肺成纖維細胞細胞核被DAPI染成藍色,證明原代肺成纖維細胞提取成功,見圖1。
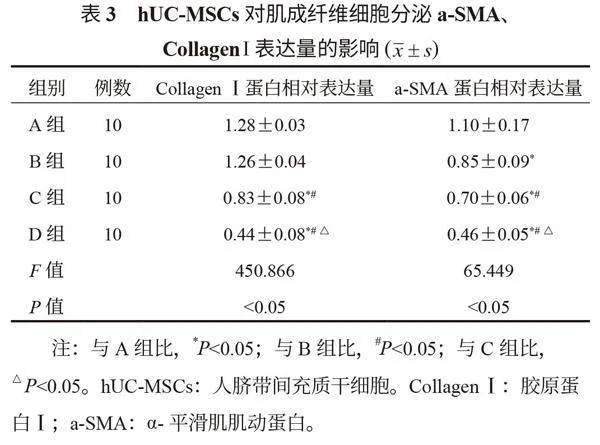
2.2 hUC-MSCs對TGF-β誘導大鼠肺成纖維細胞向肌成纖維細胞轉化過程a-SMA、Collagen I表達的影響 通過蛋白免疫印跡法檢測發現,A、B、C、D組大鼠Collagen Ⅰ和a-SMA的蛋白表達量均呈現降低趨勢,組間兩兩比較,差異均有統計學意義(均P<0.05),見圖2、表2。
2.3 hUC-MSCs對肌成纖維細胞分泌a-SMA、Collagen I表達的影響 C組和D組小鼠Collagen Ⅰ蛋白相對表達量均低于A組和B組,D組低于C組,A、B、C、D組小鼠a-SMA蛋白相對表達量呈現降低趨勢,且組間兩兩比較,差異均有統計學意義(均P<0.05),但A組和B組小鼠Collagen Ⅰ蛋白相對表達量比較,差異無統計學意義(P>0.05),見圖3、表3。
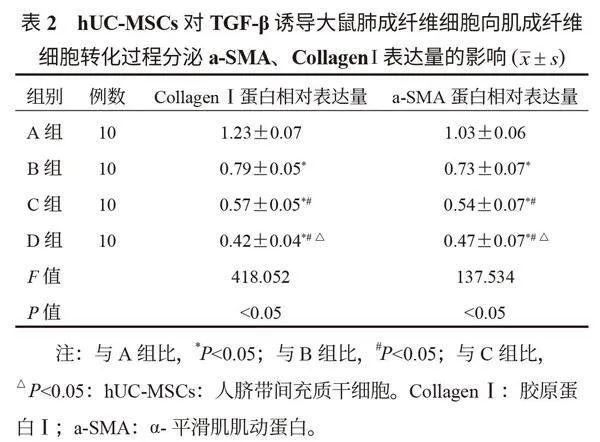
2.4 hUC-MSCs對TGF-β誘導過程中大鼠成纖維細胞CTGF及Smad2 mRNA表達量的影響 通過RT-PCR檢測發現,A、B、C、D組大鼠CTGF和Smad2 mRNA的表達量均呈現逐漸降低趨勢,且組間兩兩比較,差異均有統計學意義(均P<0.05),見表4。
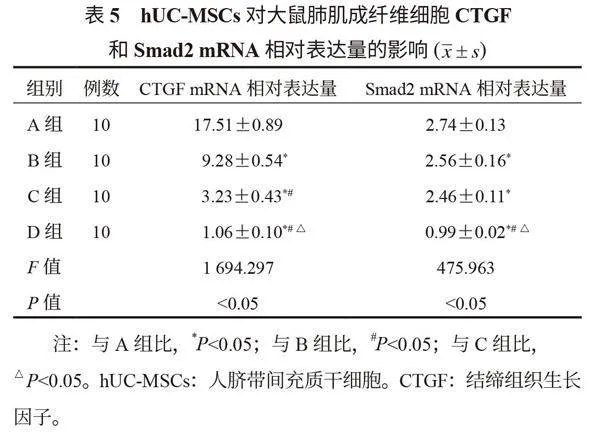
2.5 hUC-MSCs對大鼠肺肌成纖維細胞CTGF和Smad2 mRNA相對表達量的影響 通過RT-PCR檢測發現,A、B、C、D組大鼠CTGF和Smad2 mRNA的表達量均呈現逐漸降低趨勢,差異均有統計學意義(均P<0.05),但B組和C組大鼠Smad2 mRNA相對表達量比較,差異無統計學意義(均P<0.05),見表5。
3 討論
TGF-β是一種較強的促纖維化因子,成纖維細胞被TGF-β激活后可通過TGF-β1/Smad2途徑將調節信號傳導至胞內,誘導成纖維細胞向肌成纖維細胞轉化[5]。因此本研究采用TGF-β誘導肺成纖維細胞向肌成纖維細胞轉化作為體外研究的模型。
正常生理情況下,肺成纖維細胞合成和分泌細胞外基質蛋白,修復損傷和保護肺泡正常生理活性。當肺組織受損時,肺成纖維細胞增殖分化為肌成纖維細胞,其分泌細胞外基質的能力是肺成纖維細胞的4~5倍,導致細胞外基質大量沉積,加速肺纖維化的進展。成纖維細胞轉分化為肌成纖維細胞是纖維化應答過程中的關鍵性事件,肌成纖維細胞的特征介于成纖維細胞和平滑肌細胞之間,其表達a-SMA的能力要明顯高于成纖維細胞,這是成纖維細胞轉分化的一個標志[6]。正常情況下,細胞外基質的合成和分解處于動態平衡,有助于維持肺組織的正常結構和功能,Collagen Ⅰ是細胞外基質的主要組成成分之一,由肺成纖維細胞和轉分化后的肌成纖維細胞合成,當肺組織受損時,肺成纖維細胞增殖并分化成肌成纖維細胞,產生過多的細胞外基質,并在肺間質內過度蓄積,造成肺實質廣泛損傷和重塑,觸發肺纖維化[7]。間充質干細胞是一類具有自我復制和多向分化潛能的成體干細胞,能分化成許多種組織細胞,如神經細胞、肝細胞、軟骨細胞、脂肪細胞等,具有廣闊的臨床應用前景。hUC-MSCs來源于分娩時遺棄的臍帶,取材方便,原代培養即可獲取大量細胞,細胞增殖能力強、擴增速度快,分離成功率高,是一種從人臍帶組織華爾通膠分離培養出的具有多向分化潛能的成纖維樣細胞,其在體外可定向分化成各種類型的細胞,并可通過抑制炎癥反應、抑制纖維化,從而改善各種原因所致的肺損傷[8]。本實驗中hUC-MSCs對TGF-β誘導大鼠肺成纖維細胞向肌成纖維細胞轉化過程分泌a-SMA、Collagen Ⅰ表達量的研究結果表明,A、B、C、D組大鼠Collagen Ⅰ和a-SMA的蛋白表達量均呈現降低趨勢,這表明hUC-MSCs可減少TGF-β誘導大鼠肺成纖維細胞轉化為肌成纖維細胞過程中表達Collagen和a-SMA蛋白,且高濃度的hUC-MSCs效果最顯著。
CTGF能夠促進成纖維細胞增殖,參與細胞外基質的產生、積聚,對纖維細胞的增殖分化過程具有較強的調控作用,CTGF mRNA過度表達與纖維化疾病的發生密切相關[9]。TGF-β是強效的致纖維化細胞因子,但其在促進纖維化發生發展的過程中,需要信號傳導系統的參與,Smad是把TGF-β與其受體結合后產生的信號從細胞質傳遞到細胞核的中介分子,Smad中的Smad2可以使Ⅰ型受體(TβR Ⅰ)激活而發生磷酸化,從而增強TGF-β的信號傳導,因此抑制Smad2表達可有效切斷TGF-β信號傳導,從而阻斷TGF-β1介導的纖維化效應[10]。本研究中發現,A、B、C、D組大鼠CTGF和Smad2 mRNA的表達量均呈現逐漸降低趨勢,低濃度和高濃度的hUC-MSCs可不同程度降低其表達量,這表明hUC-MSCs可能通過影響TGF-β1/Smad2途徑來抑制TGF-β誘導過程中肺成纖維細胞轉化為肌成纖維細胞,從而減輕肺纖維化的嚴重程度。
ILD的發病原理仍未完全明確,該病的主要特點是大量肌成纖維細胞增殖、聚積以及細胞外基質沉積,肌成纖維細胞是ILD的主要效應細胞,其數量與疾病的嚴重程度和預后呈負相關[11]。本實驗中A、B、C、D組肌成纖維細胞Collagen Ⅰ蛋白相對表達量和a-SMA蛋白相對表達量均呈現降低趨勢,但A、B組Collagen Ⅰ蛋白相對表達量比較,差異無統計學意義,這表明hUC-MSCs可降低肌成纖維細胞表達Collagen Ⅰ和a-SMA蛋白,且高濃度間充質干細胞效果最明顯。這表明結果,hUC-MSCs可能是減輕間質性肺病肺纖維化的有效方法且療效與hUC-MSCs濃度有關。用RT-PCR法檢測發現,A、B、C、D組大鼠CTGF和Smad2 mRNA的表達量呈現逐漸降低趨勢,但B組和C組大鼠Smad2 mRNA相對表達量比較,差異無統計學意義,這表明hUC-MSCs可以減少肌成纖維細胞Smad2和CTGF的mRNA表達量,在高濃度的間充質干細胞作用下,該效果最顯著。分析其原因為,hUC-MSCs可能通過影響TGF-β1/Smad2途徑逆轉肌成纖維細胞產生肺纖維化相關的膠原沉積,從而減輕肺纖維化的嚴重程度。
綜上,hUC-MSCs可減少TGF-β誘導大鼠肺成纖維細胞轉化為肌成纖維細胞過程中表達Collagen和a-SMA蛋白,以及Smad2和CTGF mRNA,降低肌成纖維細胞表達Collagen Ⅰ和a-SMA蛋白,以及Smad2和CTGF mRNA,且高濃度的hUC-MSCs效果最顯著。但目前間質性肺病的發病機制仍較為復雜,間充質干細胞對間質性肺病肺纖維化的嚴重程度調控仍需探索。
參考文獻
吳曉東, 徐勝梅, 楊智華, 等. 穿山龍總皂苷通過TGF-β/Smad信號通路減輕類風濕關節炎相關間質性肺病的肺纖維化[J]. 中華中醫藥學刊, 2023, 41(1): 99-102, 281-283.
孟麗紅, 張曉梅, 王洪, 等. 養陰益氣合劑對肺間質纖維化大鼠血清TGF-β1、CTGF、IL-18表達影響[J]. 中華中醫藥雜志, 2019, 34(11): 5396-5399.
吳聰, 劉建, 郭亞麗, 等. 進展性纖維化型間質性肺疾病藥物治療的研究進展[J]. 世界中西醫結合雜志, 2021, 16(11): 2151-2156.
徐敏紋, 邵思琪, 馬華, 等. 間充質干細胞對小鼠間質性肺病的治療作用[J]. 江蘇醫藥, 2020, 46(2): 116-119, 217.
劉妍宏. 骨髓間充質干細胞中miR-130a-3p通過調控TGF-β/
Smad信號通路抑制小鼠肺成纖維細胞增殖和分化[D]. 沈陽: 中國醫科大學, 2021.
王慧, 賀彬, 黃文杰, 等. 水蛭素對TGF-β1誘導的肺成纖維細胞增殖及轉分化的影響研究[J]. 現代中西醫結合雜志, 2022, 31(23): 3252-3256.
周珍, 蔡坤松, 許雅紅, 等. 紫草素對博來霉素誘導肺纖維化小鼠的作用及機制[J]. 西部醫學, 2020, 32(1): 33-37.
徐敏紋, 邵思琪, 馬華, 等. 間充質干細胞對小鼠間質性肺病的治療作用[J]. 江蘇醫藥, 2020, 46(2): 116-119, 217.
李佳怡, 王亞菲, 郝月琴, 等. CXCL14、TGF-β1和CTGF水平與特發性肺纖維化的關系[J/CD]. 中華肺部疾病雜志(電子版), 2021, 14(2): 222-224.
付鈺, 吳瑕, 陳隨清. 甘草查爾酮A通過調節TGF-β/Smad信號通路抑制小鼠肺纖維化[J]. 中國實驗方劑學雜志, 2019, 25(4): 94-100.
李娜, 李科君, 杜利清. 肺纖維化中肌成纖維細胞活化機制的研究進展[J]. 基礎醫學與臨床, 2019, 39(9): 1341-1345.

