基于broccoli 的RNA 熒光適體設計與篩選
摘 要: 為了在活細胞RNA 成像中提供更加精準的工具,本文旨在基于broccoli 的RNA 熒光標記創建熒光強度高、穩定性好的綠色熒光適體. 采用理性設計對broccoli 進行優化,并通過測定光譜特征和理化性質對broccoli 變體進行多輪篩選. 結果發現基于對 RNA 熒光適配體broccoli 的三輪突變篩選,獲得了熒光強度提升3. 3 倍的 broccoli 四位點突變體(命名為Bro);再利用設計的 3WJ 支架,組建了3WJ-n×Bro RNA 熒光適配體家族;采用嵌入串聯重復Bro的方式可以顯著提升適體的熒光強度,其中3WJ-4×Bro 的熒光強度超過3WJ-Bro 的2. 7 倍,且表現出更低的鹽離子依賴性和更高的熱穩定性、光穩定性和監測靈敏度. 結果表明本文設計出的 3WJ-n×Bro 家族并從中篩選出優異的核酸適配體 3WJ-4×Bro,可為在RNA 水平上實現活細胞RNA 成像提供可視化工具.
關鍵詞: RNA 熒光適體; Broccoli 適體; RNA 成像
中圖分類號: Q74 文獻標志碼: A DOI: 10. 19907/j. 0490-6756. 2024. 046003
1 引言
在生物大分子中,核糖核酸(RNA)具有重要的生物學功能,參與細胞內的生命活動[1]. 在活細胞中,RNA 也具有獨特的結構、種類繁多的生物學功能以及復雜的時間空間分布. 如線粒體lncRNAIDL 調控腫瘤細胞氧化磷酸化產生ATP 及細胞生長[2]. 與蛋白質相比,RNA 種類更多,但它們中的大部分功能尚未被鑒定,也因此被稱為基因組中的“暗物質”[3]. 因此,在分子水平上可視化活細胞內RNA 如何轉錄、剪接、轉運、降解和亞細胞定位等過程具有重要的生物學意義.
RNA 成像是研究RNA 生物學的重要工具,RNA 成像技術在固定細胞和活細胞中都得到了快速發展. 1982 年,Singer 和Ward[4]率先展示了用于RNA 檢測的熒光原位雜交(FISH);熒光標記的RNA[5]、RNA 干擾[6]和熒光RNA[7]這3 個系統都是最早開發的在活細胞中可視化RNA 的方法,到目前為止,用于細胞RNA 的影像解析技術主要包括熒光原位雜交技術、生物酶修飾的RNA 標簽技術、分子信標技術、熒光蛋白-RNA 結合蛋白技術以及熒光RNA 技術,其中前2 種技術只能用于固定細胞即死細胞中RNA 的熒光標記,而后3 種技術可以實現活細胞RNA 的熒光標記與成像. 其中對于Spinach-DFHBI 的優化,一方面是序列優化,基于對Spinach 的理性修飾產生了序列更短的iSpinach(69 nt)[8]和Baby Spinach(51 nt)[9],但熒光效果提升幅度不顯著. 另一方面是開發了新的熒光素DFHBI-1T[10],Spinach-DFHBI-1T 復合物的熒光強度達到了GFP 的88%,卻存在穩定性改善效果不顯著. 隨后,Jaffrey 團隊結合改進的SELEX 篩選和熒光激活的細胞分選(FACS)篩選到了1 個49nt 適體Broccoli[11],有效提高了適體對高鹽離子的依賴性,然而單個broccoli 在RNA 成像中低豐度,不易檢測與成像. Zhang 等采用64 個串聯重復Spinach 標記細胞內mRNA,顯著增強其熒光強度[12],但較長的RNA 標記可能對RNA 的正常生理過程產生影響.
因此,為進一步提升broccoli 在細胞內的熒光強度和穩定性. 本文研究旨在改進broccoli 序列以獲得熒光信號增強的broccoli 單元,通過設計新支架和低拷貝串聯重復策略,構建高熒光強度和穩定性的新適體. 在本實驗中,首先以Spinach2(與broccoli 高度同源)為基礎,對broccoli 的序列進行單位點到多位點的多輪突變和體外熒光篩選出增強4 倍的熒光適體單元Bro. 接著,設計了3WJ 新型支架,構建了3WJ-n×Bro 適體家族,通過對3WJ-n×Bro 家族的折疊效率、離子依賴性、熒光強度、光穩定性和熱穩定性表征,篩選最優適體3WJ-4×Bro. 最后,我們通過體外轉錄實驗評估了3WJ-4×Bro 作為RNA 標記熒光報告ROI 的能力.
2 材料與方法
2. 1 材料與儀器
PCR 儀(C1000 thermal cycler)、熒光定量PCR 購于Bio-Rad 公司;F-7000 熒光分光光度計購于日立(中國)有限公司;Thermo Fisher 全波長多功能酶標儀購于賽默飛世爾科技公司;DFHBI-1T(Lucerna)購于美國MedChemexpress 生物科技公司;所有DNA 引物由成都生工生物有限公司合成;DNA 限制性內切酶Sac Ⅰ、Sac Ⅱ、Xba Ⅰ等、T4 DNA Ligase 購于北京全式金生物技術有限公司;反轉錄試劑盒、質粒小提試劑盒購于天根生化科技(北京)有限公司.
2. 2 方法
2. 2. 1 broccoli 變體序列設計和篩選
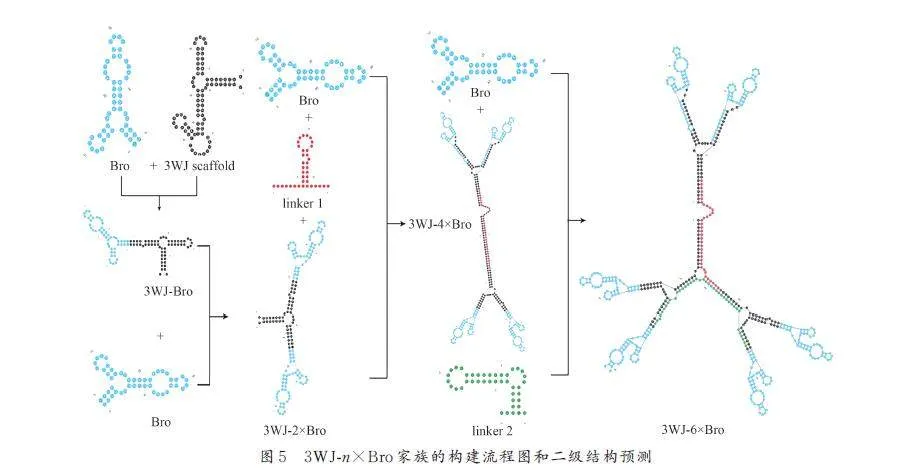
采用RNAfolder(http://rna. tbi. univie. ac. at/cgi-bin/RNAWebSuite/RNAfold. cgi)、RNA Composer(http://rnacomposer. cs. put. poznan. pl/)對broccoli的序列和晶體結構進行最小自由能二級結構預測以及3D 結構預測,對broccoli 的核心結構序列和側翼序列進行多輪系統突變和熒光篩選;采用Mfold 和RNA Composer 在線工具,以F30 支架序列為基序,設計了8 個新的三叉結構支架(F31-F37)篩選熒光強度最大的適體支架,命名為3WJ.以3WJ-Bro 為基礎,構建3WJ-2×Bro、3WJ-4×Bro 和3WJ-6×Bro.
2. 2. 2 載體構建與RNA 體外轉錄
將合成基因序列,克隆到pBluscript ⅡSK( +)質粒的T7啟動子下游(Xba Ⅰ和Sac Ⅰ兩酶切位點之間). 采用通用引物M13F 和M13R 擴增上游帶有T7 啟動子的適體DNA 序列. 采用PCR 純化回收試劑盒(全式金公司)進行純化回收,測定濃度,并稀釋到相同濃度作為體外轉錄模板;采用Xba Ⅰ 和 Sac Ⅰ 雙酶切載體和pBluescript Ⅱ SK(+)-3WJ-4×Bro,將3WJ-4×Bro 片段亞克隆到pBluescript ⅡSK( +)-AtCLE 的 Xba Ⅰ和 Sac Ⅰ位點之間,構建pBluescript Ⅱ SK( +)-AtCLE-3WJ-4×Bro,用以提供體外轉錄模板.
體外轉錄采用in vitro Transcription T7 Kit(TaKaRa)進行,輕輕混勻后于37 ℃孵育2 h. 然后加入3 μL RNase free DNase Ⅰ ,輕輕混勻后轉入42 ℃孵育30 min,用于去除模板DNA,結束后測定RNA 濃度和純度,利用熒光定量PCR 儀器對broccoli系統突變體進行實時熒光檢測[8]. 采用96 孔板加樣. 每樣孔除了包含in vitro Transcription T7Kit 的轉錄試劑外,還包含終濃度為60 μmol/LDFHBI-1T、10 mmol/L MgCl2、50 mmol/L KCl.將板放入BioRad CFX96 儀器4 ℃封閉5 min,然后轉入37 ℃ 持續1 h. 采用所有通道( 包括FAM/SYBR 濾光片)讀板,讀板時間間隔為2 min. 然后導出數據進行分析,比較各突變體的最大熒光值,初始熒光定義為4~8 min 的熒光改變量.
2. 2. 3 相關理化性質檢測
添加終濃度為50 μmol/L 精制適體RNA 于含有5 mmol/LMgCl2、10 μmol/L DFHBI-1 的1×HEPES 緩沖液中,置于PCR 儀器95 ℃加熱3 min,然后緩慢冷卻到室溫,設定降溫梯度設置為1 ℃/min,重折疊適體RNA,采用日立F7000 熒光分光光度儀對以上反應液進行光譜掃描,確定最大激發和發射波長;采用CFX96 上的BioRad 軟件確定熔解曲線和自動計算的溫度T 值,適體RNA-DFHBI-1T 復合物95 ℃加熱3 min,然后緩慢冷卻到室溫,設定降溫梯度設置為1 ℃/min,重折疊適體RNA,循環3 次,每次循環檢測熒光恢復率;適體RNA-DFHBI-1T復合物采用熒光分光光度計測定初始熒光(Fi),而后在日光燈(1500 lx)下放置5 h,每小時再次測定熒光剩余量(Fn),測定5 次,采用以下公式計算相對熒光衰退率(RFDR):RFDR=(Fi-Fn)/Fi×100%(n=1~5);形成總體積1 mL 的RNADFHBI-1T 溶液,將反應液置于PCR 儀器95 ℃加熱3 min,然后緩慢冷卻到室溫,溫度降幅設置為1 ℃/min,重折疊適體RNA 采用日立F7000 熒光分光光度儀進行熒光強度測定,繪制熒光強度對于鹽濃度的相關曲線.
3 結果與分析
3. 1 broccoli 篩選結果
3. 1. 1 通過多輪篩選得到broccoli 四突變體Bro
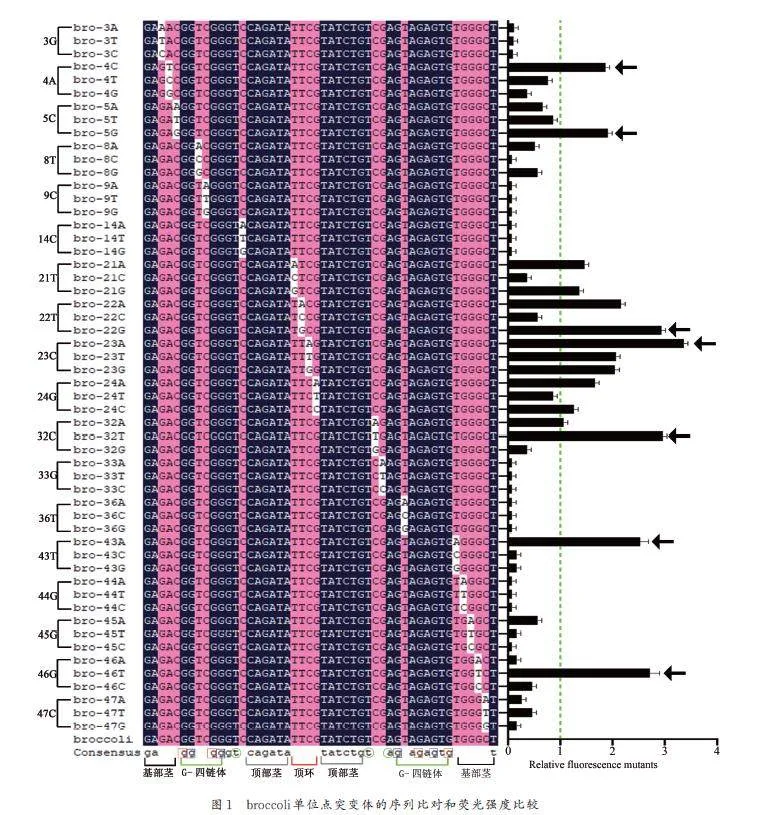
優化適體內部結構的方式是探究增強熒光RNA適體的熒光強度和穩定性重要途徑之一,首先通過位點推理突變的方式獲得更優broccoli. 我們參考 Spinach(與broccoli 序列高相似)的結構進行理性突變,發現6、7、10、11、35、38、40、42 位上的8 個G 構成核心G 四聯體結構,由13U、31U、34A 構成了“ 蓋子”結構,這2 部分是broccoli 的核心結構.因此我們在這部分不進行突變處理. 而9、36、43、44 位構成了底托結構,于是推測該部分可能對G四聯體的穩定性有影響,所以我們對這4 個位點也進行了系統突變(將該位點的核苷酸分別替換成其他3 種核苷酸之一). 結果發現,這4 個和核苷酸的任意突變都導致了熒光的急劇下降(圖1). 這表明9、36、43、44 位核苷酸是broccoli 的關鍵結構之一. 位于“ 蓋子”平面上方的14、32、33 位核苷酸,我們嘗試對該結構進行了系統突變. 結果發現,14C 和33G 突變后導致熒光消失;32C 突變成G 導致熒光較低,而突變成T 熒光相對于broccoli 增加了1. 8 倍;這表明14C,32T,33G 位點構成的“ 蓋頂”結構更有助于“ 蓋子”將DFHBI-1T 穩固在G-四聯體中,從而增強熒光;21~24 位核苷酸可能構成broccoli 頂環,而彼此又是非成對堿基,可以在空間及其他位置產生作用力,因此,我們對這些位點也進行了突變處理. 結果發現,21T 突變為A或G,22T 突變為A 或G,23C 突變成A 或T 或G,24G 突變為A 或C,均可提高了broccoli 的熒光強度,其中突變體bro-23A 的熒光強度是broccoli 的3 倍. 1~5 和45~49 構成了基部莖,其中內部的3~5 和45~47 位應該具備高的T 以維護broccoli 其自身結構穩定性. 我們在這幾個位點也做了突變.結果發現,我們增加堿基配對,如4A 變成C 與26位G 配對或46G 變成T 與4 位A 配對,5C 突變為G 與47 為C 配對,都顯著提升了broccoli 的熒光強度,而減少堿基配對則顯示降低熒光強度(圖1).從上面推理突變中,我們找到可以提升broccoli 熒光的13 個突變位點,產生了15 個熒光顯著增強的broccoli 單突變體. 我們在broccoli 的不同區段選擇了熒光顯著增強的7 個位點突變體bro-4C,bro-5G,bro-22G,bro-23A,bro-32T,bro-43A 和bro-46T(圖1 黑色箭頭所示).
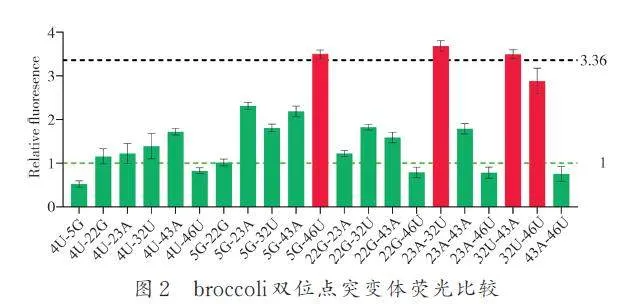
其次從第1 輪篩選的單突變位點中,我們將以上選擇的7 個單突變位點進行隨機組合,共產生了21 個雙突變體,測定熒光的相對定量,結果發現,17 個雙突變組合的熒光強度均相對于其單突變體的熒光有所降低(圖2 綠色所示). 但我們發現,有4 對雙突變組合分別高于該位點兩單突的熒光強度,這說明突變的兩位點可以促進broccoli 核心的穩定性(圖2 綠色所示). 我們篩選了3 種broccoli雙突變體:5G-46U、23A-32U 和32U-43A. 其熒光強度明顯高于最優單突的熒光強度( 圖2虛線).
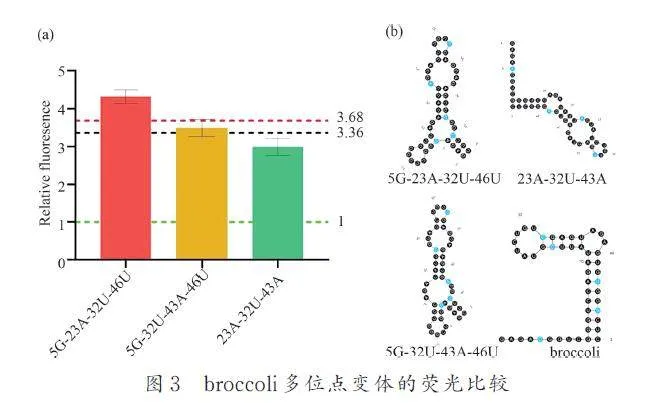
最后從第2 輪篩選出了3 組雙位點突變組合,我們將其組合形成3 組合點突變組合,即5G-23A-32U-46U、5G-32U-43A-46U 和23A-32U-43A,并測定相對熒光強度. 結果發現,基于5G-46U 和23A-32U 組合的四突變體 5G-23A-32U-46U 的熒光強度均高于兩雙突的熒光強度(圖3a). 這表明5G-46U 與23A-32U 存在直接或者間接的相互作用可以促進broccoli 的有效折疊,提升熒光強度.基于5G-46U 和32U-43A 的四突變體5G-32U-43A-46U 的熒光強度并未得到改善,而且基于23A-32U 和32U-43A 的三突組合23A-32U-43A 熒光反而低于雙突組合(圖3a). 這進一步表明5G 和23A 可以與43A 和46U 作用以穩定broccoli 的結構. 5G-23A-32U-46U 組合的熒光強,其相對熒光強度是broccoli 熒光強度(綠色虛線所示)的4. 41倍,是最優雙突變體(23A-32U)熒光強度(黑色虛線所示)的1. 2 倍和最優單突變體(bro-23A)熒光強度(紅色虛線所示)的1. 3 倍. 二級結構預測顯示,broccoli 在5、23、32、41、46 的堿基優化促進了broccoli 二級結構的折疊(圖3b). 通過以上3 輪篩選,我們最終獲得了1 個優化的broccoli 四突變體5G-23A-32U-46U,并將其命名為Bro.
3. 1. 2 3WJ-Bro 設計及其體外熒光表現
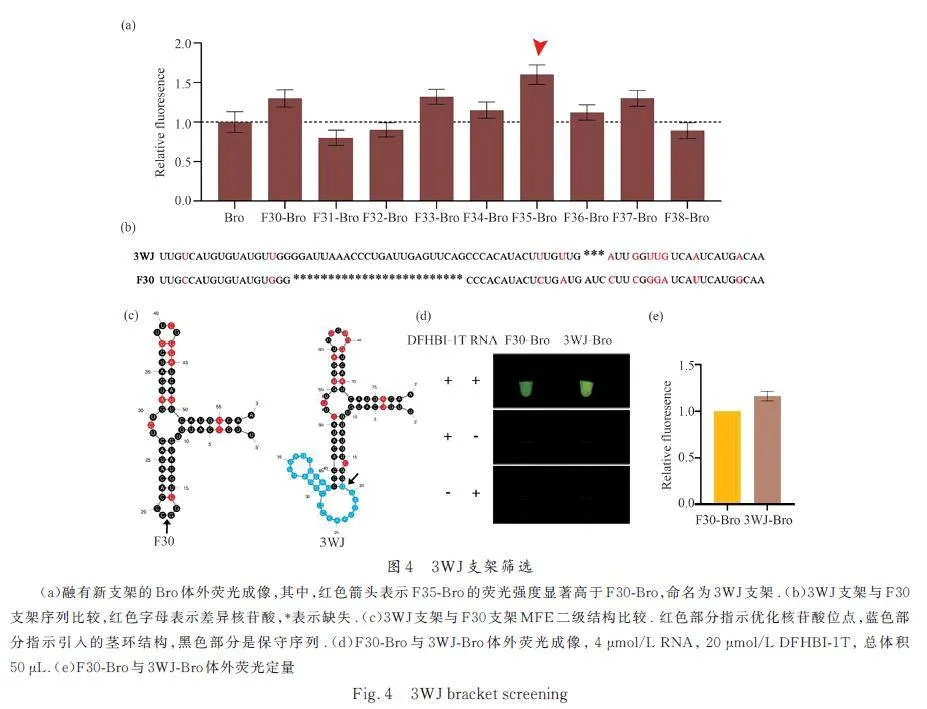
為了增強Bro 熒光效果的穩定性,我們通過設計支架輔助折疊進一步增強熒光,以F30 支架融合的Bro 為對照,將新設計8 個三叉結構支架F31-F37 與Bro 融合進行體外轉錄成像. 結果發現,8 個新設計的支架中,5 個支架(F33~F37)有效提升Bro 的熒光強度,其中F35-Bro 的熒光強度顯著高于F30-Bro.因此,將F35 支架命名為3WJ 支架(圖4a). 3WJ 與F30 支架序列對比發現,3WJ 進行了11 位的核苷酸突變和2 個位點的插入缺失突變(圖4b). 二級結構分析結果顯示,3WJ 設計了1 個新的莖環結構用于引入適體插入位點(圖4b). F30-Bro 和3WJBro體外熒光成像結果顯示, 3WJ-Bro 的熒光亮度明顯高于F30-Bro(圖4c). 2 種熒光適體的熒光定量結果顯示,3WJ-Bro 的熒光強度是F30-Bro 熒光強度的1. 2 倍( 圖4d、4e),表明新設計的3WJ 比F30 對Bro 的熒光提升能力更強.
3. 1. 3 3WJ-n×Bro 家族設計增強熒光效果
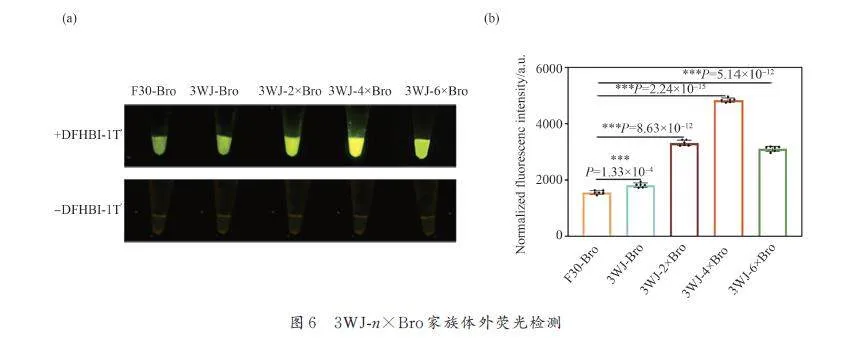
由于3WJ 支架對Bro 的熒光強度幅度較小,為了進一步增強3WJ-n×Bro 的熒光效果,我們嘗試采用串聯重復使用的方式,在3WJ 支架中串聯插入多個Bro 單元,構建1 個3WJ-n×Bro 家族,探究更有效的提升適體熒光強度的組合. 基于3WJ-Bro,在3WJ 支架中另一個凸環再引入1 個broccoli,形成3WJ-2×Bro,采用MFE 分析其二級結構,兩分子Bro 保持正常的折疊狀態(圖5). 同時,我們設計了長37 nt 莖環結構連接體(linker1,紅色標記)、1 個42 nt 連接體(linker2,綠色標記),用于穩定Bro 構象. 二級結構顯示,3WJ-2×Bro,3WJ-4×Bro 和3WJ-6×Bro 的每個Bro 單元都保持相同的折疊結構(圖5,藍色標記).
結果顯示,3WJ-2×Bro 的實際熒光強度是3WJ-Bro 的2. 0 倍,這與Bro 單元的數量比一致,表明3WJ-2×Bro 與3WJ-Bro 中的Bro 單元擁有相同水平的折疊. 然而3WJ-4×Bro 和3WJ-6×Bro 的熒光強度僅為3WJ-Bro 的2. 7 倍和1. 9 倍,表明雖然向3WJ 支架中引入多個Bro 單元可以增加熒光強度,但Bro 數量的增加會影響自身的有效折疊,使熒光激發效率降低. 其中3WJ-4×Bro 熒光強度最高,達5000 a. u.(圖6b).
3. 2 3WJ-n×Bro 家族理化性質結果
3. 2. 1 3WJ-n×Bro 家族的熱穩定性評估
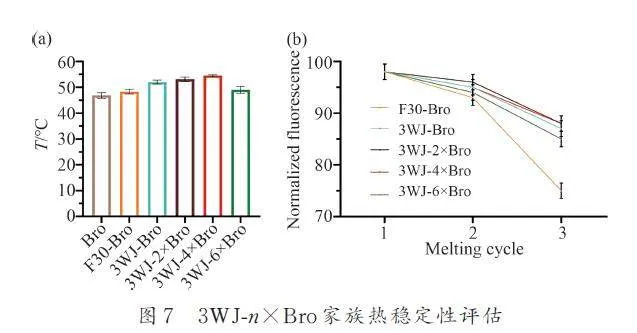
適體的熱穩定性對其表征有一定影響,我們對3WJ-n×Bro 家族的熒光強度隨變性溫度(T)的變化進行測定,結果發現,3WJ-Bro 的T 值(52 ℃)顯著高于F30-Bro T 值(48. 3 ℃),表明3WJ 對Bro 的折疊效果強于F30 支架(圖7a). 在3WJ-n×Bro 家族中,3WJ-2×Bro 與3WJ-4×Bro 的T 分別為53. 1 ℃和54. 3 ℃ ,3WJ-6×Bro 的T 50 ℃ ,3WJ-Bro 和F30-Bro 的T 值均高于Bro 的T(46 ℃),表明3WJ 之間難以維持6 個Bro 單元的結構穩定性(圖7a). 然后,我們將3WJ-n×Bro RNA 與DFHBI-1T 混合物進行95 ℃變性,然后緩慢冷卻到室溫退火,循環3 次,每次循環檢測熒光熒光恢復率,測試了3WJ-n ×Bro 在經過多輪熔解、冷卻后的熒光恢復能力. 結果發現,在3WJ-n×Bro 家族中,3WJ-2×Bro 和3WJ-4×Bro 的熒光恢復率最強,達到了初始熒光的88%. 這表明3WJ-n×Bro 家族在經過多輪熱變性后還能恢復較高的有效折疊率,從而具有較高的熱穩定性,其中3WJ-2×Bro 和3WJ-4×Bro 穩定性最好.
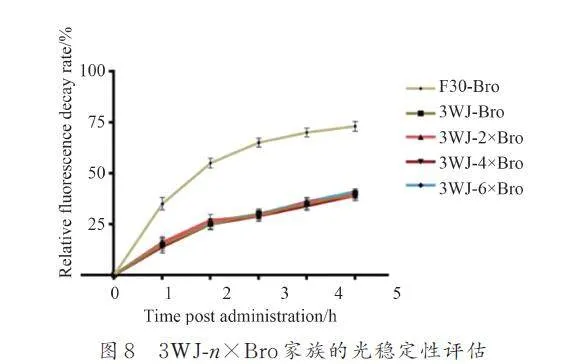
3. 2. 2 3WJ-n×Bro 家族的光穩定性評估
通過測定各個復合物的初始熒光,用488 nm 的激發光照射2 min 后暴露于日光燈(1500 lx)5 h,每1 h 測定1 次熒光剩余量,測定5 次,計算相對熒光衰退率(RFDR)來探究3WJ-n×Bro 家族的光穩定性.結果顯示,在處理后5 h 內3WJ-n×Bro 家族的熒光殘余量始終高于F30-Bro 的熒光殘余,3WJ-n×Bro 家族在光處理5 h 內表現出相似的熒光衰退率,且遠小于F30-Bro(圖8). 這表明3WJ-n×Bro家族擁有相對高的光穩定性. 其中3WJ-4×Bro 較高的熒光強度和較好的光穩定性使其具有更好的應用潛力.
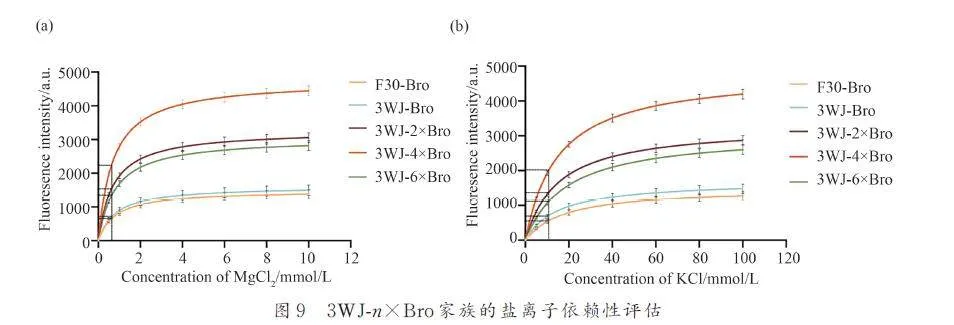
3. 2. 3 3WJ-n×Bro 家族的鹽離子依賴性評估
通過檢測3WJ-n×Bro 家族在不同濃度Mg2+和K+條件下的熒光強度,探究3WJ-n×Bro 家族對這2種離子的依賴性. 結果顯示,當Mg2+ 濃度在2 mmol/L 內時,所有適體的熒光強度隨Mg2+濃度增加而急劇升高,Mg2+濃度超過2 mmol/L 時熒光增幅降低. 3WJ-n×Bro家族和F30-Bro在5 mmol/LMg2+ 出熒光達到平臺期,這與broccoli 的趨勢相同. 我們同時發現,3WJ-n×Bro 家族和F30-Bro 存在相同的解離常數Kd ( Kd=1. 4 mmol/L),這表明3WJ-n×Bro 家族和F30-Bro 對Mg2+具有相同親和性(圖9a). 適體對K+的依賴性測定結果顯示,當K+增加到60 mmol/L 時,所有適配的熒光強度進入平臺期. 此外,所有適體的表現出有相同的K+結合親和力(Kd=15 mmol/L)(圖9b),這一結果與broccoli 相似. 以上結果表明,3WJ-n×Bro 家族和broccoli 擁有較低的鹽離子依賴性.
3. 2. 4 3WJ-4×Bro 報告體外ROI 的靈敏度
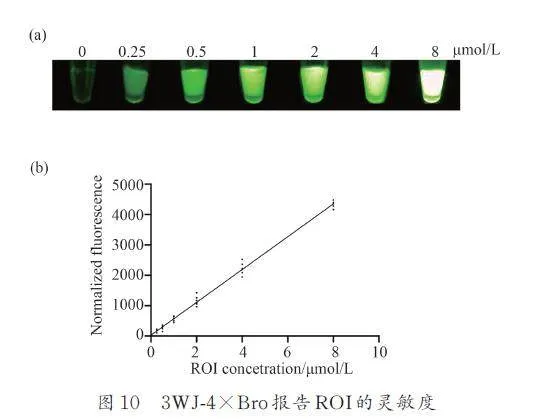
通過將3WJ-4×Bro DNA 序列克隆到AtCLE 基因的3 ′UTR 區,通過體外轉錄獲得3WJ-4×Bro 標記的AtCLE RNA. 將AtCLE RNA 稀釋成一系列濃度梯度然后與過量的DFHBI-1T 孵育5 min 后進行熒光成像和熒光定量,以此來確定3WJ-4×Bro 用于報告ROI 的靈敏度以及3WJ-4×Brod 的熒光強度與ROI 濃度的關系. 結果顯示,當AtCLE RNA稀釋低至0. 25 μmol/L 時可檢測到明顯的綠色熒光. 隨著AtCLE RNA 含量的增加,熒光強度增強,當超過8 μmol/L 時,熒光過曝(圖10a). 因此3WJ-4×Bro 報告體外ROI 具有較高的靈敏度. 熒光量化數據顯示,AtCLE RNA 含量在0. 25~8 μmol/L 范圍內,熒光強度隨AtCLE RNA 濃度增加呈線性增加趨勢(圖10b). 因此,基于這種線性關系,我們提供了體外ROI 定量的新方法.
4 討論
目前SELEX 篩選和系統突變篩選是主要的RNA 熒光適體篩選方式[13]. 本研究中,我們參考Spinach(與broccoli 序列高相似)的結構進行理性突變,在第1 輪突變篩選中,在系統突變的18 個位點中,3、8、9、33、44、47 號位的核苷酸發生任何堿基的替換均導致broccoli 熒光的急劇下降,而這些位點并不是G-四聯體的核心結構,說明這些位點的核苷酸對G-四聯體二層堆疊結構具有協助作用. 本輪突變中共10 個位點的突變可以提升broccoli的熒光強度,21~24 號位突變成另外2 個堿基均能提升broccoli 的熒光強度,其他位點只能突變成特定堿基才能提升broccoli 熒光強度(圖1),這可能是21~24 號位于頂端莖環區,該區域不直接與DFHBI-1T 相互作用,而是幫助broccoli 折疊成合適DFHBI-1T 的空間構象. 從第1 輪篩選的單突變位點中,我們將以上選擇的7 個單突變位點進行隨機組合,共產生了21 個雙突變體,有4 對雙突變組合分別高于該位點兩單突的熒光強度. 在第3次突變中,我們找了1 個熒光強度相對于broccoli增強了4 倍的broccoli 四突變體(即Bro). 通過二級結構預測發現,這種突變組合最穩定. 而其他三位點突變熒光強度均低于雙位點突變(圖3). 這表明這些位點的核苷酸可能存在相互作用,而這些位點同時突變可能破壞了這種作用.
為了增強適體的熒光強度和穩定性,基于F30支架,我們設計了新的3WJ 支架,未直接采用F30支架,主要是考慮到之前有報道證明broccoli 插入tRNA 支架和F30 支架后在大腸桿菌和哺乳動物細胞中容易受到核酸酶不同程度的剪切[14]. 經過優化后的broccoli 熒光強度有所增強,將bro 融入到3WJ 與F30 中,3WJ-Bro 相對于F30-Bro 熒光有所增強,但增強幅度不到20%(圖4),表明通過支架提升熒光強度的能力有限. 為了進一步提升適體的熒光強度和穩定性,我們采用向3WJ 支架串聯重復使用Bro 單元的方式增加熒光強度. 結果發現,這種方式雖然增強了適體的熒光強度,但熒光強度的增加與Bro 單元倍數并不成線性關系,而且3WJ-2×Bro 熒光強于3WJ-6×Bro. 這表明3WJ支架對Bro 單元的容納能力有限. 因此,采用這種方法提升熒光強度時需要考慮改進支架的容納空間(圖6). 為了將3WJ-n×Bro 家族用于ROI 體外檢測,我們評估3WJ-n×Bro 家族對的ROI 的靈敏度測試. 結果顯示,通過線性回歸發現,熒光強度與RNA 濃度成線性關系,這可以為體外RNA 檢測和定量提供新的方法.
綜上,本研究根據突變策略我們對broccoli 進行了3 輪突變篩選獲得了熒光強度高于broccoli 熒光3 倍的5G-23A-32U-46U 位點突變的熒光適體Bro. 同時,我們設計了新的3WJ 支架,結合broccoli和3WJ 二級結構,我們采用嵌入串聯重復Bro的方式構建了3WJ-n×Bro 家族RNA 熒光適體.通過對3WJ-n×Bro 家族成員光譜特征、熒光強度、T 值、鹽離子依賴性、光穩定性、ROI 靈敏度篩選出熒光強度高、穩定性好的3WJ-4×Bro 適體,為植物活細胞中RNA 成像研究提供了可視化工具.
參考文獻:
[1] Liu W Y. Biological function, self-splicing and selfreplicationof ribosomal RNA[J]. Prog Biochem Biophys,1991, 18: 1.[劉望夷. 核糖體RNA 的生物功能、自我剪接與自我復制[J]. 生物化學與生物物理進展, 1991, 18: 1.]
[2] Shan C,Li Z H. Ribozymes based self-cleavagesgRNA and its application in gene editing [J]. J SichuanUniv(Nat Sci Ed), 2019,56:345.[單策, 李中瀚. 基于核酶的自剪切sgRNA 及其在基因編輯中的應用[J]. 四川川大學報( 自然科學版), 2019,56: 345.]
[3] Liu Z Y, Cao A, Jiang L S, et al. The biologicalfunction and regulatory mechanism of long noncodingRNA ( lncRNA ) [J]. J Agric Biotechnol,2018, 26: 1419.[劉志宇, 曹安, 蔣林樹, 等. 長鏈非編碼RNA( lncRNA)生物學功能及其調控機制[J].農業生物技術學報, 2018, 26: 1419.]
[4] Singer R H, Ward D C. Actin gene expression visualizedin chicken muscle tissue culture by using in situhybridization with a biotinated nucleotide analog[J]. JClin Periodontol, 1982, 79: 7331.
[5] Zhang D, Gao L H, Shao Y, et al. A new techniquefor in vivo labeling of transcribed RNA [J]. BiotechnolBull, 2012, 23: 98.[張朵, 高麗華, 邵勇. 等.一種體內標記轉錄RNA 的新技術[J]. 生物技術通訊, 2012, 23: 98.]
[7] Yu G H, Chen R K, Chen Y L. Establishment offluorescent mRNA differential display method and optimizationof conditions [J]. Fujian Med J, 2004,26: 135.[余桂華, 陳如凱, 陳燕凌. 熒光mRNA 差異顯示方法的建立及條件優化[J]. 福建醫藥雜志,2004, 26: 135.]
[8] Fernandez Millan P, Autour A, Ennifar E, et al.Crystal structure and fluorescence properties of theiSpinach aptamer in complex with DFHBI [J].RNA, 2017, 23: 1788.
[9] Okuda M, Fourmy D, Yoshizawa S. Use of babyspinach and broccoli for imaging of structured cellularRNAs[ J]. Nucleic Acids Res, 2017, 45: 1404.
[10] Filonov G S, Moon J D, Svensen N, et al. Broccoli:Rapid selection of an RNA mimic of green fluorescentprotein by fluorescence-based selection and directedevolution [J]. J Am Chem Soc, 2014, 136:16299.
[11] Hoefer K, Langejuergen L V, Jaeschke A. Universalaptamer-based real-time monitoring of enzymaticRNA synthesis [J]. J Am Chem Soc, 2013, 135:13692.
[12] Zhang J, Fei J, Leslie B J, et al. Tandem spinach arrayfor mRNA imaging in living bacterial cells [J].Sci Rep, 2015, 5: 17295.
[13] Ageely E A, Kartje Z J, Rohilla K J, et al.Quadruplex-flanking stem structures modulate thestability and metal ion preferences of RNA mimics ofGFP[ J]. ACS Chem Biol, 2016, 11: 2398.
[14] Filonov G S, Kam C W, Song W, et al. In-gel imagingof RNA processing using broccoli reveals optimalaptamer expression strategies [J]. Alkaloids ChemBiol, 2015, 22: 649.
(責任編輯: 白林含)
基金項目: 高校基本科研業務費-專職博士后研發基金(2022SCU12100)

