山豆根ISSR-PCR反應體系優化及引物篩選



摘要 以山豆根為試驗材料,采用正交試驗考察DNA、引物、Mg2+、dNTPs、Taq酶5個因素對ISSR-PCR反應體系的影響,建立并優化山豆根ISSR-PCR反應體系條件。結果表明:山豆根ISSR-PCR反應體系(20 μL)最優條件為Mg2+濃度3 mmol/L,dNTPs 0.2 mmol/L,Taq酶1 U,引物0.5 μmol/L,模板DNA 100 ng,運用該體系從100條UBC引物中篩選到10條清晰、多態性好的引物。采用正交試驗設計可有效建立山豆根ISSR-PCR反應的最優體系,為山豆根的親緣關系,種質資源遺傳多樣性評價及品種鑒定和系統分類等研究提供科學依據。
關鍵詞 山豆根;ISSR-PCR體系優化;正交試驗;引物篩選
中圖分類號 S567 文獻標識碼 A
文章編號 0517-6611(2024)18-0078-05
doi:10.3969/j.issn.0517-6611.2024.18.017
開放科學(資源服務)標識碼(OSID):
Optimization of ISSR-PCR Reaction System and Primer Selection of Sophora tonkinensis Gagnep
LI Jin-mei1,GUAN Miao-juan1,HUANG Ding1,2 et al
(1.College of Pharmacy, Guangxi University of Chinese Medicine, Nanning, Guangxi 530200; 2.Key Laboratory of Resources Protection and Utilization of Traditional Chinese Medicine and Ethnic Medicine, Guangxi University of Chinese Medicine, Nanning, Guangxi 530200)
Abstract Taking Sophora tonkinensis as materaial, orthogonal experiments were used to investigate the effects of DNA, primers, Mg2+, dNTPs, and Taq enzymes on the ISSR-PCR reaction system, and the conditions of ISSR-PCR reaction system of Sophora tonkinensis were established and optimized. The results showed that the optimal conditions for the ISSR-PCR reaction system (20 μL) of Sophora tonkinensis including 3 mmol/L Mg2+, 0.2 mmol/L dNTPs, 1 U Taq enzyme, 0.5 μmol/L primer, 100 ng template DNA. Ten primers with good polymorphism were selected from 100 UBC primers by this system. The optimal system of ISSR-PCR reaction can be effectively established by orthogonal experiment design, which provides a scientific basis for the research of genetic relationship, genetic diversity evaluation of germplasm resources, variety identification and systematic classification of Sophora tonkinensis.
Key words Sophora tonkinensis Gagnep;ISSR-PCR system optimization;Orthogonal test design;Primer screening
基金項目 廣西中醫藥大學中藥學一流學科項目(2019XK093);廣西中醫藥大學青年創新研究團隊項目(2018QT001)。
作者簡介 李金梅(1998—),女,廣西靈山人,碩士研究生,研究方向:中藥資源學。*通信作者,教授,博士,從事中藥資源保護與開發研究。
收稿日期 2023-10-07
山豆根(Sophora tonkinensis Gagnep)為豆科越南槐屬植物,常以干燥根和根莖入藥,主要分布在我國廣西、貴州、云南等地[1]。其化學成分主要為生物堿、黃酮和三萜類化合物等[2],具有抗癌、抗腫瘤、抗炎、抗菌、抗心律失常等藥理作用[3-6]。
分子標記技術ISSR (inter-simple sequence repeat)又稱簡單重復序列間擴增,由1994年加拿大蒙特利爾大學的Zietkiewicz等[7]提出。ISSR因其具有無需預先基因組序列信息、快速、穩定、多態性豐富、重復性強及成本低等優點[8],廣泛應用于植物種質資源收集和鑒定、遺傳多樣性和親緣關系、優異基因的發掘和定位等方面。目前國內外對藥用植物山豆根的分子鑒定研究多采用DNA條形碼技術,而有關ISSR分子技術研究較少。筆者以山豆根為試驗材料,采用正交試驗結合ISSR的方法,優化Mg2+、dNTPs、Taq酶、引物和模板DNA等影響因素,建立山豆根最佳反應體系,旨在為植物山豆根親緣關系、種質資源、遺傳多樣性等研究提供參考依據。
1 材料與方法
1.1 試驗材料
試驗材料為山豆根的新鮮幼嫩葉,采自廣西中醫藥大學仙葫藥圃,樣品由廣西中醫藥大學李良波研究員鑒定為山豆根。摘取山豆根新鮮幼嫩葉,用蒸餾水沖洗葉片,75%乙醇擦拭表面,晾干至-20 ℃冰箱保存備用。
1.2 試驗方法
1.2.1 改良CTAB法提取基因組DNA。
采用改良CTAB法提取山豆根嫩葉組織DNA,取2 μL基因組總DNA溶液與1 μL loading Buffer 混合,點樣于0.7%瓊脂糖凝膠上樣孔,在1×TAE緩沖液中電壓120 V電泳40 min。電泳結束采用Gel Red 染料凝膠泡染,凝膠成像,觀察記錄并分析其基因組完整性,取1 μL基因組總DNA溶液,使用微量紫外分光光度計檢測其濃度和純度,并置于-20 ℃冰箱保存備用。
1.2.2 ISSR-PCR反應體系的正交試驗設計。
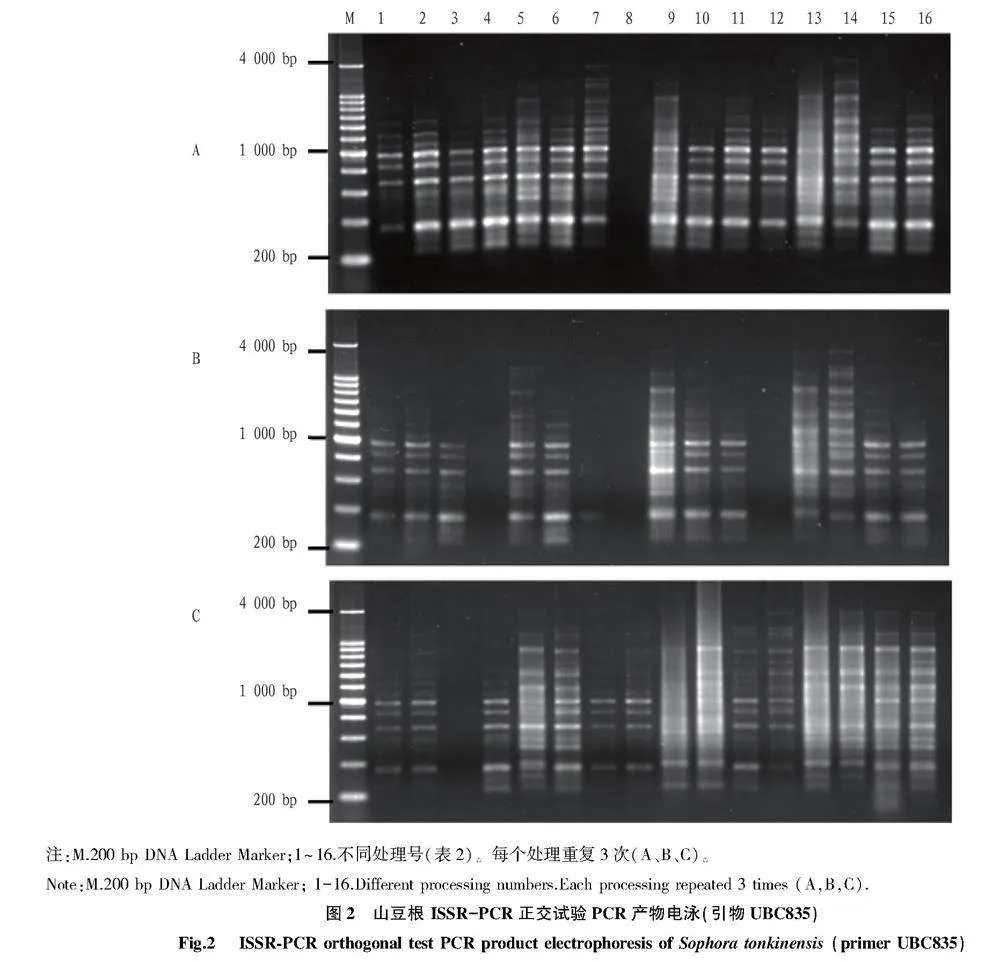
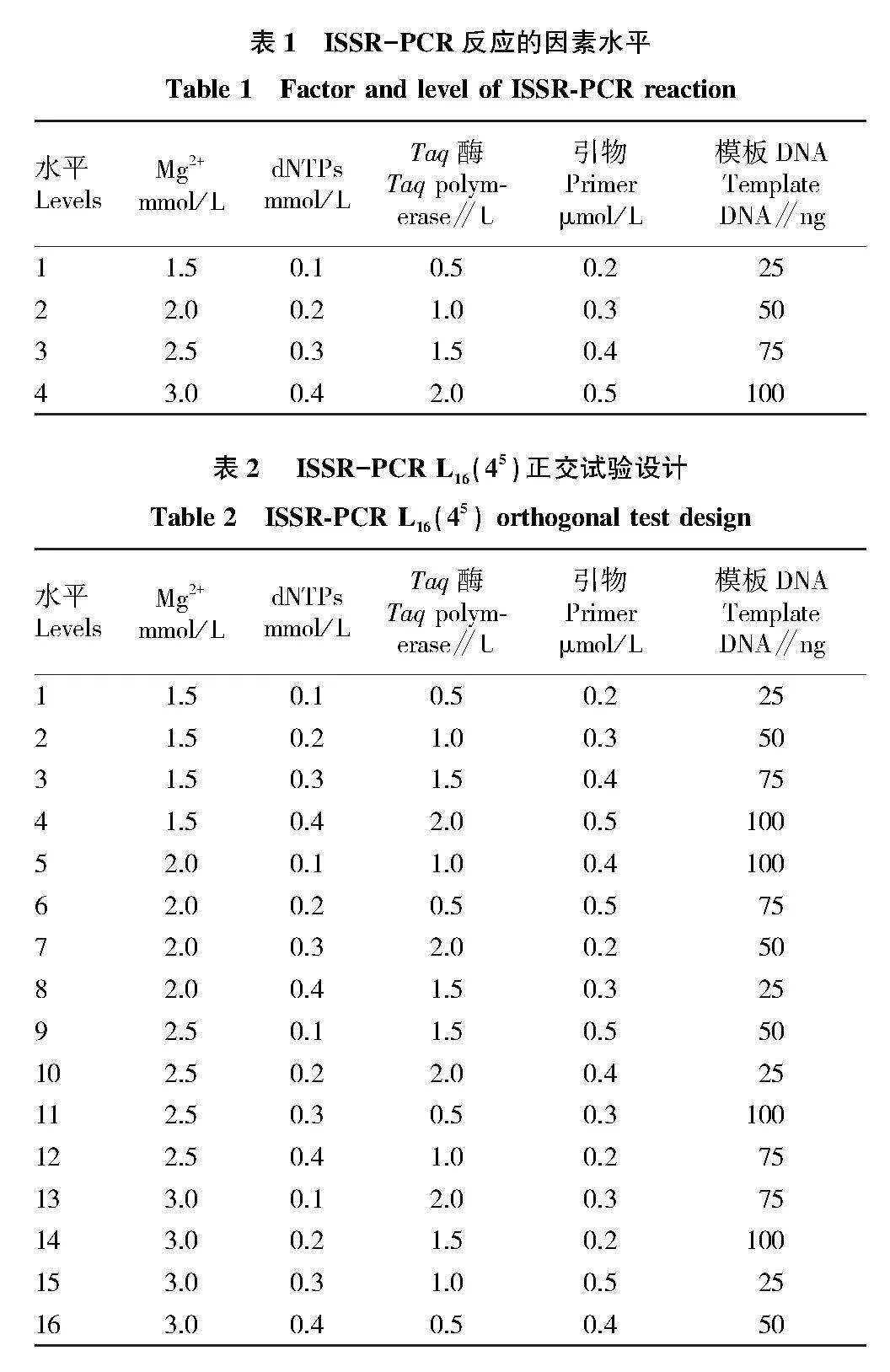
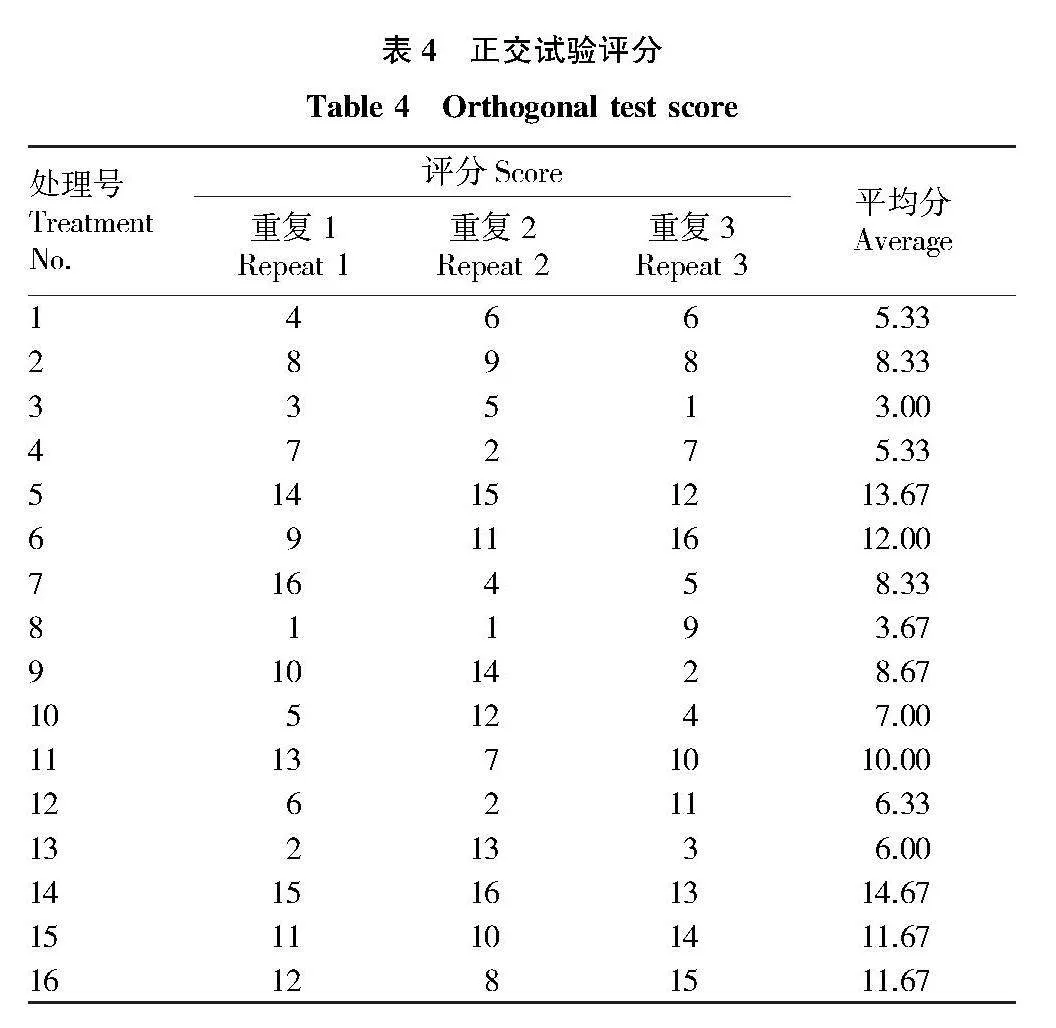
以山豆根基因組DNA為模板,采用UBC835引物為固定引物,以L16(45)開展正交試驗(表1、表2),對4水平5因素(模板DNA、引物、Mg2+、dNTPs、Taq 酶)配比進行體系優化。選用該引物TM梯度條帶多態性、完整性較好的最佳溫度,根據反應程序至PCR儀進行擴增,反應體系總體積為20 μL,其中含2 μL 10×Buffer,其余不足由滅菌水補足。每處理重復3次。
1.2.3 ISSR-PCR擴增。
建立ISSR-PCR反應體系體積為20 μL,其中Taq酶1 U,模板50 ng,引物0.3 μmol/L,Mg2+ 2 mmol/L,dNTPs 0.2 mmol/L,10×Buffer 2 μL,其余由滅菌水補足。反應程序為94 ℃ 預變性5 min,94 ℃ 變性 30 s,50 ℃ 退火30 s,72 ℃ 延伸1 min,循環30次,72 ℃延伸10 min,最后4 ℃保存。
取擴增產物3 μL,與1 μL loading Buffer 混合,點樣于1.5%瓊脂糖凝膠上樣孔中,在1×TAE緩沖液中電壓120 V 電泳40 min,結束后使用Gel Red 染料泡染,凝膠成像系統成像,觀察記錄并分析各組條帶。
1.2.4 正交試驗數據統計與處理。
參照何正文等[9]方法,以條帶清晰、多態性好為指標,對各組條帶進行打分,多態性好且清晰記16分,反之則記1分。3次重復試驗評分數值采用SPSS 19軟件進行直觀分析、方差分析、多重比較。
2 結果與分析
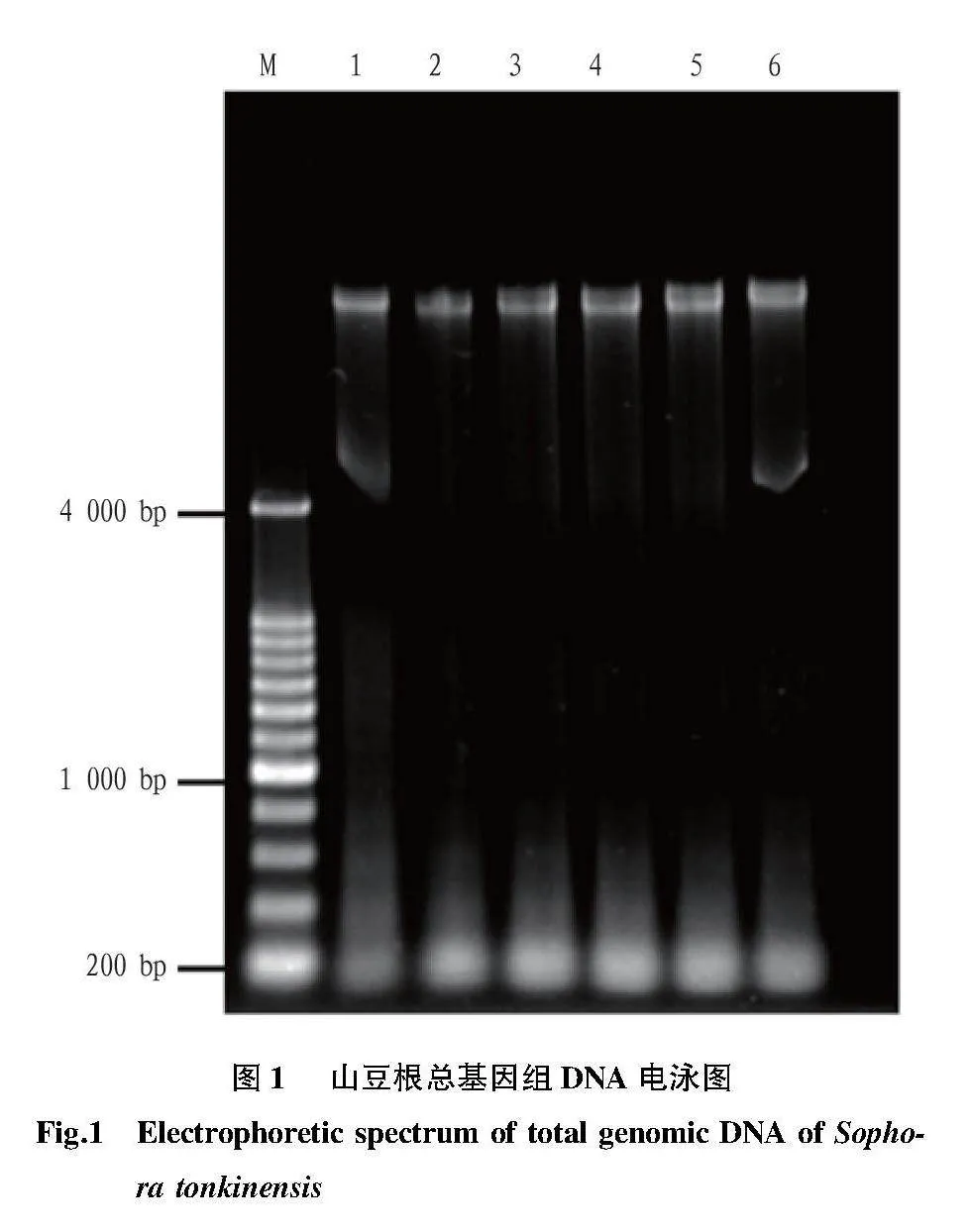
2.1 山豆根總基因組DNA
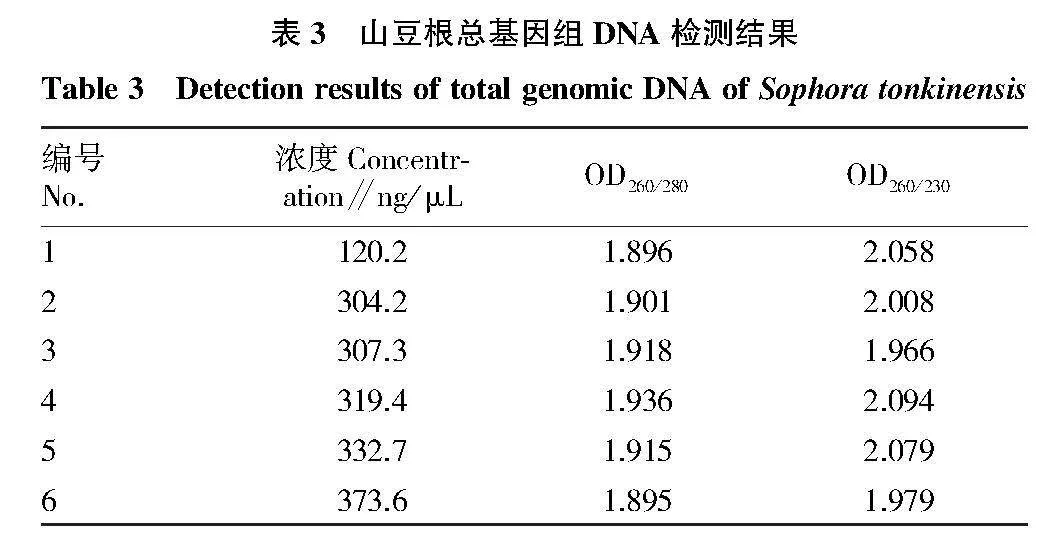
豆科植物山豆根總基因組DNA電泳、紫外檢測結果見表3、圖1,結果表明,該植物DNA的條
帶清晰明亮,有少量RNA污染;DNA的OD260/280的數值均在1.8~2.0,OD260/230的比值在1.9~2.1。
2.2 正交試驗結果
由于模板DNA、引物、Mg2+、dNTPs、Taq酶5個影響因素各水平的配比不同,擴增結果存在差異(圖2)。根據電泳結果對每組條帶評分,評分結果見表4。根據評分結果進行直觀分析、方差分析和多重比較。
2.2.1 正交試驗直觀分析。
正交試驗3次重復處理的平均值能夠反映各因素對反應體系的影響情況,根據3種藥用植物各重復處理評分結果進行直觀分析,結果見表5。①極差R大小表明各因素對反應體系的影響程度,山豆根各因素對反應體系的影響因素從大到小表現為Mg2+>模板DNA> dNTPs >Taq酶>引物;②同一因素均值最大所對應的水平為該因素最佳水平,山豆根的最佳水平為Mg2+水平4、dNTPs水平2、Taq酶水平2、引物水平4、模板DNA水平4。
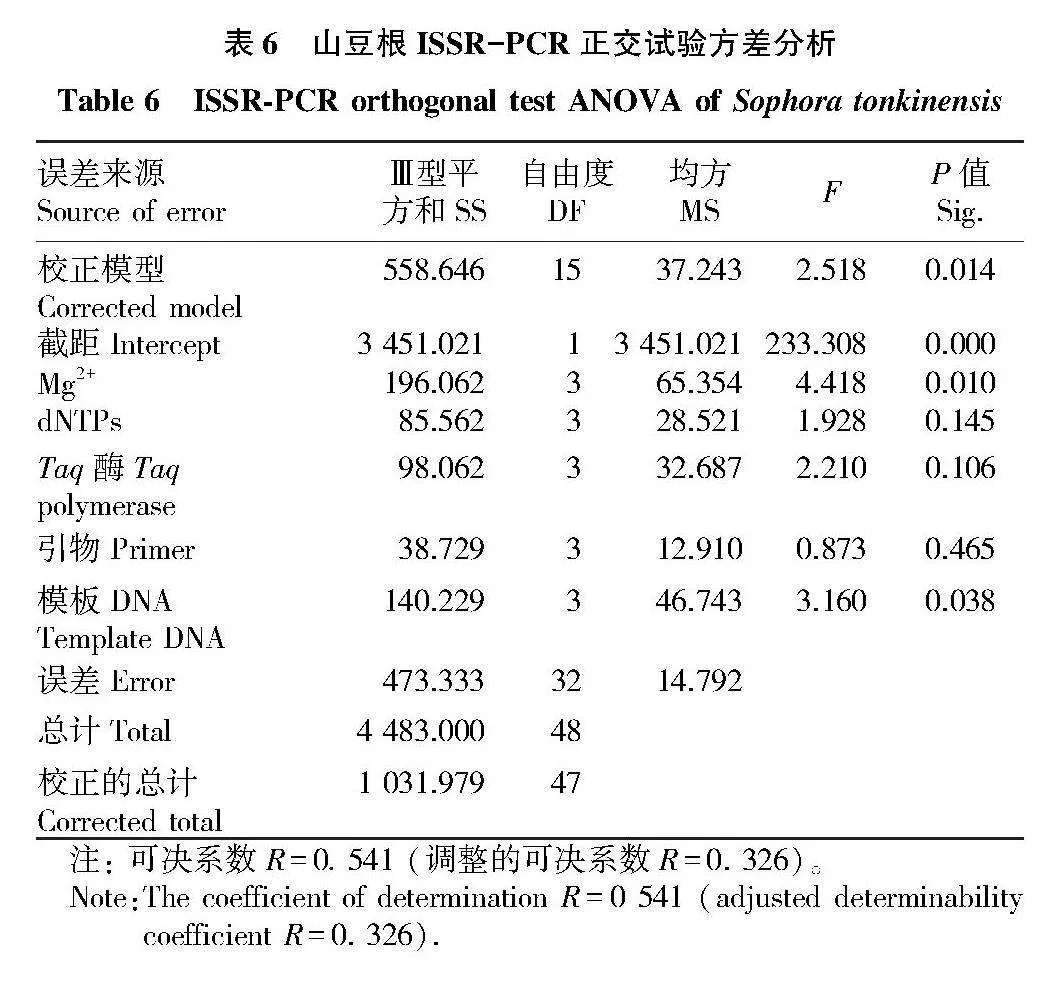
2.2.2 正交試驗方差分析。
為了進一步判斷各因素對山豆根ISSR-PCR體系的影響程度,對正交試驗評分結果進行方差分析。比較各因素F值,F值越大、表示該因素影響程度越大。
由表6可知,在山豆根ISSR-PCR反應體系的影響程度表現為Mg2+>模板DNA>Taq酶>dNTPs>引物,其中Mg2+和模板DNA具有顯著性(P<0.05),P值分別為0.010、0.038。
根據方差分析F值比較各因素對山豆根ISSR-PCR反應體系的影響程度,發現其結果與直觀分析結果不一致,但其最大的影響因素一致。正交試驗中的極差分析法僅具有方便直觀的特點,未經過統計學檢驗,而方差分析經過統計學檢驗更加準確。
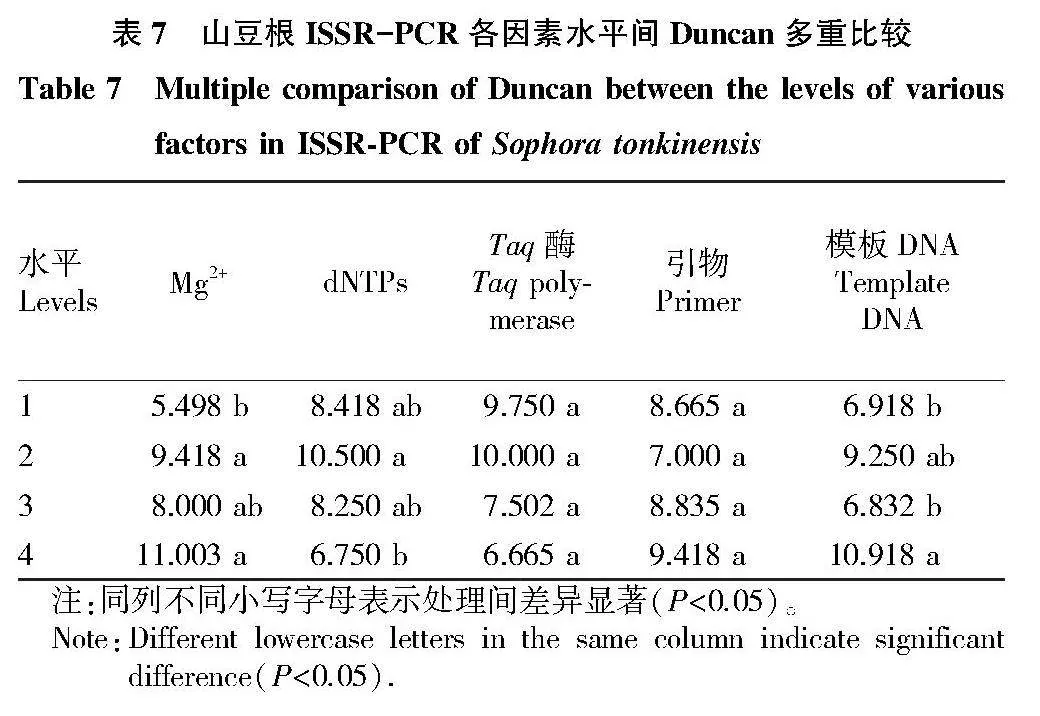
2.2.3 正交試驗Duncan多重比較。
為進一步確定山豆根ISSR-PCR反應體系中各因素的最佳水平,根據正交試驗結果對各因素進行Duncan多重比較分析,對同一因素4個水平的均值進行比較,判斷4個水平的差異顯著性。根據山豆根Duncan多重比較結果(表7)得知,Mg2+水平4均值最高,與水平1有顯著差異,因此選擇水平4為最佳水平,即3.0 mmol/L。dNTPs 水平2均值最高,與水平1、水平3差異不顯著,與水平4差異顯著,而水平4與水平1、水平3差異不顯著,因此選擇水平2為最佳水平,即0.2 mmol/L。在Taq 酶和引物因素中,4個水平無顯著差異,綜合考慮選擇均值最高的Taq酶水平2和引物水平4為最佳水平,分別為1.0 U和0.5 μmol/L。模板DNA因素中,水平4均值最高,與水平1、水平3有顯著差異,與水平2無顯著差異,因此選擇水平4為最佳水平,即100 ng。
綜上所述,根據方差分析和多重比較分析,確定山豆根的ISSR-PCR反應體系的最優條件:Mg2+ 3.0 mmol/L,dNTPs 0.2 mmol/L,Taq酶1.0 U,引物0.5 μmol/L,模板DNA 100 ng。
2.2.4 退火溫度的確定。
研究發現,退火溫度會直接影響引物與模板DNA的特異性結合。采用不同的退火溫度,擴增結果具有明顯的差異性。因此,對引物最佳退火溫度的確定是有必要的。選用UBC835引物,進行退火溫度梯度研究。8個梯度退火溫度分別為55.0、54.2、52.9、51.2、48.9、46.9、45.7、45.0 ℃。以條帶清晰度、數量為評價指標,由圖3可見泳道3條帶較清晰、數量較多,因此山豆根最佳退火溫度可確定為52.9 ℃。
2.2.5 ISSR引物的篩選與驗證。
對山豆根最佳反應體系進行100條UBC引物篩選。部分引物篩選結果見圖4和表8,結果表明山豆根的最佳反應體系均具有較高的重復性和穩定性。
3 討論
DNA質量的好壞對進行ISSR-PCR反應體系研究有一定影響,DNA雜質過多會導致后續DNA發生降解,從而影響ISSR-PCR體系的擴增效果[10-11]。在對植物DNA提取時發現,不同的采集時期,植物葉片中多糖、多酚、蛋白質等代謝產物含量不同,而新鮮嫩葉代謝產物含量較低且DNA含量高,而使用改良的CTAB方法對山豆根新鮮嫩葉進行提取,可以有效降低DNA雜質,提供DNA質量。退火溫度較低或較高都會影響ISSR-PCR擴增產物的質量,采用不同的退火溫度,擴增結果具有明顯差異[12],因此在體系優化中引物退火溫度的篩選是有必要的。
ISSR分子標記技術因具有方便、節約時間、反應靈敏及條件穩定等優點,在植物遺傳多樣性等研究分析中被廣泛應用[13]。但ISSR-PCR穩定擴增易受體系內各因素水平的影響[14],因此在利用ISSR分子標記技術對山豆根親緣關系、遺傳多樣性等分析之前,需要對ISSR-PCR反應體系進行優化。目前正交試驗法已成為優化ISSR-PCR反應體系試驗的主流方法,其綜合考慮了各影響因素的交互作用[15],并在廣西莪術[16]、夜來香[17]、通脫木[10]等植物中建立了ISSR-PCR最佳反應體系。該試驗采用正交試驗對ISSR-PCR反應體系進行優化,可快速確定最優水平,但設計中未考慮到各因素間的相互作用,降低了最佳水平的可靠程度[18]。在正交試驗數據處理上,采用直觀分析法、方差分析法和多重比較分析法,不同方法分析得到的結果有所不同。這可能與PCR反應的不穩定性有關,也可能是由于試驗結果采用主觀打分,人為主觀意識重、隨意性大,在一定程度上導致試驗的誤差[19-20]。
該試驗采用5因素4水平L16(45)正交表進行正交試驗設計,對山豆根進行ISSR-PCR反應體系優化,通過對5個因素進行直觀分析、方差分析和多重比較,確定其反應體系的最優條件。即山豆根ISSR-PCR反應體系(20 μL)的最優條件為Mg2+ 3.0 mmol/L,dNTPs 0.2 mmol/L,Taq酶1.0 U,引物0.5 μmol/L,模板DNA 100 ng。選用UBC835引物進行退火溫度篩選,并確定山豆根的最佳退火溫度為52.9 ℃。該體系的建立將為山豆根進一步利用ISSR分子標記技術開展相關研究奠定理論和技術基礎。
參考文獻
[1]
彭富海,趙偉,支永明,等.貴州石漠化地區山豆根高產栽培技術研究進展[J].耕作與栽培,2019,39(3):24-26.
[2] 鄢英慧,潘坤官,鄭芳.山豆根中毒反應92例回顧性分析[J].海峽藥學,2012,24(9):256-257.
[3] 程錢,王金鳳,王寶麗,等.山豆根化學成分、生物活性及質量控制研究進展[J].遼寧中醫藥大學學報,2017,19(7):119-125.
[4] 姜帥,張佳,王穎莉,等.黃酮醇類化合物在虎耳草科中的分布[J].中國現代中藥,2015,17(7):739-746.
[5] 陸群,朱路佳,薛潔,等.肝炎靈對實驗性慢性肝損傷的治療作用[J].蘇州醫學院學報,2001,21(5):517-519.
[6] 陳影,陳兩綿,仝燕,等.山豆根藥理毒理研究進展[J].中國中藥雜志,2017,42(13):2439-2442.
[7] ZIETKIEWICZ E,RAFALSKI A,LABUDA D.Genome fingerprinting by simple sequence repeat (SSR)-anchored polymerase chain reaction amplification[J].Genomics,1994,20(2):176-183.
[8] 劉本英,李友勇,唐一春,等.云南茶樹資源遺傳多樣性與親緣關系的ISSR分析[J].作物學報,2010,36(3):391-400.
[9] 何正文,劉運生,陳立華,等.正交設計直觀分析法優化PCR條件[J].湖南醫科大學學報,1998,23(4):403-404.
[10] 孫菲菲,韋霄,鄒蓉,等.通脫木ISSR-PCR反應體系的建立及引物篩選[J/OL].分子植物育種,2022-03-08[2023-04-25].https://kns.cnki.net/kcms/detail/46.1068.s.20220307.1112.012.html.
[11] 黃敏,黃旭萍,李斌奇,等.楓香ISSR-PCR反應體系的優化及引物篩選[J].分子植物育種,2023,21(9):2991-2998.
[12] 趙麗華.石榴ISSR-PCR反應體系的正交設計優化[J].北方園藝,2010(19):148-152.
[13] 包金花,楊恒山,莊得鳳,等.金蓮花ISSR-PCR反應體系的建立與優化[J].分子植物育種,2021,20(1):202-209.
[14] 林琿,汪偉裁,李大忠,等.苦瓜ISSR-PCR反應體系的建立與優化[J].分子植物育種,2018,16(4):1184-1189.
[15] 陳吉祥,尹海波,王丹,等.遼產龍膽ISSR-PCR反應體系的建立及遺傳多樣性分析[J].時珍國醫國藥,2022,33(7):1722-1726.
[16] 林敬禎,甘梓靜,譚勇,等.廣西莪術ISSR-PCR反應體系優化及引物篩選[J].生物技術,2023,33(4):422-428,441.
[17] 覃創羿,王曉南,魯宗翰,等.夜來香ISSR-PCR反應體系的建立及引物篩選[J/OL].分子植物育種,2023-02-17[2023-04-25].https://kns.cnki.net/kcms/detail//46.1068.s.20230215.1711.012.html.
[18] 黎曉英,李俊威,劉勝貴,等.天麻基因組DNA不同提取方法比較[J].安徽農業科學,2019,47(22):111-112,174.
[19] 吳春妍,楊冠松,張愛麗,等.甜菜樹ISSR-PCR反應體系的建立與優化[J].西南農業學報,2014,27(6):2574-2579.
[20] 楊曉霞,鄭健,冷平生,等.暴馬丁香ISSR-PCR反應體系優化及引物篩選[J].分子植物育種,2014,12(5):1018-1026.

