液相色譜-串聯質譜法測定乳品中氟苯尼考和氟苯尼考胺殘留量

摘 要:目的:建立液相色譜-串聯質譜法測定乳品中氟苯尼考和氟苯尼考胺殘留量的方法。方法:乳品試樣用2%氨化乙酸乙酯溶液提取,經正己烷脫脂,再用2%氨化乙酸乙酯溶液反萃取,濃縮過膜后上機測試。結果:氟苯尼考和氟苯尼考胺在1~50 μg·L-1線性關系良好,檢出限為0.5 μg·kg-1,定量限為1 μg·kg-1,加標回收率為82.5%~100.4%,RSD為3.35%~6.98%。結論:該方法適用于乳品中氟苯尼考和氟苯尼考胺殘留量的定性、定量分析。
關鍵詞:液相色譜-串聯質譜法;乳品;氟苯尼考;氟苯尼考胺
Determination of Flufenicol and Flufenicol Amine Residues in Dairy Products by Liquid Chromatography-Tandem Mass Spectrometry
XU Shuran
(Shenzhen Academy of Metrology & Quality Inspection, Shenzhen 518000, China)
Abstract: Objective: To establish a method for the determination of flufenicol and flufenicol amine residues in dairy products by liquid chromatography-tandem mass spectrometry. Method: Milk samples were extracted with 2% ethyl acetate solution, defatted with n-hexane, then back extracted with 2% ethyl acetate solution, concentrated and tested by machine. Result: The linear relationship between flufenicol and flufenicol amine was good in the range of 1~50 μg·L-1. The limit of detection was 0.5 μg·kg-1, the limit of quantitation was 1 μg·kg-1, the recoveries were 82.5% to 100.4%, and the RSD was 3.35% to 6.98%. Conclusion: The method is suitable for the qualitative and quantitative analysis of flufenicol and flufenicol amide residues in dairy products..
Keywords: liquid chromatography-tandem mass spectrometry; dairy food; flufenicol; flufenicol amide
氯霉素類藥物包括氯霉素、甲砜霉素、氟苯尼考(Flufenicol,FF)等,常用來治療牲畜和家禽的細菌性呼吸系統與腸道系統感染,療效很好[1]。在氯霉素因損害人體造血系統,相繼被歐盟和我國列入動物源性產品禁用名單后,氟苯尼考憑借其抗菌效果相當、價格便宜、毒副作用小等優勢,成為氯霉素的替代品,被大量用于牲畜飼養、家禽養殖中預防和治療疾病。然而,經研究表明氟苯尼考在畜禽體內具有胚胎毒性,人體長期攝入氟苯尼考及其代謝物氟苯尼考胺(Flufeni colamide,FFA)也會對健康產生威
脅[2-4]。近年來,我國乳品行業發展迅速,產量和總產值增長在10倍以上,乳制品消費市場前景廣闊。然而,在奶牛養殖過程中也會使用到FF等氯霉素類藥物。如果養殖企業違規使用抗生素或不按規定執行休藥期,就會導致乳品中FF和FFA殘留,影響消費者健康。因此,本研究參照《食品安全國家標準 動物性食品中酰胺醇類藥物及其代謝物殘留量的測定 液相色譜-串聯質譜法》(GB 31658.20—2022)[5],建立了液相色譜-串聯質譜法(Liquid Chromatography-Tandem Mass Spectrometry,LC-MS)測定乳品中FF及FFA殘留量的分析方法,旨在為奶牛養殖或乳品生產企業加強品控、檢驗檢測機構加強監管提供技術支撐。
1 材料與方法
1.1 材料與試劑
某品牌純牛奶,購自某超市。
甲醇中FF/FFA混標[編號GBW(E)083592,濃度為100 mg·L-1],中國農業科學院;甲醇中FF-D3(編號91884a,濃度為100 μg·mL-1)、甲醇中FFA-D3(編號91854a,濃度為100 μg·mL-1),均購自壇墨質檢科技股份有限公司;甲醇、乙腈,美國賽默飛公司;乙酸乙酯、正己烷(色譜純),德國默克公司;氨水(分析純),山東星菲化學有限公司;無水硫酸鈉、氯化鈉、甲酸銨(分析純),天津市大茂化學試劑廠。
1.2 儀器與設備
TSQ Quantis高效液相色譜質譜聯用儀,美國賽默飛公司;GL2202-1SCN分析天平(精度0.01 g),德國賽多利斯公司;HT190R高速臺式冷凍離心機,湖南湘儀實驗室儀器開發有限公司;HSC-B水浴氮吹儀,天津市恒奧科技發展有限公司;Multi Reax多管旋渦振蕩器,德國海道爾夫公司;VORTEX MS3渦旋混合儀,德國艾卡公司。
1.3 標準系列溶液配制
(1)混合標準中間液(5 μg·mL-1)。準確吸取0.5 mL濃度為100 mg·L-1的甲醇中FF/FFA混標于10 mL容量瓶中,用甲醇稀釋定容至刻度,配制成FF/FFA混合標準中間液。
(2)混合內標中間液(5 μg·mL-1)。分別吸取0.5 mL濃度為100 μg·mL-1的甲醇中FF-D3、甲醇中FFA-D3于10 mL容量瓶中,用甲醇稀釋定容至刻度,配制成FF-D3與FFA-D3混合內標中間液。
(3)混合內標工作液(50 μg·L-1)。準確吸取0.1 mL濃度為5 μg·mL-1的FF-D3與FFA-D3混合內標中間液于10 mL容量瓶中,用20%甲醇溶液稀釋定容至刻度,配制成FF-D3與FFA-D3混合內標工作液。
(4)混合標準工作系列溶液。分別吸取2 μL、5 μL、10 μL、20 μL、50 μL和100 μL濃度均為5 μg·mL-1的FF與FFA混合標準中間液于6個10 mL容量瓶中,再向各容量瓶中加入1.0 mL濃度為50 μg·L-1的FF-D3與FFA-D3混合內標工作液,用20%甲醇溶液稀釋定容至刻度,配制成濃度均為1.0 μg·L-1、2.5 μg·L-1、5.0 μg·L-1、10.0 μg·L-1、25.0 μg·L-1和50.0 μg·L-1的FF與FFA混合標準工作系列溶液,FF-D3與FFA-D3濃度均為5 μg·L-1的混合標準工作系列溶液。
1.4 試樣處理
稱取2 g(精確至0.01 g)混勻的乳品試樣于50 mL離心管中,加入100 μL混合內標工作液,渦旋混勻,再加入10 mL 2%氨化乙酸乙酯溶液、3 g無水硫酸鈉,置于多管旋渦振蕩器上渦旋振蕩10 min,使用8 000 r·min-1冷凍離心機離心5 min,將離心后的上清液轉移入另一支離心管中,在殘渣中加入10 mL 2%氨化乙酸乙酯溶液,重復渦旋提取一次,離心,合并兩次上清液,置于水溫50 ℃的氮吹儀上吹干,待凈化。
向待凈化的殘渣中加入3 mL 4%氯化鈉溶液,渦旋使殘渣溶解。加入5 mL 4%氯化鈉飽和的正己烷,渦旋混勻,使用8 000 r·min-1冷凍離心機離心5 min,棄去上層溶液,再重復脫脂一次。加入5 mL 2%氨化乙酸乙酯溶液,置于多管旋渦振蕩器上渦旋振蕩5 min,使用8 000 r·min-1冷凍離心機離心5 min,取上層有機相,重復萃取一次,合并兩次萃取后的有機相,置于水溫50 ℃的氮吹儀上吹干,加入1.0 mL 20%甲醇溶液復溶,渦旋混勻,過0.22 μm濾膜后上機測定。
1.5 儀器分析條件
1.5.1 液相色譜條件
色譜柱:Hypersil GOLD(100 mm×2.1 mm,1.9 μm);柱溫:40 ℃;流速:0.3 mL·min-1;進樣量:1 μL;流動相:0.1%甲酸水(A)+乙腈(B);梯度洗脫程序:0~0.5 min、90%A+10%B,0.5~2.0 min、90%A+10%B,2.0~3.5 min、5%A+95%B,3.5~3.6 min、90%A+10%B,3.6~5.0 min、90%A+10%B。
1.5.2 質譜測試條件
電離方式:電噴霧電離;離子源:FF與FF-D3為ESI-,FFA與FFA-D3為ESI+;掃描方式:多反應監測;毛細管電壓:3 500 V;離子源溫度:350 ℃;鞘氣壓力:45 Arb;輔助氣壓力:10 Arb;監測離子(m/z):FF 356.0>185.0、356.0>219.0(定性),356.0>336.0(定量);FFA 356.0>219.0、248.0>130.0(定性),248.0>230.0(定量);FF-D3 359.2>339.0(定性),359.2>339.0(定量);FF-D3 251.2>233.1(定性),251.2>233.1(定量)。
2 結果與分析
2.1 方法的線性關系
將配制的混合標準工作系列上機測定,以混合標準工作系列中FF和FFA的濃度為橫坐標,相對應測得的定量離子峰與內標峰面積之比為縱坐標,繪制標準工作曲線,由儀器配置的工作站自動計算線性方程與相關系數。由表1可知,FF和FFA在1~50 μg·L-1,線性關系良好,相關系數R2均大于0.99,滿足相關標準對線性的要求。
2.2 方法的檢出限與定量限
稱取2 g純牛奶陰性樣品,添加50 μL FF和FFA濃度均為50 μg·L-1的混合標準溶液,按照1.4試樣處理過程進行試樣前處理,在1.5儀器分析條件下分析測定,以FF和FFA測得定量離子峰面積與基線的信噪比S/N≥3對應的濃度來確定方法的檢出限,以信噪比S/N≥10對應的濃度來確定方法的定出限。結果表明,FF和FFA的檢出限均為0.5 μg·kg-1,定量限均為1 μg·kg-1,檢出限與定量限均符合方法標準GB 31658.20—2022中靈敏度的要求。
2.3 加標回收率及精密度
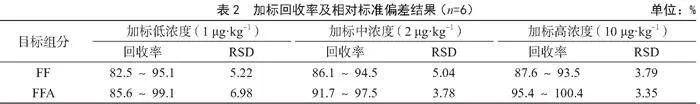
選擇陰性純牛奶為加標樣品,按照1倍、2倍、10倍定量限對應的含量,分別添加低(1 μg·kg-1)、中(2 μg·kg-1)、高(10 μg·kg-1)3個濃度水平的FF/FFA混合標準溶液,按照1.4試樣處理過程進行試樣前處理,在1.5儀器分析條件下分析測定,加標試樣的各個濃度水平均平行測定6次,計算加標回收率與相對標準偏差(Relative Standard Deviation,RSD)。由表2可知,FF加標回收率為82.5%~95.1%,RSD為3.79%~5.22%;FFA加標回收率為85.6%~100.4%,RSD為3.35%~6.98%,回收率與精密度符合GB 31658.20—2022關于準確度和精密度的要求。
3 結論
本研究參照GB 31658.20—2022,建立了LC-MS法測定乳品中FF及其代謝物FFA殘留量的分析方法,FF和FFA在1~50 μg·L-1線性關系良好,檢出限均為0.5 μg·kg-1,定量限均為1 μg·kg-1,加標回收率在82.5%~100.4%,RSD在3.35%~6.98%,可以為乳品中FF及其代謝物FFA殘留量提供確證方法,有助于檢驗檢測機構加強乳品中獸藥殘留的監控能力。
參考文獻
[1]鄭陸紅,張慧瓊,陳茹,等.超高效液相色譜-串聯質譜法同時測定動物組織中氯霉素、甲砜霉素、氟苯尼考和其代謝產物氟苯尼考胺殘留量[J].現代食品,2022,28(20):198-203.
[2]卜寧霞,陳娟,李永琴,等.雞蛋中酰胺醇類藥物及其代謝物殘留檢測超高效液相色譜-串聯質譜法建立[J].藥物分析雜志,2022,42(9):1625-1633.
[3]辛曉晨,衛瑾瑾,鹿塵,等.通過式固相萃取/超高效液相色譜-串聯質譜法測定雞蛋中氯霉素、氟苯尼考和氟苯尼考胺殘留[J].中國食品衛生雜志,2023,35(9):1297-1303.
[4]劉迪,王會霞,黃坤,等.同位素稀釋-液相色譜-串聯質譜法測定肉制品中氟苯尼考及代謝物氟苯尼考胺殘留[J].中南農業科技,2024,45(7):58-62.
[5]中華人民共和國農業農村部,中華人民共和國國家衛生健康委員會,國家市場監督管理總局.食品安全國家標準 動物性食品中酰胺醇類藥物及其代謝物殘留量的測定 液相色譜-串聯質譜法:GB 31658.20—2022[S].北京:中國農業出版社,2022.
作者簡介:徐舒然(1995—),女,廣東深圳人,本科。研究方向:食品安全問題。

