Exendin-4對小鼠黑質網狀部神經元自發放電影響
[摘要]目的探究胰高血糖素樣肽-1(GLP-1)受體激動劑Exendin-4對小鼠黑質網狀部神經元自發放電的影響。
方法采用免疫熒光染色觀察GLP-1受體(GLP-1R)在小鼠黑質網狀部的表達。使用在體電生理微電極注射10 μmol/L的 Exendin-4到小鼠黑質網狀部神經元表面,觀察黑質網狀部非多巴胺能(假定為γ-氨基丁酸能)神經元的自發放電變化。
結果免疫熒光染色結果顯示,小鼠黑質網狀部有GLP-1R的高表達。在所記錄到的13個黑質網狀部神經元中,Exendin-4可顯著降低其中9個神經元的自發放電,其放電頻率由加藥前(18.62±3.19)Hz降低到(14.615±3.06)Hz,差異有顯著性(t=7.257,P<0.05);其放電頻率平均降低(21.85±7.72)%,較生理鹽水組的(1.15±9.67)%顯著升高(Z=2.282,P<0.05)。在另外的4個黑質網狀部神經元中,Exendin-4對放電頻率無明顯影響,其放電頻率由(13.49±7.16)Hz變為(13.54±7.45)Hz,差異無顯著性。
結論Exendin-4能降低部分黑質網狀部神經元的自發放電頻率。
[關鍵詞]艾塞那肽;黑質;網狀部;胰高血糖素樣肽-1受體;電生理學;小鼠, 近交C57BL
[中圖分類號]R977.15;R322.81
[文獻標志碼]A
[文章編號]2096-5532(2024)04-0491-05doi:10.11712/jms.2096-5532.2024.60.092
[開放科學(資源服務)標識碼(OSID)]
[網絡出版]https://link.cnki.net/urlid/37.1517.R.20240726.0930.004;2024-07-2616:42:48
Effect of Exendin-4 on the spontaneous discharge of neurons in the substantia nigra pars reticulata of mice
SHEN Fangshuai, LI Xiaoxue, LIU Cui, CHEN Xinyi, XUE Yan, CHEN Lei
(Department of Physiology and Pathophysiology, School of Basic Medicine, Qingdao University Medical College, Qingdao 266071, China); [Abstract]ObjectiveTo investigate the effectof Exendin-4, a glucagon-like peptide-1 (GLP-1) receptor agonist, on the spontaneous discharge of neurons in the substantia nigra pars reticulate of mice.
MethodsImmunofluorescent staining was used to observe the expression of GLP-1receptor (GLP-1R) in the substantia nigra pars reticulata of mice. Extendin-4 10 μmol/L were injected onto the surface of neurons in the substantia nigra pars reticulate using in vivo electrophysiological microelectrodes to observe the spontaneous discharge of non-dopaminergic neurons (assumed to be GABAergic neurons) in the substantia nigra pars reticulate.
ResultsImmunofluorescent staining showed a high expression level of GLP-1R in the substantia nigra par reticulate of mice. As for the 13 neurons recorded in the substantia nigra par reticulata, Exendin-4 significantly reduced the spontaneous discharge rate of 9 neurons, with a significant reduction in discharge frequency from (18.62±3.19) Hz to (14.615±3.06) Hz (t=7.257,P<0.05), and the discharge frequency was reduced by (21.85±7.72)% on average, which was significantly higher than the reduction rate of (1.15±9.67)% in the normal saline group (Z=2.282,P<0.05). In the other 4 neurons, Exendin-4 had no signi-
ficant effect on discharge frequency, which changed from (13.49±7.16) Hz to (13.54±7.45) Hz.
ConclusionExendin-4 can reduce the spontaneous discharge frequency of some neurons in the substantia nigra pars reticulata.
[Key words]exenatide; substantia nigra; pars reticulata; glucagon-like peptide-1 receptor; electrophysiology; mice, inbred C57BL
胰高血糖素樣肽-1(GLP-1)受體(GLP-1R)是一種G蛋白偶聯受體[1]。GLP-1R激動劑被許可用于治療2型糖尿病,其作用是刺激胰腺中的GLP-1R,從而觸發胰島素的釋放。同時,研究發現大腦中廣泛存在GLP-1R的表達[2-3]。黑質網狀部主要由γ-氨基丁酸(GABA)能神經元構成,神經元數量相對黑質致密部較為稀疏。黑質網狀部GABA能神經元群是調控運動和覺醒睡眠的中樞部位[4-5]。這些GABA能神經元整合廣泛的輸入,并通過神經傳導支配多個促覺醒和運動控制回路[4]。在帕金森病(PD)中,不僅伴隨著黑質致密部多巴胺能神經元放電變化,還有黑質網狀部GABA能神經元接受來自丘腦底核的興奮性輸入,這些神經元被過度激活最終抑制丘腦和運動皮質活動[5-6]。近年來,越來越
多的研究結果表明GLP-1R激動劑在PD中對神經元起保護作用,能夠改善PD臨床表現中的運動和非運動缺陷[7-8]。然而,GLP-1R激動劑是否能調控黑質網狀部的GABA能神經元從而參與運動控制,目前尚不明確。本實驗使用免疫熒光染色和在體電生理記錄的方法,探究GLP-1R激動劑Exendin-4對小鼠黑質網狀部GABA能神經元自發放電的影響。現將結果報告如下。
1材料與方法
1.1實驗材料
1.1.1主要試劑及來源Exendin-4購自英國Tocris公司,氨基甲酸乙酯(又稱烏拉坦)購自上海麥克林生化科技有限公司,乙酸鈉和滂胺天藍購自美國Sigma公司。GLP-1抗體購自美國AbclonawnezZ0YQSvIX4Jn1+/0JEA==l公司;山羊抗兔二抗購自英國Abcam公司;酪氨酸羥化酶(TH)抗體購于英國Abcam公司。
1.1.2動物選擇及處理7~8周的雄性C57小鼠由濟南市朋悅實驗動物繁育有限公司提供。小鼠飼養在室溫(23±1)℃、12 h-12 h晝夜循環光照、濕度50%~60%的實驗環境中,具備自由進食和飲水的條件。小鼠適應環境1周后用于實驗。動物使用符合實驗醫學倫理學要求。
1.2實驗方法
1.2.1在體細胞外電生理記錄小鼠腹腔注射200 g/L烏拉坦(1 g/kg體質量)進行麻醉,實驗中使用恒溫加熱板維持實驗動物體溫穩定。麻醉后對小鼠進行腦立體定位手術(前囟后2.8~3.6 mm,旁開1.0~2.0 mm,深度4.0~5.0 mm)。使用微玻璃電極拉制儀拉制三管電極,其中一支記錄電極中加入含有0.5 mol/L乙酸鈉和20 g/L滂胺天藍染料的混合液,其余兩支電極則分別加入10 μmol/L的Exendin-4[9]和生理鹽水。在體細胞外電生理記錄過程中,觀察放電頻率及形狀,通常認為黑質網狀部神經元放電若為非多巴胺能神經元放電即可假設為GABA能神經元[10]。多巴胺能神經元放電頻率通常在4~6 Hz范圍內[10],易于辨認。小鼠腦中的生物電信號被信號放大器和數模轉化器擴大,應用Spike2軟件收集、記錄并處理放大后的電信號。當電極尖端到達黑質網狀部并記錄到穩定的神經元自發放電300 s后,通過生物細胞納升注射器將上述藥物注射到神經元表面,觀察藥物對神經元放電頻率及放電模式的影響。神經元的基礎放電頻率為給藥前120 s的平均頻率,加藥后的反應頻率為加藥后反應高峰處50 s的平均頻率。如果給藥后神經元放電頻率的變化超過基礎放電頻率均數±2個標準差,則認為該神經元對該藥物有反應,否則認為該神經元為無反應神經元。
1.2.2免疫熒光染色小鼠深度麻醉后,經心臟先后灌注冰冷生理鹽水和40 g/L多聚甲醛,之后斷頭取腦,將鼠腦浸泡于40 g/L多聚甲醛溶液中并置4 ℃冰箱固定6~8 h。之后,腦組織先后浸泡于200和300 g/L蔗糖溶液脫水,直至腦組織自動沉到溶液底部。然后,使用冰凍切片機進行切片,腦片厚度為20 μm,取含有黑質的腦片進行免疫染色。將腦片以磷酸鹽緩沖液(PBS)沖洗3次,每次置于搖床5 min,室溫孵育并以體積分數0.05的胎牛血清封閉1~2 h。棄去封閉血清后加一抗,于4 ℃冰箱搖床孵育8 h。吸出一抗,用PBS沖洗3次后加二抗鼠源TH抗體和兔源GLP-1R抗體,室溫孵育1 h。充分沖洗二抗后將腦片貼附于經多聚賴氨酸處理的載玻片上,腦片晾干后滴加抗熒光淬滅封片劑,蓋上蓋玻片。在奧林巴斯熒光顯微鏡下觀察免疫熒光反應并拍攝圖像。
1.3統計學處理
使用SPSS 26軟件進行統計學分析。所得計量資料數據以±s形式表示,神經元加藥前后的放電頻率均數比較采用配對t檢驗;兩組計數資料數據神經元自發放電頻率變化率以百分數表示,兩組比較采用曼-惠特尼秩和檢驗。以P<0.05為差異具有統計學意義。
2結果
2.1黑質網狀部神經元GLP-1R的表達
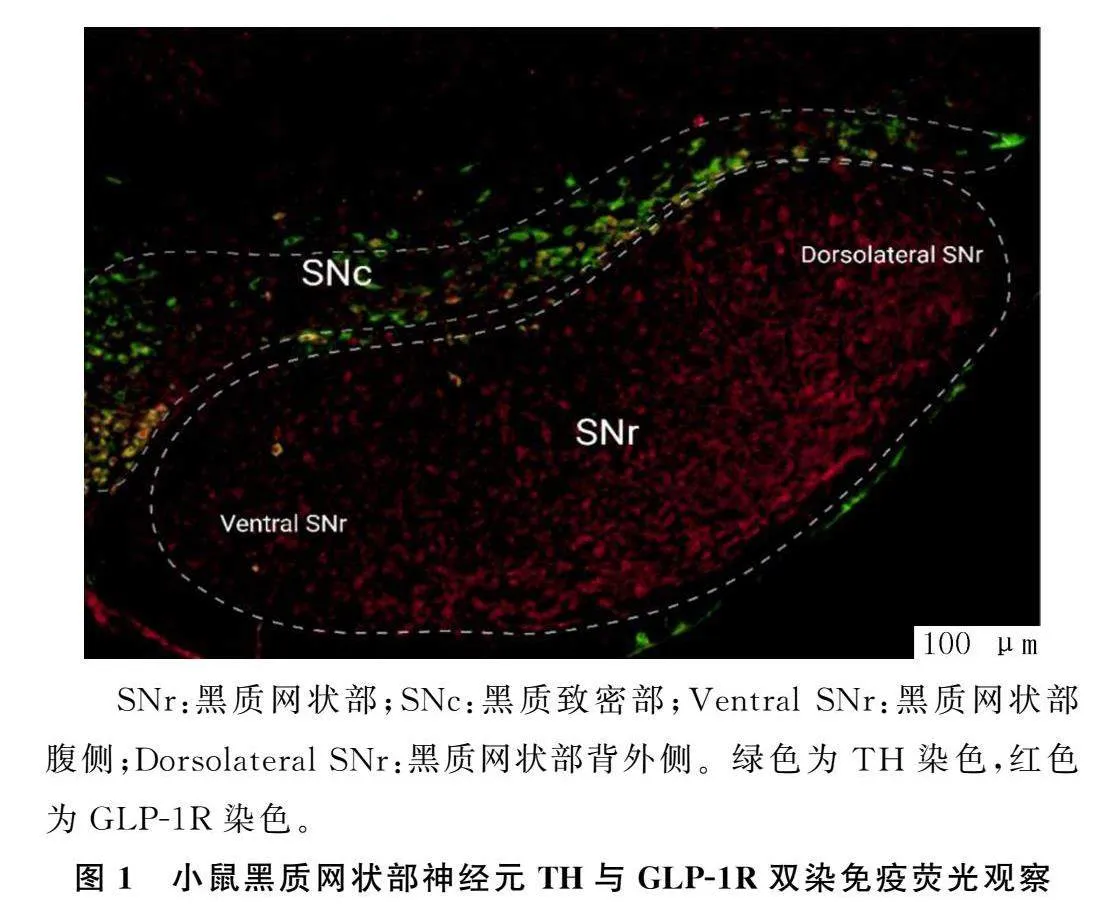
免疫熒光染色顯示,黑質網狀部神經元有大量的GLP-1R表達,尤其是在黑質網狀部的背外側部。提示正常小鼠黑質網狀部的神經元活動很有可能受到GLP-1及其受體激動劑的調控。見圖1。
2.2Exendin-4對黑質網狀部神經元自發放電頻率影響
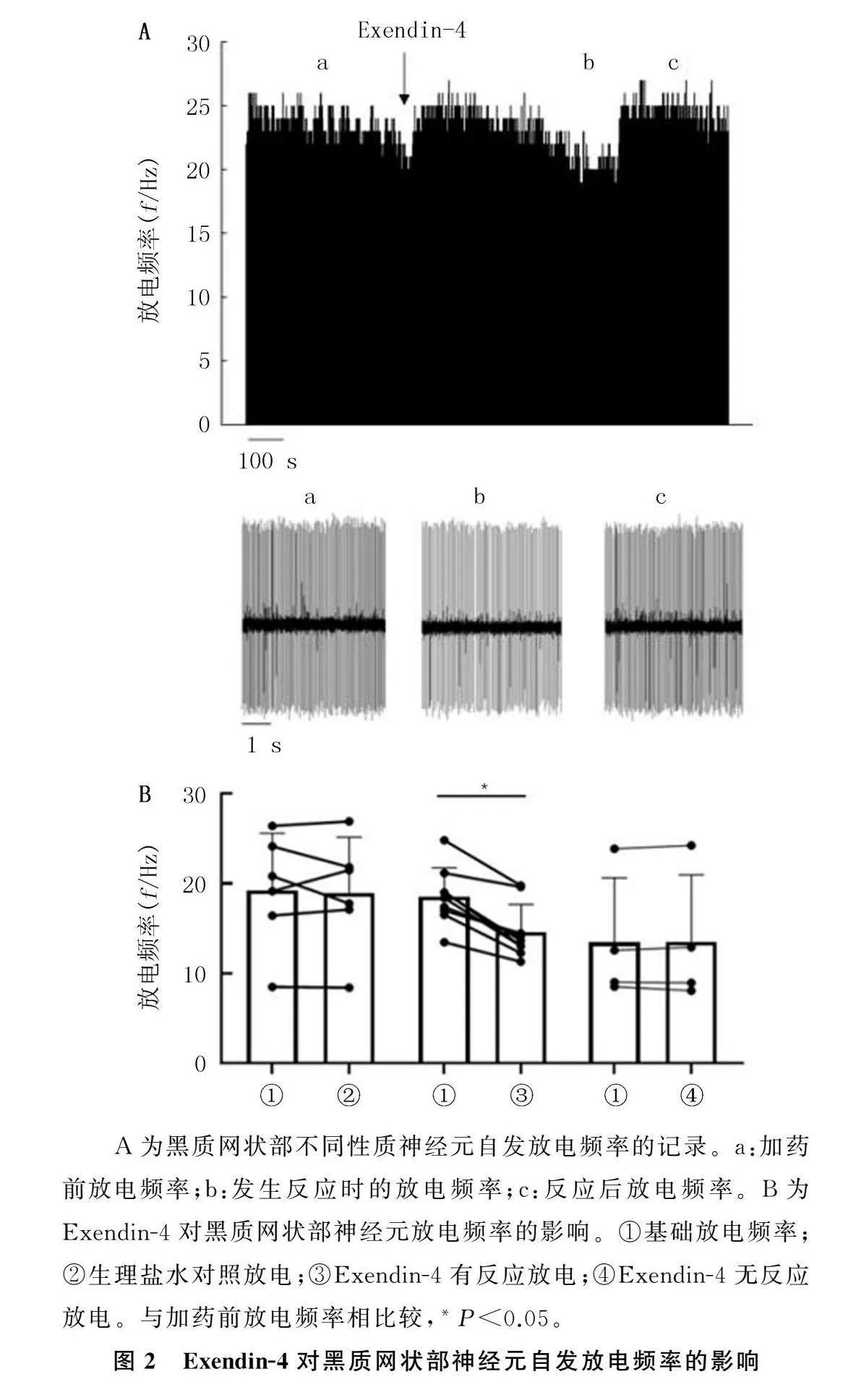
在記錄到的6個黑質網狀部神經元中,微壓力注射生理鹽水后,其放電頻率由(18.05±7.57)Hz變為(17.56±7.58)Hz,差異無顯著性(t=0.562,P=0.614);平均反應百分數為(1.15±9.67)%。在微壓力給予10 μmol/L的 Exendin-4后所記錄到的10個黑質網狀部神經元中,Exendin-4能夠顯著降
低其中9個神經元的自發放電,其放電頻率由加藥SNr:黑質網狀部;SNc:黑質致密部;Ventral SNr:黑質網狀部腹側;Dorsolateral SNr:黑質網狀部背外側。綠色為TH染色,紅色為GLP-1R染色。
前(18.62±3.19)Hz降低到(14.62±3.06)Hz,差異有顯著性(t=7.257,P<0.05);放電頻率平均降低(21.85±7.72)%,與生理鹽水組比較差異有顯著性(Z=2.282,P<0.05)。在另外的4個黑質網狀部神經元中,Exendin-4對放電頻率無明顯影響,其放電頻率由(13.49±7.16)Hz變為(13.54±7.45)Hz,差異無顯著性(t=-0.247,P=0.821)。見圖2。
2.3Exendin-4對黑質網狀部神經元放電模式影響
通過計算放電間隔直方圖和自相關圖對黑質網狀部神經元的放電模式進行分析,本實驗只記錄到一種黑質網狀部神經元基礎放電模式,即規律性放電。在給予Exendin-4后,神經元放電模式與加藥前比較顯示,在對Exendin-4有反應的9個和無反應的4個神經元中,Exendin-4均不改變神經元的放電模式。
3討論
黑質網狀部的GABA能神經元在正常生理條件下參與機體的運動控制和覺醒[4-5]。尤其是黑質網狀部谷氨酸脫羧酶2(GAD2)陽性的GABA能神經元的共同激活或失活,介導了自主行為方向的轉變、促進或抑制睡眠。這類GAD2陽性的GABA能神經元整合廣泛的輸入,并通過廣泛的側支投射來支配多個促覺醒和運動控制環路[4]。在疾病條件下,黑質網狀部GABA能神經元非正常放電引起癲癇的癥狀發生。許多調控黑質網狀部GABA能神經元放電的藥物被證實可以減輕癲癇癥狀的發生并用于治療[11]。此外,在PD的經典環路理論中,黑質網狀部GABA能神經元接受來自丘腦底核谷氨酸能神經元的興奮性輸入,導致GABA能神經元過
分激活,GABA釋放過量,造成丘腦和運動皮質被抑制。因此,黑質網狀部GABA能神經元的放電活動對機體的運動控制功能非常重要。
以往的文獻報道,大腦中GLP-1R的激活通常可以抑制電壓門控的鉀通道開放,增加神經元放電頻率,加強神經遞質的釋放[8]。有研究表明,GLP-1R激動劑利拉魯肽增加了來自未飲酒大鼠的中央杏仁核(CeA)和邊緣下區(ILC)神經元的自發抑制性突觸后電流頻率,表明GABA釋放增強[12]。然而與之前研究不同的是,本實驗表明給予Exendin-4可以降低部分黑質網狀部GABA能神經元的自發放電頻率。這可能是GLP-1R通過激活ERK1/2的不同作用來實現下游表達的多樣性所導致的[1]。有研究結果表明,GLP-1R激活的結果可能因空間和時間因素而異,其中區室化可能導致下游信號的
激活受到抑制,這種微結構域的形成已被證明影響
GLP-1R信號傳導,例如PKA誘導的ERK1/2的激活已被證明是短暫的,并導致其易位到細胞核[13-14]。這種藥物的效果差異可能來源于網狀部GABA能神經元的高頻放電和腦區環路的不同,本實驗神經元放電頻率抑制效果的信號機制需要進一步的實驗探究。GLP-1或Exendin-4可通過分離的大鼠視網膜神經節細胞中的GLP-1R抑制γ-氨基丁酸受體介導的電流。預孵育刺激性G蛋白抑制劑消除了Exendin-4的作用。此外,當鈣調素和鈣調素依賴性蛋白激酶Ⅱ的活性被抑制時,Exendin-4效應被消除[15]。然而,NPY/AgRP神經元中的電生理研究表明,GLP-1通過增加GABAA受體介導的局部GABA能中間神經元的GABA神經傳遞間接抑制了NPY神經元超極化。同時,GLP-1可能引起神經元鉀離子通道開放抑制其超極化和放電頻率,最終使得小鼠在黑暗中進食被抑制[16-17]。最后,在黑暗條件下,將GLP-1注射到終紋床核神經元中減少了食物攝入,而注射GLP-1R拮抗劑Exendin9-39增加了進食[17]。終紋床核神經元的全細胞膜片鉗記錄表明,GLP-1能引發可逆性神經元去極化或超極化反應[17-18]。這些研究表明,GLP-1R激活可能引起神經元發生復雜的放電反應[17]。本實驗結果符合Exendin-4等GLP-1類似物或者激動劑改善運動障礙的研究結論。然而,未來需要在PD動物模型上進一步確認GLP-1R激動劑是否能降低黑質網狀部GABA能神經元的放電頻率,以及聯合給予GLP-1R阻斷劑來確認Exendin-4和內源性GLP-1對此類神經元的調控作用。許多研究已經證明,Exendin-4等GLP-1R激動劑在PD模型中有神經保護作用,可改善運動和非運動缺陷[7,19-24]。GLP-1可以調節黑質多巴胺能神經元的放電活動,降低炎癥反應,增加多巴胺能神經元存活率,并且對其起到保護作用[25-30]。在PD條件下GLP-1不僅可以通過多巴胺能神經元起到神經保護作用,還可能通過降低作為主要輸出核團的黑質網狀部過度激活的GABA能神經元的放電頻率,從而參與減輕對丘腦和皮質的抑制性輸入,最終改善PD的自主運動失調等癥狀。這可能對傳統GLP-1減輕PD運動障礙的機制有新的意義。
有研究表明,使用在體電生理技術在黑質網狀部背外側能更容易記錄到神經元的自發放電[10]。而這部分黑質網狀部背外側神經元主要分布著小清
蛋白陽性的GABA能神經元[4]。本實驗中所記錄到
的神經元放電大多來自黑質網狀部背外側。未來實驗可以進一步探究黑質網狀部背外側和內側的神經元放電是否有差異。同時,本研究證實GLP-1R激動劑可以調控部分GABA能神經元的活動,而不是所有的黑質網狀部GABA能神經元都受到GLP-1R激動劑的調節。結合本文免疫熒光染色結果,這可能是由于黑質網狀部有兩種或多種GABA能神經元,其中部分GABA能神經元很少表達或者不表達GLP-1R。有研究表明,網狀部GABA能神經元并非全部同質,黑質網狀部的GABA能神經元大致可以分為小清蛋白陽性神經元和GAD2陽性神經元,其中GAD2陽性神經元更靠近黑質網狀部內側[4]。本研究中的免疫熒光染色結果顯示,GLP-1R更多地表達在黑質網狀部背外側,即小清蛋白陽性的GABA能神經元主要分布的位置。
綜上所述,本文在體電生理技術檢測顯示,在小鼠黑質網狀部微量注射GLP-1R激動劑Exendin-4可以降低部分GABA能神經元的自發放電頻率。同時,本實驗免疫熒光染色的結果表明,黑質網狀部背外側神經元大量表達GLP-1R。這一實驗結果提示,GLP-1R及其激動劑可能通過調控黑質致密部GABA能神經元的放電活動,從而改善PD等疾病中的行為障礙。
[參考文獻]
[1]SMITH N K, HACKETT T A, GALLI A, et al. GLP-1: molecular mechanisms and outcomes of a complex signaling system[J]. Neurochemistry International, 2019,128:94-105.
[2]MEIER J J. GLP-1 receptor agonists for individualized treatment of type 2 diabetes mellitus[J]. Nature Reviews Endocrinology, 2012,8(12):728-742.
[3]JEPSEN M M, CHRISTENSEN M B. Emerging glucagon-like peptide 1 receptor agonists for the treatment of obesity[J]. Expert Opinion on Emerging Drugs, 2021,26(3):231-243.
[4]LIU D Q, LI W F, MA C Y, et al. A common hub for sleep and motor control in the substantia nigra[J]. Science, 2020,367(6476):440-445.
[5]KRAVITZ A V, FREEZE B S, PARKER P R, et al. Regulation of parkinsonian motor behaviours by optogenetic control of basal Ganglia circuitry[J]. Nature, 2010,466(7306):622-626.
[6]CHEN X Y, LIU C, XUE Y, et al. Changed firing activity of nigra dopaminergic neurons in Parkinson’s disease[J]. Neurochemistry International, 2023,162:105465.
[7]ATHAUDA D, FOLTYNIE T. The glucagon-like peptide 1 (GLP) receptor as a therapeutic target in Parkinson’s disease:
mechanisms of action[J]. Drug Discovery Today, 2016,21(5):802-818.
[8]DRUCKER D J. Mechanisms of action and therapeutic application of glucagon-like peptide-1[J]. Cell Metabolism, 2018,27(4):740-756.
[9]SUN H Z, SHEN F S, LI X X, et al. Exendin-4 increases the firing activity of hippocampal CA1 neurons through TRPC4/5 channels[J]. Neuroscience Research, 2024,199:48-56.
[10]BLOMS-FUNKE P, LOSCHER W. The anticonvulsant gabapentin decreases firing rates of substantia nigra pars reticulata neurons[J]. European Journal of Pharmacology, 1996,316(2/3):211-218.
[11]WEN Y T, WU K L, XIE Y F, et al. Inhibitory effects of glucagon-like peptide-1 receptor on epilepsy[J]. Biochemical and Biophysical Research Communications, 2019,511(1):79-86.
[12]CHUONG V, FAROKHNIA M, KHOM S, et al. The glucagon-like peptide-1 (GLP-1) analogue semaglutide reduces alcohol drinking and modulates central GABA neurotransmission[J]. JCI Insight, 2023,8(12):e170671.
[13]HOLST J J. The physiology of glucagon-like peptide 1[J]. Physiological Reviews, 2007,87(4):1409-1439.
[14]CALEBIRO D, MAIELLARO I. cAMP signaling microdomains and their observation by optical methods[J]. Frontiers in Cellular Neuroscience, 2014,8:350.
[15]ZHANG T, RUAN H Z, WANG Y C, et al. Signaling mechanism for modulation by GLP-1 and exendin-4 of GABA receptors on rat retinal ganglion cells[J]. Neuroscience Bulletin, 2022,38(6):622-636.
[16]CORK S C, RICHARDS J E, HOLT M K, et al. Distribution and characterisation of Glucagon-like peptide-1 receptor expressing cells in the mouse brain[J]. Molecular Metabolism, 2015,4(10):718-731.
[17]CHEN X Y, CHEN L, YANG W, et al. GLP-1 suppresses feeding behaviors and modulates neuronal electrophysiological properties in multiple brain regions[J]. Frontiers in Molecular Neuroscience, 2021,14:793004.
[18]WILLIAMS D L, LILLY N A, EDWARDS I J, et al. GLP-1 action in the mouse bed nucleus of the stria terminalis[J]. Neuropharmacology, 2018,131:83-95.
[19]ESPARZA-SALAZAR F J, LEZAMA-TOLEDO A R, RI-
VERA-MONROY G, et al. Exendin-4 for Parkinson’s disease[J]. Brain Circulation, 2021,7(1):41-43.
[20]YUAN Z Y, LI D F, FENG P, et al. A novel GLP-1/GIP dual agonist is more effective than liraglutide in reducing inflammation and enhancing GDNF release in the MPTP mouse model of Parkinson’s disease[J]. European Journal of Pharmacology, 2017,812:82-90.
[21]CAO B, ZHANG Y Q, CHEN J H, et al. Neuroprotective effects of liraglutide against inflammation through the AMPK/NF-κB pathway in a mouse model of Parkinson’s disease[J]. Metabolic Brain Disease, 2022,37(2):451-462.
[22]NOWELL J, BLUNT E, GUPTA D, et al. Antidiabetic agents as a novel treatment for Alzheimer’s and Parkinson’s disease[J]. Ageing Research Reviews, 2023,89:101979.
[23]MULVANEY C A, DUARTE G S, HANDLEY J, et al. GLP-1 receptor agonists for Parkinson’s disease[J]. The Cochrane Database of Systematic Reviews, 2020,7(7):CD012990.
[24]MANFREADY R A, FORSYTH C B, VOIGT R M, et al. Gut-brain communication in Parkinson’s disease: enteroendocrine regulation by GLP-1[J]. Current Neurology and Neuroscience Reports, 2022,22(7):335-342.
[25]YUN S P, KAM T I, PANICKER N, et al. Block of A1 astrocyte conversion by microglia is neuroprotective in models of Parkinson’s disease[J]. Nature Medicine, 2018,24(7):931-938.
[26]SUN J, LI H J, JIN Y J, et al. Probiotic Clostridium butyricum ameliorated motor deficits in a mouse model of Parkin-
son’s disease via gut microbiota-GLP-1 pathway[J]. Brain, Behavior, and Immunity, 2021,91:703-715.
[27]JASTREBOFF A M, KUSHNER R F. New frontiers in obesity treatment: GLP-1 and nascent nutrient-stimulated hormone-based therapeutics[J]. Annual Review of Medicine, 2023,74:125-139.
[28]AKOUMIANAKIS I, ZAGALIOTIS A, KONSTANTARAKI M, et al. GLP-1 analogs and regional adiposity: A syste-
matic review and meta-analysis[J]. Obesity Reviews, 2023,24(8):e13574.
[29]SHETTY R, BASHEER F T, POOJARI P G, et al. Adverse drug reactions of GLP-1 agonists: A systematic review of case reports[J]. Diabetes Metab Syndr, 2022,16(3):102427.
[30]NOWELL J, BLUNT E, GUPTA D, et al. Antidiabetic agents as a novel treatment for Alzheimer’s and Parkin-
son’s disease[J]. Ageing Research Reviews, 2023,89:101979.
(本文編輯于國藝)

