丁香酚對南方根結線蟲活性測定方法的比較
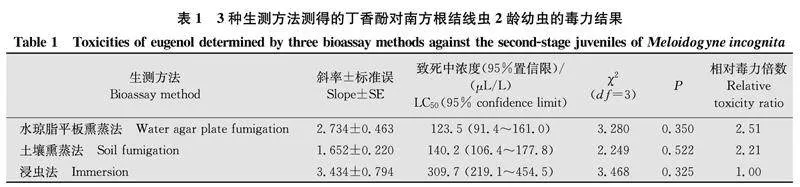
摘要為了準確評價丁香酚(C10H12O2)對南方根結線蟲Meloidogyne incognita的毒殺效果,本研究采用水瓊脂平板熏蒸法、土壤熏蒸法和浸蟲法分別測定了丁香酚對南方根結線蟲2齡幼蟲(J2)和卵的毒力,比較3種測定方法的測定效果。結果表明,水瓊脂平板熏蒸法、土壤熏蒸法和浸蟲法測得的丁香酚對2齡幼蟲的LC50分別為123.5、140.2 μL/L和309.7 μL/L;丁香酚濃度為50 μL/L時,水瓊脂平板熏蒸法測得的卵孵化抑制率高達97.10%,而土壤熏蒸法和浸蟲法測得的卵孵化抑制率僅分別為32.79%、11.50%;同時,水瓊脂平板可作為線蟲或卵的可視化載體,便于在體視顯微鏡下觀察拍照。綜上,水瓊脂平板熏蒸法具有藥效發揮更充分、可視化、操作簡便等優點,該方法更適用于熏蒸類化合物的殺線蟲生物測定。
關鍵詞丁香酚;南方根結線蟲;生物測定方法
中圖分類號:S 432.45文獻標識碼:ADOI:10.16688/j.zwbh.2023495Comparison of three bioassay methods of eugenol against Meloidogyne incognitaCHEN Zongxiong,YANG Ziwei,HUI Renjie,DING Xiaofan*(Key Laboratory of Green Prevention and Control of Tropical Plant Diseases and Pests,5ghyI6wWlbYbY2mZFNty1Q== Ministry of
Education, School of Tropical Agriculture and Forestry, Hainan University, Danzhou571737, China)AbstractIn order to accurately evaluate the toxicity of eugenol (C10H12O2) on Meloidogyne incognita, the second-stage juveniles (J2) and eggs of M.incognita were treated with eugenol by water agar plate fumigation, soil fumigation, and immersion, respectively. The results showed that the LC50 value of eugenol by water agar plate fumigation was 123.5 μL/L, while those by soil fumigation and immersion were 140.2 μL/L and 309.7 μL/L, respectively. The inhibition rate of egg hatching by 50 μL/L eugenol with water agar plate fumigation was 97.10%, while those by soil fumigation and immersion method were only 32.79% and 11.50%, respectively. Meanwhile, the water agar plate could be used as a visual carrier of J2 or eggs under stereomicroscopy for easy observation. In summary, the water agar plate fumigation has the advantages of fully exerting virulence effect of eugenol, visualization, and simple operation. It is more suitable for the nematode bioassay of fumigation compounds.
Key wordseugenol;Meloidogyne incognita;bioassay method
植物寄生線蟲是重要的病原線蟲,嚴重威脅農業的可持續發展,每年給世界農業造成巨大經濟損失[1]。尤其是根結線蟲Meloidogyne spp.,其為害可造成我國蔬菜每年約30%的減產、超過30億人民幣的損失[2]。目前, 對根結線蟲的防治仍以化學防治為主,常用藥劑有噻唑膦、阿維菌素、克百威等,大量使用化學殺線蟲劑不僅對環境造成極大的破壞,還極易對人及其他非靶標生物造成危害,同時由于長期不合理地使用農藥已使線蟲產生了抗藥性[35]。因此挖掘新的安全、高效、低毒且在自然環境中可降解、不易產生抗藥性的殺線劑是發展的方向。在創制新殺線蟲劑的過程中,室內生物活性測定是必不可少的環節。
農業行業標準NY/T 1833.1-2009中推薦的殺線蟲劑室內生物測定方法為“浸蟲法”,即將待測藥劑配制為不同濃度梯度溶液后與線蟲懸液等體積混合均勻后測定藥劑活性,該方法也稱“觸殺法”,對于不溶于水的揮發性藥劑的生物測定存在一定的局限性[6]。殺線劑的生物測定方法還有“土壤淋浴法”“葉面噴霧法”和“土壤熏蒸盆栽法”[78],這3種方法均需要準備活體盆栽植物,試驗周期長,無法在24 h或48 h內準確獲知供試藥劑的急性毒力,因此較少被采納。目前不溶于水且具有揮發性的化合物的毒力多采用浸蟲法測定,由于揮發性化合物與水不互溶,需要添加助劑將其配制成水劑,這樣水相中的親脂分子結合形成膠束,使得揮發性化合物不能很好地與生物體附著,無法充分發揮藥效;而若是利用熏蒸法,化合物在氣相狀態下則能自由附著在生物體上[910]。丁香酚(C10H12O2)主要存在于丁香油、豆蔻油和樟腦油中,可從丁香、香樟等植物中提取,具有廣泛的生物活性[11]。Meyer等利用浸蟲法測得丁香油對南方根結線蟲2齡幼蟲的EC50為0.097% (V/V),5.0%丁香油揮發物使線蟲卵孵化率降低30%,且孵化出的J2存活率為0[12]。本研究通過比較水瓊脂平板熏蒸法、土壤熏蒸法和浸蟲法測定丁香酚抑殺根結線蟲的效果,旨在篩選出適用于揮發性化合物的生物測定方法。
1材料與方法
1.1供試材料
供試線蟲為南方根結線蟲 Meloidogyne incognita,采自海南省樂東縣尖峰嶺國家森林公園(18°23′N,108°46′E),由海南大學熱帶農林學院植物線蟲實驗室分離鑒定,并在番茄上于28℃溫室中通過單卵塊擴繁;供試番茄為感病品種 ‘新中蔬’,青縣興運種業有限公司生產。
供試藥劑:98.5%丁香酚原液,上海源葉生物科技有限公司生產。
1.2試驗方法
1.2.1丁香酚水瓊脂平板熏蒸處理
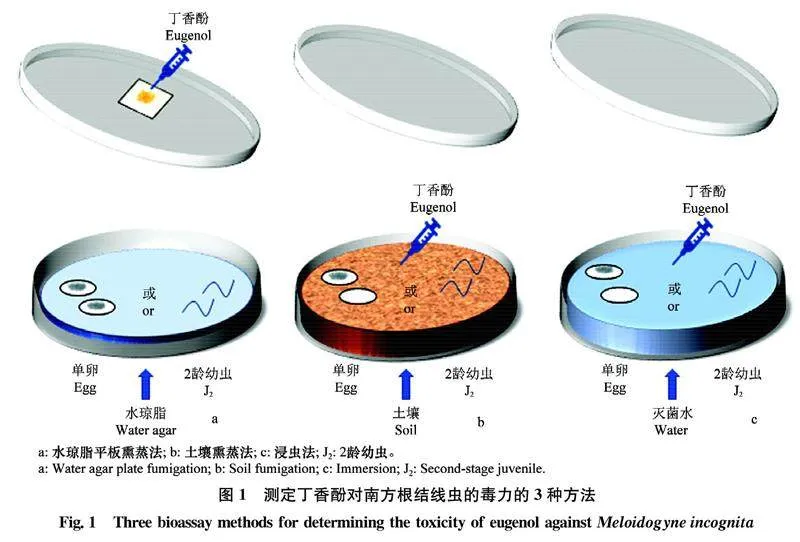
將塑料培養皿(d=6 cm)作為密閉的熏蒸容器,在皿蓋中央用雙面膠固定一片邊長約1.5 cm的濾紙,皿中倒入1 mL 1.5%滅菌水瓊脂,待凝固成厚約2 mm的透明凝膠后,每皿分別加入200 μL根結線蟲2齡幼蟲懸液(約100條幼蟲)或單卵懸液(約100粒卵),用移液器將丁香酚原液加到培養皿皿蓋的濾紙片上,設置1.25、2.5、5、10、20 μL(相當于各皿丁香酚濃度分別為50、100、200、400、800 μL/L) 5個處理,迅速將含藥皿蓋蓋住培養皿,并用封口膜密封(圖1a);每處理設3次重復,以無菌水作為對照;于28℃培養箱孵育24 h(J2)或9 d(卵)后,于體視顯微鏡(徠卡S8APO)下鏡檢J2存活情況和卵的孵化情況。用細鋼針(或睫毛針)反復觸碰J2判斷其死活,若線蟲緩慢扭動即為存活,僵直不動視為死亡。分別計算線蟲死亡率、校正死亡率、卵孵化率以及孵化相對抑制率。
死亡率=線蟲死亡數/線蟲總數×100%;
校正死亡率=(處理組死亡率-對照組死亡率)/(1-對照組死亡率)×100%;
卵孵化率=幼蟲數/供試卵數×100%;
孵化相對抑制率=(對照組孵化率-處理組孵化率)/對照組孵化率×100%。
1.2.2丁香酚土壤熏蒸處理
將過10目篩的土壤與育苗基質(品氏托普園藝上海有限公司)按10∶1混合并滅菌后,于50℃烘箱中干燥24 h至恒重。將塑料培養皿(d=6 cm)作為密閉的土壤熏蒸容器,無菌土填滿培養皿,每皿分別加入2齡幼蟲懸液(約500條幼蟲)或單卵懸液(約500粒卵),使土壤含水量為15%~20%;將丁香酚直接滴加到土壤中,丁香酚濃度和密封方法同1.2.1,每處理設3次重復,以無菌水作為對照(圖1b);于28℃培養箱中孵育24 h(J2)或9 d(卵)后取出,利用卡勃過篩分離法(Cobbs’s sieving)收集2齡幼蟲及未孵化的卵[13],鏡檢方法及統計方法同1.2.1。
1.2.3丁香酚浸蟲處理
丁香酚原液用無水乙醇溶解,再用0.3%吐溫20的水溶液稀釋,配制成系列梯度溶液,濃度依次為100、200、400、800、1 600 μL/L(即最終測試濃度的2倍),依次吸取丁香酚溶液1 mL與等體積的2齡幼蟲懸液(約100條幼蟲)或單卵懸液(約100粒卵)于塑料培養皿(d=6 cm)內混勻(圖1c)立即加蓋皿蓋并密封;同時設置不含丁香酚的溶劑對照[6,14]。每處理3次重復,并設滅菌水為空白對照。于28℃培養箱中孵育24 h(J2)或9 d(卵)后取出,開蓋暴露3 min后鏡檢、統計方法同1.2.1。并以浸蟲法的LC50為基準,計算相對毒力倍數[15]。
1.3數據分析
使用SPSS 26軟件及Microsoft Excel 2021軟件分析試驗數據,對結果進行統計分析,求出毒力回歸方程、LC50、95%置信區間等,并利用Duncan氏新復極差法進行差異顯著性分析[16]。
2結果與分析
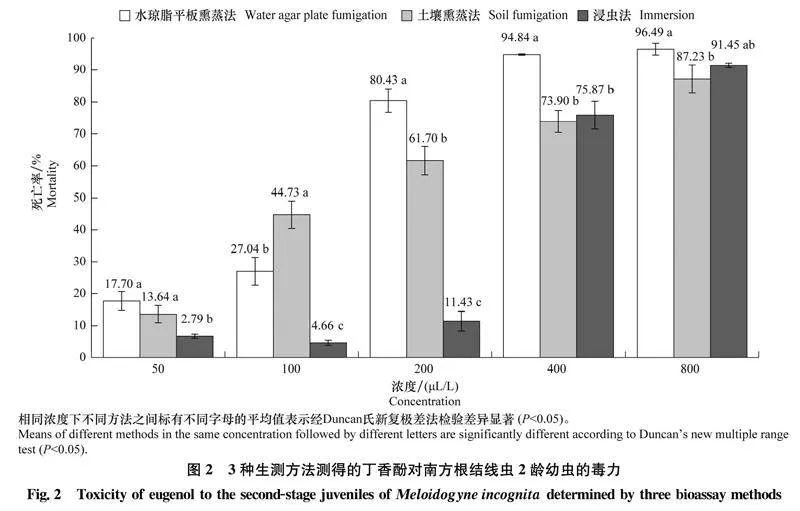
2.13種生測方法測得的丁香酚對南方根結線蟲2齡幼蟲的致死作用水瓊脂平板熏蒸法、土壤熏蒸法和浸蟲法測定結果顯示,不同濃度丁香酚處理對南方根結線蟲2齡幼蟲均有致死作用,致死率均隨著濃度的增加而升高(圖2)。水瓊脂平板熏蒸法測得的丁香酚致死效果最好,在200 μL/L和400 μL/L濃度下測得的2齡幼蟲死亡率顯著高于其他方法,其中200 μL/L時的線蟲死亡率高達80.43%,而采用土壤熏蒸法和浸蟲法時死亡率僅分別為61.70%、11.43%,濃度升高至400 μL/L時土壤熏蒸法和浸蟲法測得的線蟲死亡率僅分別為73.90%、75.87%,顯著低于水瓊脂平板熏蒸法測得的致死率(94.84%)。
2.23種生測方法測得的丁香酚對南方根結線蟲2齡幼蟲的毒力比較水瓊脂平板熏蒸法、土壤熏蒸法和浸蟲法測得的丁香酚對南方根結線蟲2齡幼蟲毒力存在差異。其中水瓊脂平板熏蒸法測得的毒力最強,其LC50為123.5 μL/L;土壤熏蒸法次之,LC50為140.2 μL/L;浸蟲法最差,LC50為309.7 μL/L。水瓊脂平板熏蒸法、土壤熏蒸法測得的毒力分別是浸蟲法測得結果的2.51倍和2.21倍(表1)。
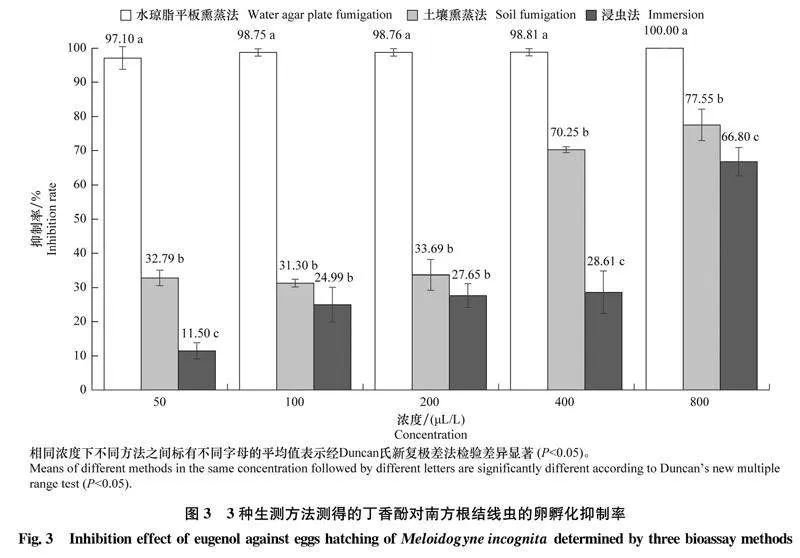
2.33種生測方法測得的丁香酚對南方根結線蟲卵孵化的抑制作用水瓊脂平板熏蒸法、土壤熏蒸法和浸蟲法測定結果顯示,丁香酚對南方根結線蟲卵孵化的抑制均隨丁香酚濃度的增加而增強(圖3)。50 μL/L丁香酚處理后9 d,水瓊脂平板熏蒸法的卵孵化抑制率高達97.10%,而土壤熏蒸法和浸蟲法的卵孵化抑制率僅分別為32.79%、11.50%。丁香酚各個處理濃度下,3種生測方法對卵孵化的抑制效果均表現為水瓊脂平板熏蒸法大于土壤熏蒸法和浸蟲法,且采用水瓊脂平板熏蒸法時卵孵化抑制率均顯著高于土壤熏蒸法和浸蟲法。
3結論與討論
根據中華人民共和國農業行業標準NY/T 1833.1-2009,殺線蟲劑室內生物測定試驗采用“浸蟲法”,建議水溶性藥劑直接用水溶解、稀釋,其他藥劑選用合適的有機溶劑(如丙酮、氯仿、乙醇等)溶解,再用含有適量表面活性劑如 0.1%吐溫80(或 0.1% Triton-X100)的水溶液稀釋[6]。例如噻唑膦、阿維菌素等藥劑,它們主要通過與線蟲直接接觸發揮殺蟲效果,在測定此類藥劑時以浸蟲法較為適宜[1718]。而對于具有揮發性熏蒸作用的藥劑,浸蟲法存在一定局限性。
土壤淋浴法、葉面噴霧試驗法以及土壤熏蒸盆栽法均需要栽種供試植物,且需要經半月至2月不等的時間后通過拔苗檢查統計病苗率[7],試驗周期長,無法滿足藥劑急性毒力的測定需求。本研究中采用的土壤熏蒸法無需栽種供試植物,容器中的土壤模擬植物線蟲自然生境,可供熏蒸類藥劑的揮發擴散,且可在處理后24 h完成急性毒力測定,但試驗結束后需要利用卡勃過篩分離法回收線蟲,較水瓊脂平板熏蒸法工序繁瑣,且線蟲回收率低、不穩定,對試驗準確性存在一定的干擾。
當前揮發性精油等化合物室內生測多采用浸蟲法[9,1920],由于精油的非水溶性, 供試藥劑溶液配制需添加助劑,因而需設置助劑對照組, 使生物測定試驗變得較繁瑣。同時,丁香酚溶于水后對線蟲活性下降,推測是因為丁香酚在水中溶解度適中、揮發性低[21]。因為含有羥基的化合物可能在一定程度上被溶解,從而更多地留在水相中,導致活性降低[22]。
殺線劑的生測方法多種多樣,任何一種方法都難以滿足試驗者的所有需求,如只測定化合物對線蟲的觸殺作用,則其熏蒸作用難以反映;若以土壤淋浴法進行活體測定,則不能反映葉面噴霧法藥劑對線蟲的活性。因此在生測方法的選擇上應根據化合物的類型和已知同類殺線劑的作用機理來進行[17]。
本研究利用水瓊脂平板熏蒸法測定具揮發性熏蒸作用的藥劑,將供試藥劑和線蟲置于密閉的容器內,讓藥劑產生的揮發性氣體與線蟲蟲體直接接觸,供試藥劑無需添加有機溶劑和表面活性劑,可準確反映所測藥劑的熏蒸毒力,且透明瓊脂載體可直接于體視顯微鏡下觀察判定線蟲存活狀態,同時具有操作簡便等優點。
參考文獻
[1]ABAD P, GOUZY J, AURY J M, et al. Genome sequence of the metazoan plant-parasitic nematode Meloidogyne incognita [J]. Nature Biotechnology, 2008, 26(8): 909915.
[2]彭德良. 植物線蟲病害:我國糧食安全面臨的重大挑戰[J]. 生物技術通報, 2021, 37(7): 12.
[3]丁琦, 羅萬春, 肖婷, 等. 13種植物源化合物對南方根結線蟲的毒力比較[J]. 植物資源與環境學報, 2007, 16(3): 3539.
[4]CHEN Jixiang, SONG Baoan. Natural nematicidal active compounds: Recent research progress and outlook [J]. Journal of Integrative Agriculture, 2021, 20(8): 20152031.
[5]劉曉艷, 閔勇, 饒犇, 等. 殺線蟲劑產品研究進展[J]. 中國生物防治學報, 2021, 37(3): 592597.
[6]中華人民共和國農業部. 農藥室內生物測定試驗準則: NY/T 1833.1—2009 [S]. 北京: 中國農業出版社, 2009.
[7]萬樹青. 介紹幾種室內測定殺線蟲劑活性的簡易方法[J]. 植物保護, 1992, 18(6): 44.
[8]萬樹青. 殺線蟲劑生物活性測定[J]. 農藥科學與管理, 1993(4): 1415.
[9]王偉軒, 王愧, 徐建美, 等. 檸檬草和腫柄菊葉精油的抗線蟲活性[J]. 天然產物研究與開發, 2016,28(8): 12661272.
[10]LAIRD K, PHILLIPS C. Vapour phase: a potential future use for essential oils as antimicrobials? [J]. Letters in Applied Microbiology, 2012, 54(3): 169174.
[11]孔曉軍, 劉希望, 李劍勇, 等. 丁香酚的藥理學作用研究進展[J]. 湖北農業科學, 2013, 52(3): 508511.
[12]MEYER S L, LAKSHMAN D K, ZASADA I A, et al. Dose-response effects of clove oil from Syzygium aromaticum on the root-knot nematode Meloidogyne incognita [J]. Pest Management Science, 2008, 64(3): 223229.
[13]劉維志. 植物病原線蟲學[M]. 北京: 中國農業出版社, 2000: 372373.
[14]NTALLI N G, FERRARI F, GIANNAKOU I, et al. Phytochemistry and nematicidal activity of the essential oils from 8 Greek Lamiaceae aromatic plants and 13 terpene components [J]. Journal of Agricultural and Food Chemistry, 2010, 58(13): 78567863.
[15]師超, 涂錫茂, 馮雪春, 等. 6種殺螨劑對朱砂葉螨不同生測方法的毒力比較[J]. 農藥, 2012, 51(3): 222224.
[16]賈春生. 利用SPSS軟件計算殺蟲劑的LC50 [J]. 昆蟲知識, 2006(3): 414417.
[17]李慧, 葉子雨, 吳迪, 等. 殺線蟲劑發展趨勢分析[J]. 世界農藥, 2022, 44(5): 15.
[18]粟寒, 刁亞梅, 李捷, 等. 殺線蟲劑生物活性測定方法[J]. 浙江化工, 2000(S1): 8586.
[19]CARLETTI B, PACI F, AMBROGIONI L, et al. Effects of a clove oil extract on eggs and second-stage juveniles of Meloidogyne incognita (Kofoid et White, 1919) Chitwood, 1949 [J]. Redia, 2011, 94: 1319.
[20]ELENI N, IOANNIS O G. The potential of eugenol as a nematicidal agent against Meloidogyne javanica (Treub) Chitwood [J/OL]. Journal of Nematology, 2020, 52(1): e2020-103. DOI: 10.21307/jofnem-2020-103.
[21]KNOBLOCH K, PAULI A, IBERL B, et al. Antibacterial and antifungal properties of essential oil components [J]. Journal of Essential Oil Research, 1989, 1(3): 119128.
[22]SATO K, KRIST S, BUCHBAUER G. Antimicrobial effect of trans-cinnamaldehyde, (-)-perillaldehyde, (-)-citronellal, citral, eugenol and carvacrol on airborne microbes using an airwasher [J]. Biological and Pharmaceutical Bulletin, 2006, 29(11): 22922294.
(責任編輯:田喆)

