黃花蒿對粘蟲殺蟲活性成分及機制研究



摘要:為研究黃花蒿石油醚萃取物對粘蟲3齡幼蟲殺蟲活性成分及初步作用機制,采用硅膠柱色譜進行分離,氣相?質譜法分析化學成分,浸蟲法測定不同餾分及主要成分的觸殺活性,并進一步對活性成分進行粘蟲幼蟲體內靶標酶和代謝酶活性測定。結果表明,黃花蒿石油醚萃取物經硅膠柱色譜分離,共得到27個餾分,其中餾分8表現出較好的觸殺活性。經氣相色譜?質譜法檢測,十三烷、4-喹啉甲醛、石竹烯氧化物、亞油酸乙酯和亞麻酸乙酯為主要化合物,含量分別為7.9%、72.8%、3.6%、2.4%、3.1%。這5種化合物處理粘蟲7 d的半數致死濃度(LC50)分別為7.9、2.5、3.6、5.4和1.5 mg·mL-1,即亞麻酸乙酯對粘蟲的觸殺活性最好。掃描電鏡結果顯示,1.5 mg·mL-1亞麻酸乙酯處理粘蟲7 d,粘蟲表皮蠟質層結構排列疏松,蠟質層顆粒明顯消失,蠟花間隙增大;在處理過程中,粘蟲的乙酰膽堿酯酶和羧酸酯酶表現出先激活后抑制作用;Na+-K+-ATPase表現出持續抑制作用;過氧化氫酶表現出先抑制后激活作用。綜上,亞麻酸乙酯為黃花蒿對粘蟲殺蟲活性的主要化合物,研究結果為黃花蒿資源的開發利用以及將亞麻酸乙酯作為生物防治粘蟲的潛力化合物提供參考。
關鍵詞:黃花蒿;粘蟲;亞麻酸乙酯;作用機制doi:10.13304/j.nykjdb.2023.0589
中圖分類號:S476 文獻標志碼:A 文章編號:10080864(2024)12012909
粘蟲(Mythimna separate Walker)是鱗翅目(Lepidoptera)夜蛾科(Noctuidae)昆蟲,具有暴食性、突發性和毀滅性等特點[1]。其主要為害玉米、水稻、小麥、高粱等糧食作物[2]。粘蟲通過取食植物葉片,造成幼嫩葉片嚴重缺失和蟲糞污染,導致糧食作物產量和品質下降[3]。目前,主要使用辛硫磷和高效氯氟氰菊酯[4]等化學農藥防治粘蟲,但化學農藥的大量使用導致粘蟲產生抗藥性、環境污染和人畜安全等問題。為減少殺蟲劑的使用量,延緩害蟲抗藥性的產生,目前利用粘蟲黑卵蜂、粘蟲赤眼蜂和管側溝繭蜂等捕食性天敵,核型多角體病毒以及苦參堿、印楝素等生物農藥對粘蟲進行防治,均取得了較好的效果。在植物與環境長期協同進化過程中,為了生存和適應復雜的環境,植物組織產生了許多結構新穎、活性多樣以及機理獨特的次生代謝物質[5]。這些物質可對昆蟲產生觸殺、胃毒、拒食、引誘、趨避和產卵抑制等作用[6],且因其具有良好的有效性、安全性和生態可接受性受到廣泛關注。
黃花蒿(Artemisia annua L.)又名青蒿,為菊科蒿屬一年生草本植物,常生于路旁、荒地、山坡和林緣等地,生態適應性廣,遍布全國各地[7]。關于其殺蟲活性的報道主要集中在提取物和揮發油方面,化合物的殺蟲活性報道較少。黃花蒿乙醇提取物對菜青蟲(Pieris rapae)具有觸殺活性[8],對南部灰翅夜蛾(Spodoptera eridania) 和瓢蟲(Epilachna paenulata)具有拒食活性[9];甲醇提取物對赤擬谷盜(Tribolium castaneum)具有觸殺活性[10];丙酮提取物對菜蚜(Lipaphis erysimi))具有觸殺和胃毒活性[11],對朱砂葉螨(Tetranychuscinnabarinus)具有觸殺蟲活性[12];石油醚提取物對黑翅土白蟻(Odontotermes formosanus)、赤擬谷盜、谷蠹(Rhizopertha dominica)、棉蚜(Aphis gossypii)、棉紅蜘蛛(Tetranychus urticae)、豇豆莢螟(Etiellazinckenella)具有拒食活性[13],對赤擬谷盜具有觸殺活性[10];黃花蒿揮發油對黑頰麗蠅(Calliphoravomitoria)[14]、赤擬谷盜[15]具有觸殺和熏蒸活性;從黃花蒿中分離得到的1,8桉葉腦對赤擬谷盜具有觸殺、熏蒸和拒食活性[16]。基于前期對黃花蒿等8種蒿屬植物的篩選發現,黃花蒿石油醚萃取物對粘蟲表現出較強的觸殺活性[17]。因此,本研究以觸殺活性為導向,對黃花蒿石油醚萃取物中的活性成分進行柱色譜分離,采用氣相色譜-質譜(gas chromatography-mass spectrometry,GC-MS)分析活性餾分中的主要化合物,并進行活性化合物的作用機制研究。
1 材料與方法
1.1 試驗材料
1.1.1 供試植物與試蟲 黃花蒿于2020年8月采自西藏拉薩市城關區,經西南林業大學杜凡教授鑒定為菊科蒿屬植物黃花蒿。粘蟲蟲卵由河南省濟源白云實業有限公司提供,飼養條件:溫度(27±1)℃,相對濕度75%±5%。在16 h 光照、8 h黑暗的恒溫培養箱中培養,待卵粒孵化后用新鮮玉米葉飼養至3齡,作為試蟲。
1.1.2 供試試劑 石油醚、乙酸乙酯、甲醇和乙醇均購自云南利妍科技有限公司,吐溫80購自天津風船化學試劑科技有限公司,4- 喹啉甲醛(≥97%)、十三烷(≥98%)、石竹烯氧化物(≥90%)、亞油酸乙酯(≥98%)和亞麻酸乙酯(≥95%)均購自上海麥克林生化科技股份有限公司,除蟲菊酯(≥98%)購自上海源葉生物科技有限公司。
1.1.3 供試儀器與設備 KQ5000-DE超聲波清洗器,昆山市超聲儀器有限公司;R-3旋轉蒸發儀,瑞士步琪實驗儀器公司;RGX-250B 人工氣候培養箱,上海坤天實驗儀器有限公司;薄層層析硅膠板(GF254)和200~300目柱層析硅膠,青島海洋化工廠;1 mL玻璃比色皿,宜興奧銳拓光學儀器有限公司;Agilent 7890A-5975C氣相色譜?質譜聯用儀,美國Agilent科技有限公司;OCE-Y30組織研磨器,天根生化科技有限公司;Thermo-17R 高速冷凍離心機,南京以馬內利儀器設備有限公司;紫外分光光度計,北京普析通用儀器有限責任公司;CP224C 分析電子天平,奧豪斯儀器上海有限公司。
1.2 試驗方法
1.2.1 柱層析分離及乳液的配制 采用薄層層析(thin-layer chromatography,TLC)法確定洗脫體系。濕法裝柱,稱取一定量硅膠于燒杯中,加入適量石油醚攪拌至無氣泡后加入玻璃柱,待液面達到一定高度時,打開玻璃柱活塞,放出多余石油醚。干法上樣,將樣品用不同極性的溶劑溶解,加入硅膠,加入量與樣品的比例為1∶1,攪拌干燥成粉末狀,加入色譜柱,依次用石油醚、石油醚∶氯仿(50∶1、10∶1、5∶1、1∶1)、氯仿、氯仿∶乙酸乙酯(20∶1、1∶1)、乙酸乙酯、甲醇洗脫體系進行洗脫。洗脫液經TLC檢測,合并相同餾分,將各餾分減壓濃縮稱重。將餾分及十三烷、4-喹啉甲醛、石竹烯氧化物、亞油酸乙酯和亞麻酸乙酯均用0.5% 吐溫80乳液配成不同水平的乳液備用,0.5%吐溫80乳液作陰性對照,除蟲菊酯作陽性對照。
1.2.2 觸殺活性測定 采用浸蟲法[18]將蟲態一致的3齡粘蟲放入配制好的不同乳液中浸漬5 s,吸取多余藥液。用毛筆將粘蟲分別挑入帶蓋圓柱形塑料盒中,每盒1只。加入2片新鮮玉米葉片飼養,每組10只試蟲,重復5次。置于人工氣候培養箱,溫度(27±1)℃,相對濕度75%±5%,16 h光照、8 h黑暗培養,于處理第1、3、5、7 天時檢查粘蟲的存活情況。用毛筆輕觸蟲體無反應即為死亡。用公式(1)和(2)計算死亡率及校正死亡率。
1.2.3 GC-MS分析 將餾分8用正己烷溶解,進行GCMS測定。色譜柱為HP-5MS 毛細管柱(30 m×0.3 mm×0.3 μm)。升溫程序:100 ℃保持2 min,以4 ℃·min-1 升至250 ℃,保持10 min。載氣為氦氣,流速1.2 mL·min-1,進樣口溫度250 ℃,柱前壓100 kPa,進樣量0.2 μL,分流比100∶1。
質譜條件:電離方式為EI離子源;電子能量70 eV,氣質接口溫度280 ℃,離子源溫度230 ℃,四極桿溫度150 ℃;電子倍增器電壓為1 894 V。采用wiley7n.l標準譜庫檢索定性。通過面積歸一化法計算各化合物的相對含量。
1.2.4 掃描電鏡樣品制備及觀察 分別取對照組和亞麻酸乙酯組處理7 d的粘蟲,去其首尾,取中間約5 mm2左右的粘蟲表皮,用2.5%戊二醛固定液固定樣本,4 ℃放置過夜;然后用0.1 mol·L-1pH7.0的磷酸緩沖液漂洗樣品3次,每次15 min;用30%、50%、70%、80%、90% 和95% 的乙醇溶液對樣品進行脫水處理,每次15 min;再用100%的乙醇處理2次,每次20 min;用乙醇與醋酸異戊酯的混合液(體積比為1∶1)處理樣品30 min;再用醋酸異戊酯處理樣品,放置過夜;CO2臨界點干燥,干燥溫度為38 ℃,壓力為85個標準大氣壓。將干燥好的樣品粘臺,噴金,置于掃描電鏡下觀察并拍照。
1.2.5 粘蟲幼蟲體內靶標酶和代謝酶活性測定 采用亞麻酸乙酯半數致死濃度(LC50)處理粘蟲3齡幼蟲,處理方法同1.2.2。每個處理20只幼蟲,重復5次,以0.5%吐溫80乳液為對照組。分別于處理第1、3、5、7 天時取粘蟲3齡幼蟲,液氮研磨后稱取0.1 g,加入1.0 mL提取液;冰浴勻漿1 min,12 000 r·min-1、4 ℃離心10 min,取上清液,置于冰上作為待測酶液。參照各自試劑盒說明書測定乙酰膽堿酯酶(acetylcholin esterase,AChE,nmol·min-1·g-1 FW)、羧酸酯酶(carboxylesterase,CarE, ΔOD450·min-1·g-1 FW) 、Na+-K+-ATPase(μmol·h-1·g-1 FW)和過氧化氫酶(catalase,CAT,μmol·min-1·g-1 FW)4 種酶活性。根據公式(3)~(8)計算酶活力。
1.2.6 數據處理與分析 采用SPSS 23.0軟件進行數據的統計分析,采用Origin 2021軟件繪圖。
2 結果與分析
2.1 黃花蒿各餾分對粘蟲的觸殺活性
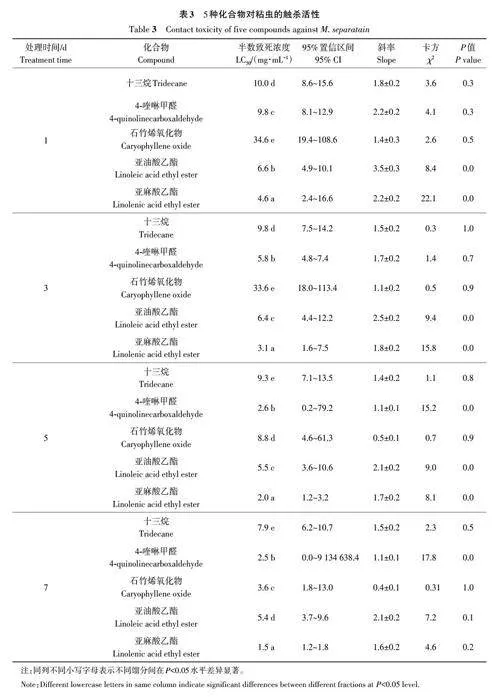
由表1可知,洗脫液經TLC檢測并合并相同餾分后,共得到27個餾分。用5 mg·mL-1 餾分處理1 d,其中餾分8和餾分9的校正死亡率分別為100.0%和66.0%;處理7 d時,餾分5、餾分6、餾分7、餾分8和餾分9的校正死亡率均超過50.0%,而其余22個餾分的校正死亡率均低于50.0%。由此表明,餾分8的殺蟲效果最好,與其他餾分存在顯著差異。因此,選擇餾分8進行GCMS分析。
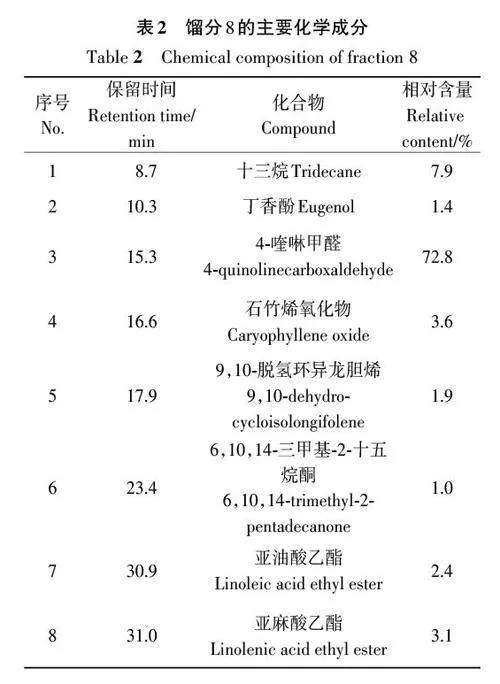
2.2 餾分8 的化學成分分析
由表2可知,從黃花蒿石油醚萃取物餾分8中共檢測出8 種化合物,其中相對質量分數大于2.0%的有十三烷(7.9%)、4-喹啉甲醛(72.8%)、石竹烯氧化物(3.6%)、亞油酸乙酯(2.4%)和亞麻酸乙酯(3.1%)。主要化合物含量占總量的89.7%。
2.3 餾分8 中5 種主要化合物的殺蟲活性
由表3可知,十三烷、4-喹啉甲醛、石竹烯氧化物、亞油酸乙酯和亞麻酸乙酯對粘蟲3齡幼蟲均具有殺蟲活性,其中亞麻酸乙酯的殺蟲活性顯著優于相同處理時間下其他4種化合物,且隨著處理時間的延長,殺蟲活性增強。雙因素方差分析結果表明,亞麻酸乙酯對粘蟲的處理劑量(F=393.2,Plt;0.001)和處理時間(F=81.8,Plt;0.001)均顯著影響粘蟲3齡幼蟲的校正死亡率。因此,選擇亞麻酸乙酯進行下一步試驗。
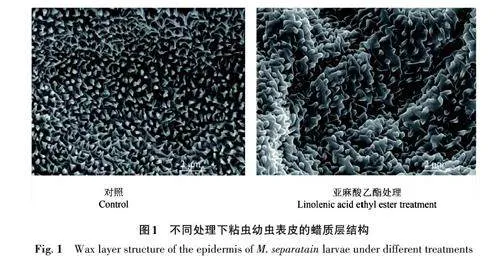
2.4 亞麻酸乙酯處理下粘蟲的掃描電鏡觀察結果
1.5 mg·mL-1亞麻酸乙酯處理粘蟲幼蟲7 d,對粘蟲幼蟲表皮蠟質層的影響如圖1所示。對照組幼蟲的蠟質層結構排列緊密,呈魚鱗狀,蠟花間空隙狹小;而亞麻酸乙酯處理組幼蟲的蠟質層結構排列較為疏松,蠟花間空隙增大,且蠟質層顆粒明顯消失,蠟質層發生明顯改變。
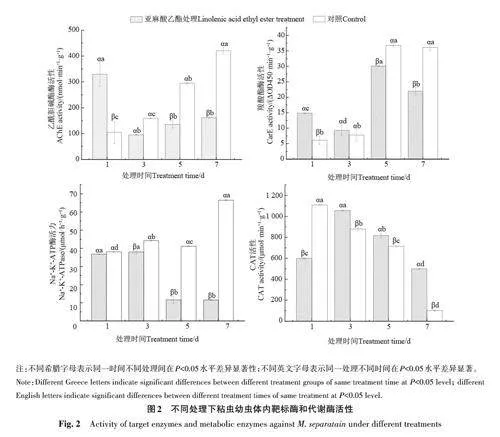
2.5 亞麻酸乙酯對粘蟲幼蟲體內靶標酶和代謝酶活性的影響
亞麻酸乙酯處理對粘蟲幼蟲體內靶標酶和代謝酶活性的影響如圖2所示。處理組的AChE活性在處理第1 天時顯著高于對照,為對照的3.2倍,表現為激活作用;在第3、5、7天時均顯著低于對照,分別降低40.4%、53.9%、61.7%,表現為抑制作用。處理組的CarE活性在第1、3天時均高于對照,表現為激活作用,其中第1天顯著高于對照,為對照的2.4倍;在第5、7天時均顯著低于對照,分別降低18.1%、39.2%。處理組的Na+-K+-ATPase活性在第1天時與對照差異不顯著;在第3、5、7天時均顯著低于對照,分別降低14.2%、71.7%、82.6%。處理組的CAT活性在第1天時顯著低于對照,較對照降低46.0%;在第3、5、7天時均顯著高于對照,其中第7天時為對照的5.0倍。
3 討論
本研究表明,亞麻酸乙酯對粘蟲在第1、3、5、7 天時的LC50 分別為4.6、3.1、2.0 和1.5 mg·mL-1。研究表明,紅蓼(Polygonum orientale)種子和莖稈的乙酸乙酯萃取物24 h時對粘蟲5齡幼蟲的觸殺活性高于其乙醇和甲醇提取物,LC50分別為8.7和29.1 mg·mL-1[18]。Zhu 等[19]合成了69 種4-丙炔氧基苯磺酰胺衍生物,其中含氨基酸酯基的化合物對粘蟲具有較好的殺蟲活性,D18、D19和D16處理粘蟲48 h時的LC50分別為4.28、2.96和2.38 mg·mL-1。從透骨草中分離得到4種化合物,其中T1、T2和T4化合物處理24 h時對粘蟲3齡幼蟲無殺蟲活性,而T3 化合物對粘蟲具有觸殺活性,LC50 為1.1 mg·mL-1[20]。由此表明,亞麻酸乙酯對粘蟲的殺蟲活性不及透骨草中分離得到的T3化合物,與含氨基酸酯基的D18、D19和D16化合物的殺蟲活性接近,優于紅蓼提取物。
AChE 是神經傳導的關鍵性酶,可催化神經遞質乙酰膽堿快速水解,終止膽堿能神經信號的傳遞[21]。亞麻酸乙酯處理粘蟲1 d,蟲體內的AChE 活性顯著高于對照,說明處理前期粘蟲通過機體正調節提高AChE活性,以達到降解或阻斷亞麻酸乙酯,進而降低或削弱其毒害作用;處理3、5和7 d時,AChE被抑制,導致乙酰膽堿不斷累積,與突觸后膜受體結合,造成鈉離子通道開放時間延長,膜內的鈉離子數量增加,使昆蟲表現出過度興奮、運動失調,痙攣死亡[22]。CarE是昆蟲體內重要的解毒代謝酶,主要參與有毒物質的代謝解毒過程,可通過水解酯類化合物的酯鍵降解酯類化合物,也可與親酯類化合物結合鈍化其毒性,CarE酶活性的高低是害蟲產生抗藥性及中毒死亡的重要原因[23]。亞麻酸乙酯處理1和3 d時,粘蟲幼蟲體內的CarE活性顯著高于對照,說明CarE參與亞麻酸乙酯代謝,導致其活性增強,以維持幼蟲生命活動的正常進行;處理5、7 d時,CarE活性低于對照,表明處理粘蟲幼蟲的解毒代謝能力下降,最終中毒死亡[24]。Na+-K+-ATPase能影響細胞膜上離子通道的開放或關閉,具有維持膜內外離子平衡的重要作用,其活性過低或過高均會引起膜內外電位和滲透壓平衡的破壞,導致電位信號傳導和代謝紊亂[25]。亞麻酸乙酯處理粘蟲體內的Na+-K+-ATPase活性顯著低于對照,從而引起細胞膜特別是神經細胞膜對離子的通透性降低,細胞膜內Na+外流受到抑制,含量升高,造成粘蟲神經膜處于持續興奮狀態,引發神經系統功能紊亂,最終導致粘蟲死亡[26]。CAT的主要作用是催化H2O2分解成O2和H2O,減輕活性氧自由基對昆蟲機體的損傷[27]。亞麻酸乙酯處理1 d時,粘蟲3齡幼蟲的CAT活性顯著低于對照,可能是由于游離超氧自由基的累積導致CAT活性受到抑制;處理3、5、7 d時,CAT活性顯著高于對照,可能是亞麻酸乙酯擾亂了粘蟲體內活性氧平衡,致使機體內活性氧水平升高,從而激活CAT活性,以清除活性氧自由基,減輕對蟲體的傷害。亞麻酸乙酯對粘蟲的殺蟲分子機理還需進一步深入研究。
參 考 文 獻
[1] 趙玉玉,李伯遼,李梅梅,等.粘蟲對高效氯氰菊酯抗性機制的初步研究[J].應用昆蟲學報,2018,55(5):857-864.
ZHAO Y Y, LI B L, LI M M, et al .. Preliminary research on the resistance mechanism of Mythimna separata to betacypermethrin[J]. Chin. J. Appl. Entomol., 2018, 55 (5):857-864.
[2] LI H, LIU F F, FU L Q, et al .. Identification of 35 c-type lectins in the oriental armyworm, Mythimna separata (Walker) [J/OL].Insects, 2021, 12(6):559 [2023-07-10]. https://doi.org/10.3390/insects12060559.
[3] 江幸福,張蕾,程云霞,等.我國粘蟲發生危害新特點及趨勢分析[J].應用昆蟲學報,2014,51(6):1444-1449.
JIANG X F, ZHANG L, CHENG Y X, et al .. Novel features occurrence trends and economic impact of the oriental armyworm, Mythimna separata (Walker) in China [J]. Chin. J.Appl. Entomol., 2014, 51(6):1444-1449.
[4] 王娟,孔勇,李伯遼,等.5種殺蟲劑對粘蟲不同發育階段的室內毒力[J].西北農業學報,2016,25(7):1097-1102.
WANG J, KONG Y, LI B L, et al .. Indoor toxicity determination of five kinds of insecticides on Mythimna separata (Walker) at different developmental stages [J]. Acta Agric. Bor-Occid. Sin., 2016, 25(7):1097-1102.
[5] YAN Y, LIU Q K, ZANG X, et al .. Resistance-gene-directed discovery of a natural-product herbicide with a new mode of action [J]. Nature, 2018, 559:415-418.
[6] 李曉維,程江輝,韓海斌,等. 植物次生代謝物質對薊馬的行為調控作用[J].昆蟲學報,2022, 65(9):1222-1246.
LI X W, CHENG J H, HAN H B, et al .. Behavioral manipulation of the plant secondary metabolites to thrips and their application in thrips management [J]. Acta Entomol. Sin.,2022, 65(9):1222-1246.
[7] 中國科學院中國植物志編輯委員會.中國植物志[M].北京: 科學出版社,1991:1062.
[8] 李云壽,鄒華英,唐紹宗,等.14種菊科植物提取物對菜青蟲的殺蟲活性[J].華東昆蟲學報,2000,9(2):99-101.
LI Y S, ZOU H Y, TANG S Z, et al .. Insecticidal activity of extracts from fourteen compositae plants against larvae of cabbage white butterfly Pieris rapae L. [J]. Entomol. J. East China, 2000, 9(2):99-101.
[9] MAGGI M E, MANGEAUD A, CARPINELLA M C, et al ..Laboratory evaluation of Artemisia annua L. extract and artemisinin activity against Epilachna paenulata and Spodoptera eridania [J]. J.Chem. Ecol., 2005, 31(7):1527-1536.
[10] DEB M, KUMAR D. Bioactivity and efficacy of essential oils extracted from Artemisia annua against Tribolium casteneum (Herbst. 1797) (Coleoptera: Tenebrionidae): an eco-friendly approach [J/OL]. Ecotox. Environ. Safe., 2019, 189: 109988[2023-07-10]. https://doi.org/10.1016/j.ecoenv.2019.109988.
[11] 王振吉,楊申明,沈慧,等.黃花蒿提取物對菜蚜的殺蟲活性 研究[J].西部林業科學,2014,43(4):136-139.
WANG Z J, YANG S M, SHEN H, et al .. Bioassay of insecticidal effect of extract from Artemisia annua on Lipaphis erysimi [J]. J. West Chin. For. Sci., 2014, 43(4):136-139.
[12] 張永強,丁偉,趙志模,等.黃花蒿提取物對朱砂葉螨生物活性的研究[J].中國農業科學,2008,41(3):720-726.
ZHANG Y Q, DING W, ZHAO Z M, et al .. Studies on acarcidal bioactivities of the extracts from Artemisia annua L.against Tetranychus cinnabarinus Bois. (Acari:Tetranychidae) [J]. Sci. Agric. Sin., 2008, 41(3):720-726.
[13] 朱芬,雷朝亮,王健.黃花蒿粗提物對幾種害蟲拒食性的初步研究[J].昆蟲天敵,2003,5(1):16-19.
ZHU F, LEI C L, WANG J. Acti-feedant activity of crude extract of Artemisia annua. on some insect pests [J]. Nat.Enemies Insects, 2003, 25(1):16-19.
[14] BEDINI S, FLAMINI G, COSCI F, et al .. Artemisia spp.essential oils against the disease-carrying blowfly Calliphora vomitoria [J]. Parasite Vector, 2017, 10(1):1-10.
[15] 程昉,邵亞洲,楊盈盈,等.黃花蒿揮發油對赤擬谷盜成蟲和幼蟲的生物活性研究[J]. 中國糧油學報,2020,35(11):119-124.
CHENG F, SHAO Y Z, YANG Y Y, et al .. Biological activity of Artemisia annua essential oil against adults and larvae of Tribolium castaneum [J]. J. Chin. Cereals Oils Assoc., 2020, 35(11):119-124.
[16] TRIPATHI A K, PRAJAPATI V, AGGARWAL K K, et al ..Toxicity, feeding deterrence, and effect of activity of 1,8-cineole from Artemisia annua on progeny production of Tribolium castanaeum (Coleoptera: Tenebrionidae) [J]. J. Econ.Entomol., 2001, 94(4):979-983.
[17] 李春燕,高成香,梁倩.黃花蒿對粘蟲的殺蟲活性研究[J].現代園藝,2023,46(13):4-9.
LI C Y, GAO C X, LIANG Q. Study on insecticidal activity of Artemisia annua against M. separata [J]. Mod. Hortic., 2023,46 (13): 4-9.
[18] 張新瑞,胡冠芳,劉敏艷,等.紅蓼提取物殺蟲活性及其對粘蟲的作用方式[J].草地學報,2009,17(3):377-382.
ZHANG X R, HU G F, LIU M Y, et al .. Insecticidal activity of extracts from Polygonum orientale L. and their actionways against Mythimna separate walker [J]. Acta Agric. Sin., 2009,17(3):377-382.
[19] ZHU X Z, SUN M X, ZHANG Z W, et al .. Design synthesis andinsecticidal activities of 4-propargyloxybenzene sulfonamide derivatives substituted with amino acids [J]. J. Asian Nat. Prod.Res., 2023 25(4):379-386.
[20] LI Y K, WEI J Q, FANG J M, et al .. Insecticidal activity of four lignans isolated from Phryma leptostachya [J/OL]. Molecules,2019, 24:1976 [2023-07-10]. https://doi.org/10.3390/molecules 24101976.
[21] 於祥,陳婭芳,張艷,等.歐芹酚甲醚腙類衍生物的設計合成及抗乙酰膽堿酯酶活性研究[J]. 化學研究與應用,2023,35(1):91-97.
YU X, CHEN Y F, ZHANG Y, et al .. Synthesis and antiacetylcholinesterase evaluation of osthole esters [J]. Chem.Res. Appl., 2023, 35(1):91-97.
[22] 陳宇鵬.桔小實蠅不同蛹色品系的抗藥性機制[D].廣州:華南農業大學,2019.
CHEN Y P. Insecticide resistance mechanism of pupa strains with different coloration of Bactrocera dorsalis (Hendel) [D].Guangzhou: South China Agricultural University, 2019.
[23] SHEN G M, DOU W, NIU J Z, et al .. Transcriptome analysis of the oriental fruit fly (Bactrocera dorsalis) [J/OL]. PLoS One,2011, 6 (12): e29127 [2023-07-10]. https://doi. org/10.1371/journal.pone.0029127.
[24] YANG S Y, WU H H, XIE J C, et al.. Depressed performance and detoxification enzyme activities of Helicoverpa armigera fed with conventional cotton foliage subjected to methyl jasmonate exposure[J]. Entomol. Exp. Appl., 2013, 147(2):186-195.
[25] 凌斯全.Itol A 對褐飛虱的生理影響及作用機理的初步研究[D].南寧:廣西大學,2017.
LIN S Q. Preliminary study on physiological effect and insecticidal mechanism of Itol a against brown planthopper Nilaparvat alugens (Stal) [D]. Nanning: Guangxi University, 2017.
[26] 陳義娟.香樟葉提取物中殺螨活性物質的分離鑒定及作用機理研究[D].上海:上海交通大學,2017.
CHEN Y J. Isolation, identificantion and mechanism of the acaricidal compound from Cinnamomum camphora against Tetranychus cinnabarinus [D]. Shanghai: Shanghai Jiao Tong University, 2017.
[27] 王召,彭舒,孟立霞.噻蟲嗪對鯽魚的急性毒性和抗氧化酶及乙酰膽堿酯酶活性的影響[J].水產科學,2020,39(6):922-927.
WANG Z, PENG S, MENG L X. Acute toxicity of thiamethoxam and activities of antioxidant enzymes and acetylcholinesterase in juvenile crucian carp Carassius auratus [J].Fisheries Sci., 2020, 39(6):922-927.

