番茄BURP 結構域基因家族全基因組鑒定及表達分析





摘要:BURP結構域蛋白為植物所特有,在植物生長發育和脅迫響應中起著重要作用。為鑒定番茄BURP結構域基因(SlBURP)及分析其表達,從番茄基因組中鑒定出12個SlBURP 基因,系統進化分析將其分為7個亞族,不同亞族的保守基序和基因結構有明顯差異。SlBURPs 啟動子序列中廣泛存在脅迫、生長、激素、光響應元件,表明該家族基因在對非生物脅迫的響應中有重要作用。共線性分析表明,番茄SlBURP 基因和擬南芥BURP 基因家族成員來自同一祖先。RT-qPCR表明,SlBURP6、SlBURP7、SlBURP8、SlBURP12 在葉中大量表達;SlBURP2、SlBURP6、SlBURP7、SlBURP8 在鹽處理后轉錄水平上升;在植物調節劑處理下SlBURP5、SlBURP8、SlBURP9、SlBURP12 基因在果實發育期的轉錄水平均有上升。綜上所述,SlBURP 基因在番茄生長發育和逆境脅迫中起著重要作用。
關鍵詞:番茄;BURP 基因家族;果實發育;鹽脅迫;表達分析
doi:10.13304/j.nykjdb.2023.0311
中圖分類號:S641.2 文獻標志碼:A 文章編號:1008‐0864(2024)08‐0051‐12
BURP 結構域蛋白是植物所特有的一種蛋白,在植物生長發育和脅迫響應中起重要作用[1]。BURP結構域蛋白家族以高度保守的C端氨基酸基序為特征,其名稱來源于油菜花粉蛋白BNM2、蠶豆胚蛋白USP、擬南芥干旱響應蛋白RD22和番茄多聚半乳糖醛酸酶PG1β這4個蛋白名稱的首字母[2‐3]。一般來說,含有BURP結構域的蛋白質包含幾個保守模塊:①在N端疏水結構域有1個假定的信號肽;②C端為BURP結構域,包括幾個保守的氨基酸位點和4個重復的半胱氨酸組氨酸(CH)基序,即CHX10CHX23-37CHX23-26CHX8W (X為任意氨基酸殘基);③每個BURP蛋白中間都有1個可變區,包括1個短的保守片段或其他短片段;④由重復單元組成的可選段[4]。BURP結構域的差異導致其蛋白功能不同,且其亞細胞定位可能也截然不同。
近年來,在眾多植物中都發現BURP結構域基因(BURP)具有響應逆境脅迫功能。大豆(Glycinemax L.)BURP 基因SALI5-4a 和SALI3-2 被鋁誘導在根尖中的表達量上調,且SALI3-2 的過表達可提高酵母細胞的耐鹽性[5‐6]。玉米(Zea mays)BURP基因家族在脫落酸(abscisic acid,ABA)處理下表達上調,在冷脅迫下表達下調,并且也受鹽脅迫的影響[7]。油菜(Brassica napus)腋芽特異表達基因BnBDC1 在鹽、ABA和滲透性脅迫下表達水平上調[8]。BURP 基因在植物生長發育中也起著重要作用。在擬南芥(Arabidopsis thaliana)和甘藍型油菜(Brassica napus)中,一些BURP 蛋白參與種子發育[9‐10],其蛋白定位于高爾基體和液泡中[11]。大豆BURP蛋白可能參與調節合子胚胎發生的早期發育[12]。棉花(Gossypium spp)GhRDL1 基因可與GhEXPA1 基因互作,且它們共表達可顯著提高產量[13]。葡萄(Vitis vinifera)VvBURP1 基因在早期果實形態發育中發揮關鍵作用[14]。綜上所述,BURP 基因不僅在植物生長發育和脅迫響應中起重要作用,還可能參與植物激素信號通路。
番茄(Solanum lycopersicum)在我國蔬菜生產中占有重要地位,具有營養豐富、產量高等特點[15‐16]。但番茄在生長發育過程中面臨著各種環境脅迫[17],從而影響番茄經濟產量。目前多數植物的BURP 基因家族被鑒定,并進行了詳盡的家族分析[4,18‐19],但番茄中僅分離純化了PG1β 基因,該基因在番茄果實的果膠代謝中發揮重要作用[20]。而關于番茄BURP 基因家族的系統鑒定與分析尚未見報道。因此,本研究通過生物信息學方法在全基因組水平上鑒定番茄BURP 基因,分析其理化性質、基因結構、共線性、啟動子元件等,并結合RT-qPCR驗證其在果實發育以及鹽脅迫、噴施植物生長調節劑后果實中的表達模式,為深入解析番茄BURP 基因家族在抗逆、果實發育及對外源植物生長調節劑的響應機理提供理論基礎,同時為番茄屬優良基因資源發掘及品種抗逆改良提供依據。
1 材料與方法
1.1 試驗材料與處理
以加工番茄模式品種‘M82’為試驗材料,由新疆農業科學院園藝作物研究所番茄遺傳育種課題組提供。將其種植在新疆特色果蔬基因組研究與遺傳改良重點實驗室,培養條件為:光照16 h/黑暗8 h,溫度(22±4) ℃,光照強度100 μmol·m?2·s?1,相對濕度60%。待4葉期時,挑選長勢一致的番茄苗,取其根、莖、葉樣,液氮速凍?80 ℃保存備用。將4葉期的番茄苗進行200 mmol·L?1的NaCl脅迫處理,于處理0.0、0.5、2.0、4.0、6.0、8.0 和12.0 h取樣備用,每個處理設置3個生物學重復。
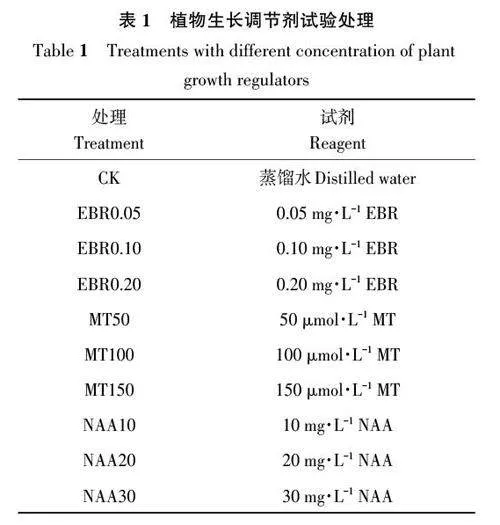
以櫻桃番茄‘京番粉星1號’品種為試驗材料研究BURP 基因在噴施植物生長調節劑后果實中的表達模式。分別在果實膨大期(expansionperiod,EP)、綠熟期(mature green period,MG)、轉色期(breaker period,BP)、紅熟期(red ripeningperiod,RRP)噴施不同水平的2,4-表油菜素內酯(2, 4-epibrassinolide, EBR)、褪黑素(melatonin,MT)、萘乙酸(naphthaleneacetic acid, NAA),以蒸餾水為對照(CK),詳見表1。每個處理設置3個生物學重復。
1.2 數據來源
從茄科基因組數據庫(http://solomics.agis.org.cn/tomato/)下載番茄和馬鈴薯(Solanum tuberosum)基因組注釋文件,水稻(Oryza sativa)的基因組注釋文件下載自EnsemblPlants(http://plants.ensembl.org/info/data/ftp/index.html),擬南芥的基因組注釋文件下載于TIAR (http://www.arabidopsis.org),玉米的基因注釋文件下載于玉米遺傳和基因組數據庫(http://maizegdb.org/genmoe)。
1.3 番茄BURP 基因的鑒定
從Pafm數據庫(https://www.ebi.ac.uk/interpro/search/text/)下載BURP結構域的隱馬爾可夫文件(PF03181)[21],以擬南芥、水稻、馬鈴薯和玉米BURP 基因的蛋白序列作為種子序列,本地構建BLAST庫,從番茄基因組中比對提取出BURP 候選基因(E-value=1×10-10)。利用Smart (http://smart.embl.de/)和NCBI CDD (https://www.ncbi.nlm.nih.gov/cdd)在線軟件分析驗證番茄BURP 基因的結構域,最終確定番茄BURP 基因[22‐23]。通過在線Expasy (https://web.expasy.org/protparam/)工具預測番茄BURP 基因的理化性質[24],通過WoLFPSORT (https://www.genscript.com/wolf-psort.html?src=leftbar)在線軟件進行番茄BURP蛋白的亞細胞定位[25]。
1.4 多物種BURP 系統進化樹構建
利用MEGA7 軟件將擬南芥、水稻、玉米、馬鈴薯和番茄的BURP 蛋白的氨基酸序列進行比對分析,并通過鄰接法(neighbour-joining,NJ)和最大似然法(maximum likelihood,ML)構建系統發育樹,Bootstrap檢驗設定為2 000次重復[26]。
1.5 番茄BURP 基因結構和保守基序分析
基于已有的番茄gff文件和番茄BURP 基因家族,利用TBtools 軟件繪制番茄BURP 基因結構。利用Docker得到SlBURP 基因家族的meme.xml文件,然后利用TBtools軟件預測分析SlBURP蛋白序列的結構域[27],搜尋motif值設置為20,其他為默認參數。
1.6 番茄BURP 基因染色體定位
根據基因組注釋文件得到染色體長度和番茄所有BURP 基因位點,再利用TBtools 軟件進行構圖。
1.7 番茄BURP 基因啟動子-順式作用原件和共線性分析
利用番茄基因組注釋文件提取番茄BURP 基因上游和下游2 000 bp的序列作為候選啟動子序列。通過PlantCare (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)網站進行順式作用元件分析[28],使用TBbool 軟件繪制順式作用元件圖[27]。利用TBtools 軟件進行多物種的基因共線性分析,最后使用Multiple Synteny Plot進行繪圖。
1.8 番茄BURP 基因的RT-qPCR 驗證
使用天根生化科技(北京)有限公司的RNA-prep純植物試劑盒(DP441)提取總RNA,再用All-In-One 5X RT MasterMix 反轉錄試劑盒(ABM)進行反轉錄,獲得cDNA。利用DNAMAN6軟件設計SlBURPs 家族成員RT-qPCR 引物(表2)。RT-qPCR 反應體系(20 μL)包含:10 μL 2×ChamQ Universal SYBR qPCR Master Mix (諾唯贊)、8.2 μL ddH2O、上下游引物各0.4 μL、1 μLcDNA模板。PCR程序為94 ℃預變性120 s;94 ℃變性5 s,退火15 s,72 ℃延伸10 s,40個循環。以番茄Actin 為內參基因,3個生物重復。采用2-△△Ct法[29]計算相對表達量。
2 結果與分析
2.1 番茄BURP 基因鑒定及理化性質分析
通過番茄全基因組鑒定,最終確定番茄BURP 基因家族成員12個,分別命名為SlBURP1~SlBURP12。由表3可知,番茄BURP 基因家族成員編碼的氨基酸序列長度差異較大,為322~1 200 aa,分子量為30 030.04~131 593.70 Da。其中,SlBURP6的氨基酸序列長為322 aa,分子量為30 030.04 Da;SlBURP2 的氨基酸序列長為1 200 aa,分子量為131 593.7 Da。等電點為6.05~9.22,其中2/3的基因等電點大于7,說明大多屬于堿性蛋白。脂肪指數和親水性表明,番茄BURP蛋白較為穩定,為疏水性蛋白。亞細胞定位主要定位在細胞質、細胞核、葉綠體和胞外。
2.2 番茄BURP 蛋白的系統進化分析
為研究BURP蛋白進化關系,對擬南芥(4個)、水稻(17個)、玉米(10個)、馬鈴薯(26個)、番茄(12個)和4個BURP蛋白家族(AtRD22、VfUSPs、BNM2和LePG1β)共73個BURP蛋白進行系統發育分析,結果(圖1)表明,它們被聚為7個亞族:BNM2-like、USP-like、RD22-like、PG1-like、BURP Ⅴ、BURP Ⅵ和BURP Ⅶ。12個番茄SlBURP 基因成員分布在BNM2-like、RD22-like、PG1β-like 這3 個亞族;馬鈴薯的26 個BURP 基因也分布在這3 個亞族。由于馬鈴薯和番茄都屬于茄科雙子葉植物,因此推測茄科中的BURP 基因功能較為相似。BURPⅤ、BURP Ⅵ和BURP Ⅶ這3 個亞族全是水稻和玉米的BURP 基因家族成員,或許這3個亞族是單子葉植物特有的BURP 基因家族。綜上所述,這些亞家族的BURP蛋白可能在單子葉、雙子葉植物中向不同的方向進化,并表現出不同的功能。
2.3 番茄BURP 編碼蛋白的保守基序與基因結構分析
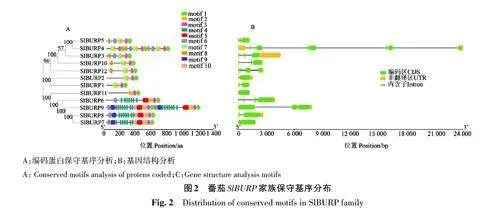
由圖2 可知,SlBURP3~SlBURP5、SlBURP10、SlBURP12相似性較高,都屬于RD22-like亞族,具有motif 1、motif 2、motif 3、motif 7、motif 8,其中SlBURP3和SlBURP5的保守基序排列和數目均一樣,SlBURP10和SlBURP12的保守基序排列和數目一樣;SlBURP1 和SlBURP2 相似性較高,均為BNM2-like 亞族,具有motif 1、motif 2、motif 3、motif 7,且保守基序的排列一樣;SlBURP6~SlBURP9和SlBURP11相似性較高,屬于PGlβ-like亞族,它們都具有motif 1~motif 6、motif 9 和motif10。綜上所述,同一亞族成員的保守基序十分相似。
進一步分析番茄12 個BURP 基因的編碼區(coding sequence, CDS)和非翻譯區(untranslated"region,UTR),結果(圖2B)表明,BNM2-like亞族的SlBURP1 和SlBURP2 有1個內含子和2個外顯子;USP-like 亞族的SlBURP3 和SlBURP5、SlBURP10和SlBURP12 有3個外顯子;而SlBURP4 有8個外顯子。由此表明,同一亞族的基因結構也較為相似。
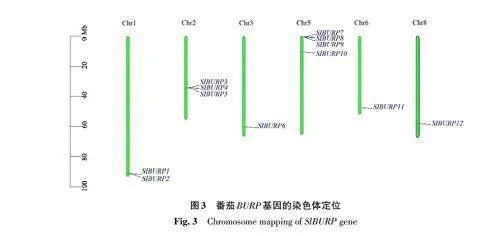
2.4 番茄BURP 基因的染色體定位分析
12個番茄BURP 基因不均勻地分布在6條染色體上(圖3)。Chr3、Chr6、Chr8這3條染色體的長臂末端各有1個BURP 基因,分別是SlBURP6、SlBURP11、SlBURP12。Chr5染色體有4個BURP基因,分別是SlBURP7~SlBURP10,多聚集在其長臂的頂端。Chr2分布有3個BURP 基因,分別是SlBURP3~SlBURP5。Chr1 有2 個BURP 基因,分別是SlBURP1 和SlBURP2,分布在長臂末端。
2.5 番茄BURP 基因啟動子中的順式作用元件分析
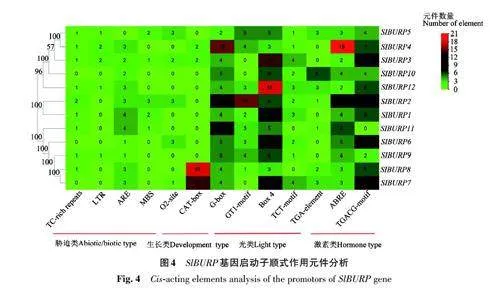
在SlBURPs 啟動子中,發現了6 種植物激素響應作用元件,分別為生長素(AuxRR-core 和TGA-element)、赤霉素(P-box、TATC-box和GAREmotif)、乙烯(ERE)、甲基茉莉酸(CGTAC-motif和TGACG-motif)、水楊酸(TCA-element)和脫落酸(ABRE);4種脅迫響應作用元件,分別為厭氧誘導(ARE)、干旱(MBS)、防御和應激響應(TC-richrepeats)、冷應激(LTR);18種光響應作用元件,分別為ACE、G-box、GT1-motif、MRE、Box4、ATCTmotif、I-box、GATA-motif、TCT-motif、AE-box、TCCC-motif、AE-box、GA-motif、Box Ⅱ、chs-CMA2a、chs-CMA1a、LAMP-element、AT1-motif;7種生長發育調控元件,分別是細胞周期(MSA-like)、生長(Circadian)、種子調控(RY-element)、代謝(O2-site)、分生組織(CAT-box)、胚乳(GCN4_motif)、柵欄葉肉細胞(HD-Zip 1)。挑選脅迫、生長、激素、光響應中數量最多的控制元件生成熱圖,結果(圖4)表明,從整體來看,4 類順式作用元件在SlBURPs 啟動子序列都有分布。其中,光響應元件在每個基因中都大量存在,激素響應元件ABRE、TGACG-motif 在每個基因中也存在較多,其中SlBURP4 基因屬于RD22-like亞族,有大量的ABRE。CAT-box 僅存在于SlBURP3、SlBURP4、SlBURP7、SlBURP8 中,且主要在SlBURP7、SlBURP8 中。SlBURP7、SlBURP8 為PG1β-like 亞族,說明SlBURP7、SlBURP8 主要控制植物生長發育。ARE 在11 個SlBURP 中都有分布,表明SlBURPs 基因在氧脅迫上也有重要作用。TC-richrepeats分布于9個SlBURP 中。LTR 和MBS分布于5個SlBURP 中。以上結果表明,BURP 基因在番茄中的生長發育與脅迫響應中起重要作用。
2.6 多物種間BURP 基因共線分析
為揭示番茄BURP 基因家族的進化及和直系同源的關系,對番茄、擬南芥、馬鈴薯、玉米和水稻BURP 基因家族進行共線性分析,結果(圖5)表明,4個擬南芥BURP 基因與番茄的12個BURP 基因有5個同源基因對,說明番茄和擬南芥BURP 基因家族成員具有較高的共線性,可能來自同一祖先;番茄和馬鈴薯有7個同源基因對;而水稻和玉米BURP 基因與番茄BURP 基因沒有同源基因對,說明水稻、玉米的BURP 基因與番茄BURP 基因在進化中存在分離,水稻、玉米BURP 基因可能屬于單子葉特有的1個亞族。
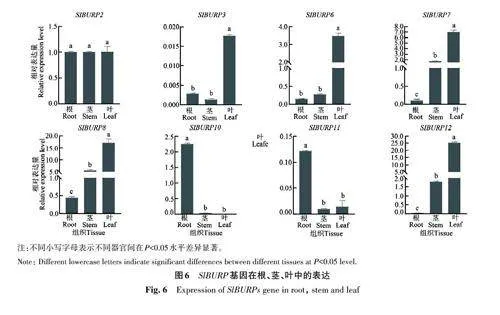
2.7 番茄BURP 基因的組織特異表達分析
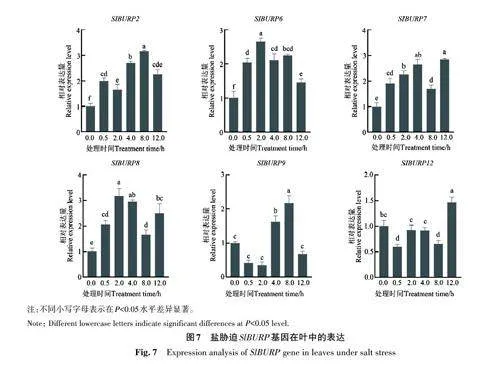
檢測SlBURP 在番茄不同組織器官中的表達模式,結果( 圖6)表明,SlBURP2、SlBURP3、SlBURP6、SlBURP7、SlBURP8、SlBURP10、SlBURP11、SlBURP12 在番茄根、莖、葉中均有表達;SlBURP6、SlBURP7、SlBURP8、SlBURP12 在葉中高表達,其中SlBURP8、SlBURP12 在葉中表達量分別是根中的17.0、25.0倍,是莖中的3.4、14.0倍;SlBURP2 在根、莖、葉中的表達水平較一致;SlBURP10 在根中表達量較高。
2.8 番茄BURP 基因在鹽脅迫和植物生長調節劑處理下的表達分析
在200 mmol·L-1 NaCl處理下,大部分SlBURP基因均對鹽脅迫產生積極響應(圖7)。SlBURP2、SlBURP6、SlBURP7、SlBURP8 的表達量較0 h均上調。其中,SlBURP7、SlBURP8 屬于PG1β-like 亞族,在脅迫2和4 h達到最高值,在8 h下調,12 h又上調,這2個基因的表達模式較一致。
與對照組相比,在植物生長調節劑處理下,果實發育受到了顯著影響( 圖8)。在轉色期,SlBURP5 在NAA10、EBR0.05、MT150處理后顯著上調;在紅熟期,SlBURP5 對NAA30、EBR0.05、MT150 處理響應最顯著;SlBURP8 和SlBURP9在NAA、EBR、MT 處理下整均顯著上調,其中,SlBURP8 在NAA30、EBR0.05、MT50 處理下的表達量分別為對照組的108、93、15倍,SlBURP9 在NAA20、EBR0.05、MT100的處理下表達量分別為對照組的94、90、31倍,表明這2個基因受NAA、EBR、MT強烈誘導。在綠熟期,SlBURP12 在3種植物生長調節劑處理下的表達量較對照組顯著上調,其中在NAA30、EBR0.1、MT150處理下最為顯著,且在EBR0.1處理下其表達量是對照組的19倍,說明SlBURP12 可能在果實發育期起調控作用。值得注意的是,SlBURP5 在所有時期3種植物生長調節劑處理下的表達量與對照組相比均有明顯差異,表明其在果實發育全程起著重要的調控作用。
3 討論
BURP 蛋白家族是植物界中廣泛存在的、比較保守的結構基因家族,在胚胎形成和種子發育過程中具有重要功能。BURP 基因家族在植物生長發育、非生物脅迫、激素響應等方面起著不可或缺的作用,但不同植物中的BURP 基因數量有較大差異。番茄中有12個BURP 基因,大約是水稻(17)的2/3、陸地棉(65)的1/5、大豆(23)的1/2,但和玉米(10)相近[4,19,30]。番茄BURP 基因在第2和5號染色體上分別有4和3個;在第1、2、5號染色體上均成簇出現,且這些基因的序列也較相似,其在亞族上的分布和保守基序的排列和數量也基本一致。這種現象在水稻、陸地棉、大豆等作物上也有發現[4,19,30]。此外,在這些成簇的基因中,5號染色體的SlBURP8 和SlBURP9 發生了串聯復制事件。位于毛果楊4號染色體上的PtBURP1和PtBURP2,以及9號染色體上的基因簇也發生了基因復制事件[31]。在陸地棉中,基因復制特別是片段復制在GhBURP 基因家族的形成中起著重要作用[18]。綜上所述,基因復制在BURP 基因對植物生長發育和脅迫響應中起重要作用。
系統發育樹把來自5個物種的BURP 家族成員分為7個亞族。RD22-like、PG1β-like亞族由雙子葉和單子葉植物的BURP 基因組成。BURP Ⅴ、BURP Ⅵ和BURP Ⅶ亞族僅由單子葉植物的BURP 基因組成;而BNM2-like亞族由雙子葉植物的BURP 基因組成。這說明BURP 基因可能起源于單子葉和雙子葉分化之前,且單子葉植物和雙子葉植物間在功能上可能也存在差異。研究表明,單子葉植物和雙子葉植物的部分BURP 基因也會分布在不同亞族 [4,10,18‐19,32‐33]。
BURP 蛋白家族參與脅迫誘導[34-36]。本研究表明,番茄中有7個BURP 基因不同程度的受鹽和植物生長調節劑的誘導或抑制,這與水稻BURP基因響應鹽脅迫的結果一致[4]。擬南芥AtRD22 基因由非生物脅迫(干旱和鹽度)誘導,且該基因隨后被用作脅迫反應的指標[9]。本研究發現,在果實發育過程噴施植物生長調節劑NAA、EBR、MT,SlBURP5、SlBURP8、SlBURP9、SlBURP12 均受到不同程度的誘導,其中,SlBURP8、SlBURP9 在NAA、EBR處理下的表達量顯著高于對照組。在果實發育的4 個時期,SlBURP5 在EBR0.05、SlBURP12 在MT150處理下均上調,說明SlBURP基因在番茄果實發育中起著重要作用。含有BURP結構域的蛋白已在許多植物中被發現,且BURP 基因家族也參與植物營養和生殖發育功能[37]。因此,本研究利用生物信息學方法對番茄BURP 基因家族篩選和鑒定,并根據RT-qPCR檢測其在逆境脅迫和植物生長調節劑處理下的表達模式,為深入研究番茄BURP 基因在非生物脅迫和果實發育中的調控機理提供了理論依據。
參考文獻
[1] PHILLIPS K, LUDIDI N. Drought and exogenous abscisic acid
alter hydrogen peroxide accumulation and differentially
regulate the expression of two maize RD22-like genes [J/OL].
Sci. Rep., 2017, 7(1): 8821 [2023-07-31]. https://doi.org/
10.1038/s41598-017-08976-x.
[2] VAN SON L, TIEDEMANN J, RUTTEN T, et al .. The BURP
domain protein AtUSPL1 of Arabidopsis thaliana is destined to
the protein storage vacuoles and overexpression of the cognate
gene distorts seed development [J]. Plant Mol. Biol., 2009, 71(4):
319-329.
[3] JIN J, JEMAA E, XU Z, et al .. Arabidopsis ETHYLENE
INSENSITIVE 3 directly regulates the expression of PG1β-like
family genes in response to aluminum stress [J/OL]. J. Exp.
Bot., 2022, 14:161 [2023-07-31]. https://doi.org/10.1093/jxb/
erac161.
[4] DING X P, HOU X, XIE K B, et al.. Genome-wide identification of
BURP domain-containing genes in rice reveals a gene family
with diverse structures and responses to abiotic stresses [J].
Planta, 2009, 230(1):149-163.
[5] KOMATSU S, NANJO Y, NISHIMURA M. Proteomic analysis
of the flooding tolerance mechanism in mutant soybean [J]. J.
Proteomics, 2013, 79:231-250.
[6] TANG Y L, LI X J, ZHONG Y T, et al .. Functional analysis of
soybean SALI3-2 in yeast [J]. Shenzhen Univ. Sci. Eng., 2007,
24:324-330.
[7] GAN D, JIANG H, ZHANG J, et al .. Genome-wide analysis of
BURP domain-containing genes in maize and sorghum [J]. Mol.
Biol. Rep., 2011, 38(7):4553-4563.
[8] YU S W, ZHANG L D, ZUO K J, et al .. Isolation and
characterization of a BURP domain-containing gene BnBDC1
from Brassica napus involved in abiotic and biotic stress [J].
Physiol. Plantarum, 2004, 122(2):210-218.
[9] THAMMEGOWDA H V, LE V S, CHRISTIANE S, et al ..
AtRD22 and AtUSPL1, members of the plant-specific BURP
domain family involved in Arabidopsis thaliana drought
tolerance [J/OL]. PLoS One, 2014, 9(10): e110065 [2023-07-
31]. https://doi.org/10.1371/journal.pone.0110065.
[10] TEERAWANICHPAN P, XIA Q, CALDWELL S J, et al ..
Protein storage vacuoles of Brassica napus zygotic embryos
accumulate a BURP domain protein and perturbation of its
production distorts the PSV [J]. Plant Mol. Biol., 2009, 71(4):
331-343.
[11] WANG A M, XIA Q, XIE W S, et al .. The classical ubisch
bodies carry a sporophytically produced structural protein
(RAFTIN) that is essential for pollen development [J]. Proc.
Natl. Acad. Sci. USA, 2003, 100:14487-14492.
[12] XU X Y, YANG H K, SINGH S P, et al .. Genetic manipulation
of non-classic oilseed plants for enhancement of their potential as a
biofactory for triacylglycerol production [J/OL]. Engineering, 2018,
4(4):11 [2023-07-31]. https://doi.org/10.1016/j.eng.2018.11.
[13] XU B, GOU J Y, LI F G, et al .. A cotton BURP domain protein
interacts with α-expansin and their co-expression promotes
plant growth and fruit production [J]. Mol. Plant, 2013, 6(3):
945-958.
[14] MATUS J T, AQUEA F, ESPINOZA C, et al .. Inspection of the
grapevine BURP superfamily highlights an expansion of RD22
genes with distinctive expression features in berry development
and ABA-mediated stress responses [J/OL]. PLoS One, 2014, 9
(10): e110372 [2023-07-31]. https://doi.org/10.1371/journal.
pone.0110372.
[15] 宋單單,史夢雪,高金匯,等.復配型轉光棚膜光學性能及其
對日光溫室番茄生長及果實品質的影響[J].植物生理學報,
2022,58(11):2218-2226.
SONG D D, SHI M X, GAO J H, et al .. Optical properties of
complex-type of light conversion greenhouse films and their
effects on the growth and fruit qualities of tomato in solar
greenhouse [J]. J. Plant Physiol., 2022, 58(11):2218-2226.
[16] 劉向蕾,尹亞紅,高玉迪,等.番茄SlNPF68 基因參與缺氮條
件下根系覓食反應[J].植物生理學報,2022,58(7):1212-1220.
LIU X L, YIN Y H, GAO Y D, et al .. SlNPF68 gene involved
in root foraging response under nitrogen deficiency in tomato
[J]. J. Plant Physiol., 2022, 58(7):1212-1220.
[17] 萬玉通,裴茂松,韋同路,等.甲基化修飾影響果實生長發育
的研究進展[J].植物生理學報,2022,57(3):531-541.
WAN Y T, PEI M S, WEI T L, et al .. Progress of methylation
modification on fruit development [J]. J. Plant Physiol., 2022,
57(3):531-541.
[18] SUN H R, WEI H L, WANG H T, et al .. Genome-wide
identification and expression analysis of the BURP domaincontaining
genes in Gossypium hirsutum [J/OL]. BMC
Genomics, 2019, 20:558 [2023-07-31]. https://doi.org/10.1186/
s12864-019-5948-y.
[19] XU H, LI Y, YAN Y, et al .. Genome-scale identification of
soybean BURP domain-containing genes and their expression
under stress treatments [J]. BMC Plant Biol., 2010, 10(1):1-16.
[20] JEONG H Y, NGUYEN H P, EOM S H, et al .. Integrative
analysis of pectin methylesterase (PME) and PME inhibitors in
tomato (Solanum lycopersicum): identification, tissue-specific
expression, and biochemical characterization [J]. Plant Physiol.
Biochem., 2018, 132:557-565.
[21] XU Q, DUNBRACK R L. Assignment of protein sequences to
existing domain and family classification systems: Pfam and
the PDB [J]. Bioinformatics, 2012, 28(21):2763-2772.
[22] SONNHAMMER E, EDDY S R, DURBIN R. Pfam: a
comprehensive database of protein domain families based on
seed alignments [J]. Proteins, 2015, 28(3):405-420.
[23] SCHULTZ J, COPLEY R R, TOBIAS D, et al .. SMART: a web-
based tool for the study of genetically mobile domains [J].
Nucl. Acids Res., 2000, 28:231-234.
[24] ARTIMO P, JONNALAGEDDA M, ARNOLD K, et al ..
ExPASy: SIB bioinformatics resource portal [J]. Nucl. Acids
Res.. 2012, 40:597-603.
[25] HORTON P, PARK K J, OBAYASHI T, et al .. WoLF PSORT:
protein localization predictor [J]. Nucl. Acids Res., 2007, 35:
585-587.
[26] KUMAR S, STECHER G, TAMURA K. MEGA7 molecular
evolutionary genetics analysis version 7.0 for bigger datasets [J].
Mol. Biol. Evol., 2015, 33:1870-1874.
[27] CHEN C, CHEN H, ZHANG Y, et al .. TBtools: an integrative
toolkit developed for interactive analyses of big biological data
[J/OL]. Mol. Plant, 2020, 13(8): 009 [2023-07-31] https://
doi.org/10.1016/j.molp.2020.06.009.
[28] ROMBAUTS, DEHAIS, MONTAGU V, et al .. PlantCARE, a
plant cis-acting regulatory element database [J]. Nucl. Acids
Res., 1999, 27:295-296.
[29] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene
expression data using real-time quantitative PCR and the 2-ΔΔCT [J].
Methods, 2001, 25:492-508.
[30] 張中保,吳忠義,魏建華.玉米BURP 家族基因的鑒定和分
析[J].玉米科學,2014,22(3):36-42.
ZHANG Z B, WU Z Y, WEI J H. Genome-wide analysis and
identification of ZmBURP genes family in maize [J]. J. Maize
Sci., 2014, 22(3):36-42.
[31] SHAO Y H, WEI G, WANG L, et al .. Genome-wide analysis of
BURP domain-containing genes in Populus trichocarpa [J]. J.
Integr. Plant Biol., 2011, 53(9):743-755.
[32] GRANGER C, CORYELL V, KHANNA A, et al ..
Identification, structure, and differential expression of
members of a BURP domain containing protein family in
soybean [J/OL]. Genome, 2002, 45(4):693 [2023-07-31]. https://
doi.org/10.1139/g02-032.
[33] LI Y, CHEN X, CHEN Z, et al .. Identification and expression
analysis of BURP domain-containing genes in Medicago
truncatula [J/OL]. Front. Plant Sci., 2016, 7:485 [2023-07-31].
https://doi.org/10.3389/fpls.2016.00485.
[34] YU S W, ZHANG L D, ZUO K J, et al .. Isolation and
characterization of a BURP domain-containing gene BnBDC1
from Brassica napus involved in abiotic and biotic stress [J].
Physiol. Plantarum, 2004, 100:210-218.
[35] WANG H M, ZHOU L, FU Y P, et al .. Expression of an
apoplast-localized BURP-domain protein from soybean
(GmRD22) enhances tolerance towards abiotic stress [J]. Plant
Cell Environ., 2012, 35(11):1932-4197.
[36] 米子嵐,鐘活權,江年瓊,等.BURP蛋白家族與植物對非生物
脅迫的響應[J].中國細胞生物學學報,2015, 37(9):1302-1308.
MI Z L, ZHONG H Q, JIANG N Q, et al .. BURP Proteins
Family and the Response of Plant to Abiotic Stress [J]. J. Cell
Biol., 2015, 37(9):1302-1308.
[37] WANG L H, WU N N, ZHU Y, et al .. The divergence and
positive selection of the plant-specific BURP-containing protein
family [J]. Ecol. Evol., 2015, 5(22):5394-5412.

