除風益損湯對兔角膜損傷后自噬相關因子及TGF-β1、MMP-2表達的影響


〔摘要〕 目的 探討除風益損湯對兔角膜損傷的修復作用及對自噬相關因子和轉化生長因子-β1(TGF-β1)、基質金屬蛋白酶-2(MMP-2)的影響。方法 隨機將84只新西蘭大白兔分為6組,具體為空白組、模型組、中藥組、自噬促進組、自噬抑制組、自噬促進+中藥組、自噬抑制+中藥組,每組12只,每一組下又分為3個亞組,每個亞組4只,分別供造模后第7、14、28天檢測。動物模型建立后各組在第7、14、28天觀察角膜以及角膜熒光素染色情況,記錄角膜混濁評分,采用激光共焦斷層掃描儀觀察角膜基質層修復情況,用Western blot檢測角膜中TGF-β1、微管相關蛋白輕鏈3(LC3)比值、MMP-2的蛋白表達。結果 (1)角膜基質激光共焦斷層掃描結果:除空白組外,其余各組角膜在造模后第7天均有成纖維細胞浸潤及膠原沉積。隨著時間的推移,中藥組、自噬促進組、自噬促進+中藥組中成纖維細胞及膠原沉積較其他組減少。(2)顯微鏡觀察白兔角膜情況:空白組白兔的角膜在第7、14、28天皆清晰透明。其余各組白兔的角膜在第7天均出現混濁,熒光素著染,隨著時間推移熒光素著色范圍縮小,角膜混濁逐漸消褪。角膜混濁評分顯示,與模型組相比,第28天自噬抑制組、自噬抑制+中藥組評分較高(Plt;0.05)。(3)LC3-Ⅱ/Ⅰ:與模型組相比,各時間段中藥組、自噬促進組LC3-Ⅱ/Ⅰ表達均升高(Plt;0.05),自噬抑制組表達降低(Plt;0.05)。(4)TGF-β1:與模型組相比,各時間段中藥組、自噬促進組表達均較低(Plt;0.05),自噬抑制組表達較高(Plt;0.05)。(5)MMP-2:與模型組相比,各時間段中藥組、自噬促進組表達均較低(Plt;0.05),自噬抑制組表達較高(Plt;0.05)。結論 除風益損湯、氯化鋰可以促進角膜損傷的愈合,有助于減少瘢痕形成,其機制是通過促進自噬和調控TGF-β1、MMP-2的水平來實現的。
〔關鍵詞〕 除風益損湯;角膜損傷;自噬;微管相關蛋白輕鏈3;轉化生長因子-β1;基質金屬蛋白酶-2
"〔中圖分類號〕R285.5"""""""" 〔文獻標志碼〕A""""""""" 〔文章編號〕doi:10.3969/j.issn.1674-070X.2025.02.004
〔收稿日期〕2024-09-02
〔基金項目〕國家自然科學基金面上項目(82174443);湖南省教育廳“芙蓉學者”獎勵計劃(2022年);湖南省衛生健康委高層次人才計劃(2023年);湖南省眼科疾病(中醫)臨床醫學研究中心(2023SK4038);湖南中醫藥大學一流學科開放基金(2021ZYX05)。
〔通信作者〕*姚小磊,男,博士,主任醫師,博士研究生導師,E-mail:yxlshh@126.com;彭清華,男,博士,教授、主任醫師,博士研究生導師,E-mail:pqh410007@126.com。
Effects of Chufeng Yisun Decoction on autophagy related factors and expressions of TGF-β1 and MMP-2 after corneal injury in rabbits
ZENG Lingcong1,3, WU Kai1,2, ZHU Bingyao1,4, LIU Qianhong1,2, CHEN Xiong1,2,
PENG Qinghua1*, YAO Xiaolei1,2*
1. Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 2. The First Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410007, China; 3. Chenzhou Municipal Hospital of Traditional Chinese Medicine, Chenzhou, Hunan 424499, China; 4. Shenzhen Hospital of Integrated Chinese and Western Medicine, Shenzhen, Guangdong 518033, China
〔Abstract〕 Objective To investigate the repair effects of Chufeng Yisun Decoction on corneal injury in rabbits and its impact on autophagy related factors, as well as the expressions of TGF-β1, and MMP-2. Methods A total of 84 New Zealand white rabbits were randomized into six groups, including blank group, model group, Chinese medicines group, autophagy promotion group, autophagy inhibition group, autophagy promotion+Chinese medicines group and autophagy inhibition+Chinese medicines group, with 12 rabbits in each group. Each group was further divided into three subgroups of four rabbits each, for observations and testing at 7, 14, and 28 days post-modeling. After establishing the animal model, the corneal condition and corneal fluorescein staining were observed on days 7, 14, and 28 in each group, and the corneal opacity score was recorded. A confocal laser scanning microscopy was used to observe the repair of the corneal stroma. Western blot was employed to determine the expressions of transforming growth factor-β1 (TGF-β1), the ratio of microtubule-associated protein light chain 3 (LC3)-II/I, and matrix metalloproteinase-2 (MMP-2) in the cornea. Results (1) Confocal laser scanning of the corneal stroma: Except for the blank group, all other groups showed fibroblast infiltration and collagen deposition in the cornea on day 7 post-modeling. Over time, the Chinese medicines group, autophagy promotion group, and autophagy promotion+Chinese medicines group exhibited reduced fibroblast and collagen deposition compared to the other groups; (2) Microscopic observation of rabbit corneas: The corneas of rabbits in the blank group were clear and transparent on days 7, 14, and 28. The corneas of rabbits in all other groups were hazy and stained with fluorescein on day 7, with the fluorescein staining area decreasing and corneal opacity gradually" fading over time. Corneal opacity score showed that, compared with the model group, the autophagy inhibition and autophagy inhibition+Chinese medicines groups had higher scores on day 28 (Plt;0.05). (3) LC3-Ⅱ/Ⅰ: Compared with the model group, the LC3-Ⅱ/Ⅰ expression was higher in the Chinese medicines and autophagy promotion groups at all time points (Plt;0.05), while it was lower in the autophagy inhibition group (Plt;0.05). (4) TGF-β1: Compared with the model group, the TGF-β1 expression was lower in the Chinese medicines and autophagy promotion groups at all time points (Plt;0.05), while it was higher in the autophagy inhibition group (Plt;0.05). (5) MMP-2: Compared with the model group, the MMP-2 expression was lower in the Chinese medicines and autophagy promotion groups at all time points (Plt;0.05), while it was higher in the autophagy inhibition group (Plt;0.05). Conclusion Chufeng Yisun Decoction and lithium chloride can promote the healing of corneal injuries and help reduce scar formation, and their mechanisms involve promoting autophagy and regulating the levels of TGF-β1 and MMP-2.
〔Keywords〕 Chufeng Yisun Decoction; corneal injury; autophagy; microtubule-associated protein light chain 3; transforming growth factor-β1; matrix metalloproteinase-2
本文引用: 曾令聰, 吳" 凱, 朱冰瑤, 劉倩宏, 陳" 雄, 彭清華, 姚小磊. 除風益損湯對兔角膜損傷后自噬相關因子及TGF-β1、MMP-2表達的影響[J]. 湖南中醫藥大學學報, 2025, 45(2): 212-219.
角膜位于眼球結構最外層,易受到物理、化學、感染等外界因素的損傷,各種原因導致的角膜損傷,皆可使角膜過度纖維化而形成瘢痕,最終導致角膜盲。角膜混濁或角膜瘢痕在全球范圍內影響超1000萬人,是全球致盲的主要原因[1]。在臨床上,對于角膜瘢痕引起的視力障礙主要以角膜移植術為主要治療手段,但手術風險高、價格昂貴,且存在術后移植排斥的風險[2]。因此,尋找風險較小、經濟的有效治療方法來促進角膜損傷后修復及減少瘢痕形成至關重要。
角膜損傷修復過程是一個多因子參與的過程,現有的研究發現,轉化生長因子-β1(transforming growth factor-β,TGF-β1)在角膜修復過程中起重要的作用:能誘導傷口中成纖維細胞分化為不透明的肌成纖維細胞促進傷口愈合[3];同時促使肌成纖維細胞分泌大量的細胞外基質(extracellular matrix,ECM),其中ECM中的金屬蛋白酶-2(matrix metalloproteinase-2,MMP-2)沉積[4-5]。大量的肌成纖維細胞、MMP-2的沉積能降低角膜透明度[3],進而損害視力。而自噬過程存在于角膜損傷修復整個過程,當自噬體或者溶酶體活性降低,角膜組織中有害因素或者過剩因子及蛋白積累,最終導致角膜瘢痕[6]。研究發現,氯化鋰通過調節自噬水平來影響TGF-β1的表達[7]。因此,通過調節自噬活性來減少TGF-β1、MMP-2的表達來抑制角膜瘢痕的形成。
中醫學認為角膜損傷所產生的角膜瘢痕“翳”的范疇,《眼科秘訣·論退翳法》中“翳者,氣血津凝而不行,結聚而成云翳”,歸結為角膜氣血津液運行失常是“翳”產生的病機,而外傷是導致氣血津液運行失常最常見原因。中醫學擁有龐大的藥物資源,在眼表損傷的治療中已取得良好的成效,除風益損湯便是代表之一。除風益損湯出自《原機啟微》:“主治目為物所傷”為中醫治療眼部外傷的常用代表方劑。本方由熟地黃、當歸、白芍、川芎、藁本、前胡、防風組成,具有養血活血、祛風明目之功,現代常用于眼外傷及眼科術后,預防及治療氣血津液運行失常產生翳障的常用方劑,使用除風益損湯有助于調整氣血運行,從而促進角膜的修復[8-10]。故除風益損湯理論上可減少“翳”的形成。本實驗將以新西蘭大白兔為實驗對象,從TGF-β1、MMP-2以及自噬相關因子著手,研究除風益損湯是否有助于減少角膜損傷后瘢痕的形成,并探討其機制,旨在為除風益損湯在角膜損傷中的應用提供理論依據和技術借鑒。
1 材料
1.1" 動物
健康成年的普通級新西蘭兔84只,雄性,體質量2.0~2.5 kg,許可證號:SCXK(湘)2020-0005,購自湖南太平生物科技有限公司。均在20~25 ℃環境中以普通飼料喂養,本研究方案已通過湖南中醫藥大學實驗動物倫理委員會審批(編號:LL20210921001)。
1.2" 藥物配制
除風益損湯組成:熟地黃、當歸、白芍藥、川芎各3 g;藁本、前胡、防風各2.1 g,藥物購自湖南中醫藥大學第一附屬醫院,廠家為四川新綠色藥業科技發展有限公司。該藥為顆粒劑,根據每次實驗用量,分袋密封包裝,室溫條件下儲存。
根據NIE等[7]的報道,發現20 mmol/L氯化鋰處理過的角膜基質細胞活性高,故將0.84 g氯化鋰顆粒溶于100 mL生理鹽水中用于角膜板層注射。0.5 mg/mL 3-甲基腺嘌呤(3-methyladenine,3-Ma):將5 mg 3-Ma溶解于10 mL生理鹽水中。
1.3" 主要試劑與儀器
TGF-β抗體、LC3抗體、MMP-2抗體(Proteintech,批號:21898-1-AP,14600-1-AP,10373-2-AP);氯化鋰(阿法丁,批號:7447418);3-甲基腺嘌呤(MCE,批號:HY-19312);戊巴比妥鈉(Sigma,批號:P3761);脫脂奶粉(伊利,批號:66196131T);三硫叔糖醇(Biosharp,批號:Amresco0281);SDS、甘油、甲醇(國藥集團化學試劑有限公司,批號:30166428、 10010618、10014118);TEMED、Trise-Base、溴酚藍、丙烯酰胺、甲叉丙烯酰胺、PMSF(Amresco,批號:Amresc00761、Exp2017/12、BO449-5G、Exp2016109、Amresc00172、329-98-6);PVDF膜(Millipore,批號:IPVH00010);BCA蛋白濃度測定試劑盒(增強型)(上海碧云天生物有限公司,批號:P0010S);電泳儀(Tanon,批號:EPS300);酶標儀(Thermo,批號:muLI?SKANMK3);4 ℃離心機(Eppendorf,批號:Centrifuge 5415R);月形隧道刀頭(宿遷天工醫療,型號:2.8 mm月形刀);共焦激光斷層掃描儀(德國Heidelberg Engineering GmbH,型號:HRT3);7×~50×倍三目顯微鏡、4800萬像素高清相機(深圳市海約電子有限公司,型號“HY-0750A);角膜環鉆(淮安中林東晟醫療器械有限公司,型號:直徑6 mm)。
2 方法
2.1" 分組
取84只健康雄性新西蘭大白兔,隨機分為7組,每組12只,具體為空白組、模型組、中藥組、自噬促進組、自噬抑制組、自噬促進+中藥組、自噬抑制+中藥組。分別供造模后7、14、28 d檢測。
2.2" 兔角膜損傷模型制備
根據所查閱文獻及臨床基礎,參照CONNON[11]及徐路星[12]的方法,對于造模方式進行改良,予空白組不做處理,其他組制作成兔角膜損傷動物模型。造模方法:將新西蘭大白兔固定于兔固定箱中,剔除雙耳及雙眼周圍毛發,充分暴露耳緣靜脈及眼周皮膚,將10%戊巴比妥鈉溶液以耳緣靜脈注射的方式麻醉白兔,待白兔麻醉后置其于干凈手術臺,常規消毒鋪巾,以奧布卡因滴眼劑滴眼表面麻醉3次。在顯微鏡下使用6 mm的角膜環鉆在角膜中央進行旋轉按壓,留下直徑約6 mm的圓形印跡,使用2.8 mm月形隧道刀剔除角膜厚度約100 μm,造成直徑為6 mm,深度為100 μm左右的圓形角膜創面。
2.3" 干預方法
造模完成后,空白組、模型組不做特殊干預。參照由新英[13]的方法稍作改良,使用32G注射針頭在自噬促進組、自噬促進+中藥組角膜的3點、6點、9點、12點位置注射20 mmol/L氯化鋰溶液,每個方位注射0.05 mL。使用32G注射針頭在自噬抑制組和自噬抑制+中藥組角膜的3點、6點、9點、12點位置注射0.5 mg/mL的3-MA溶液,每個方位注射0.05 mL。術后均予以左氧氟沙星凝膠抗感染。中藥組、自噬促進+中藥組、自噬抑制+中藥組每天予以中藥湯劑灌胃5 mL。
2.4" 觀測指標
分別在造模后第7、14、28天對白兔進行角膜激光共焦斷層掃描儀檢查、高倍顯微鏡眼前段觀察。之后處死動物,剪取角膜組織低溫保存以供Western blot檢測。
2.4.1" 角膜激光共焦斷層掃描儀檢查" 在造模7、14、28 d后,對新西蘭大白兔進行激光共焦斷層掃描儀檢查。將新西蘭大白兔置于兔固定箱中并放于穩定平臺,予以奧布卡因滴眼劑滴眼進行表面麻醉3次。將左氧氟沙星凝膠涂于角膜顯微鏡鏡頭表面,蓋上無菌接觸帽。將兔頭固定,并貼近于激光共焦斷層掃描儀的激光攝像頭。調整激光頭位置,使激光攝像頭光束位于角膜損傷病灶區域后向前緩慢推進激光攝像頭。當前接觸帽與角膜之間相距5~10 mm時,再緩慢調整激光攝像頭的位置,讓角膜接觸帽中央對準角膜激光束反射光點。然后緩慢旋轉推進激光攝像頭,讓角膜與角膜接觸帽之間保持一種輕微的接觸。系統上設定焦距平面為0,擰動激光掃描旋鈕改變焦平面,觀察并采集不同深度的角膜圖像。
2.4.2" 高倍顯微鏡眼前段觀察" 在造模7、14、28 d后,對新西蘭大白兔進行高倍顯微鏡觀察。將新西蘭大白兔置于兔固定箱中并放于穩定平臺。予以奧布卡因滴眼劑進行表面麻醉3次后放開瞼器。調整顯微鏡位置,使視野落于角膜表面,充分暴露角膜及角膜創面區域。調整顯微鏡焦距,觀察兔角膜并采集圖像。然后用2%熒光素鈉滴眼液對兔角膜進行染色,顯微鏡轉換為鈷藍色燈,調整顯微鏡焦距,觀察并采集圖像。
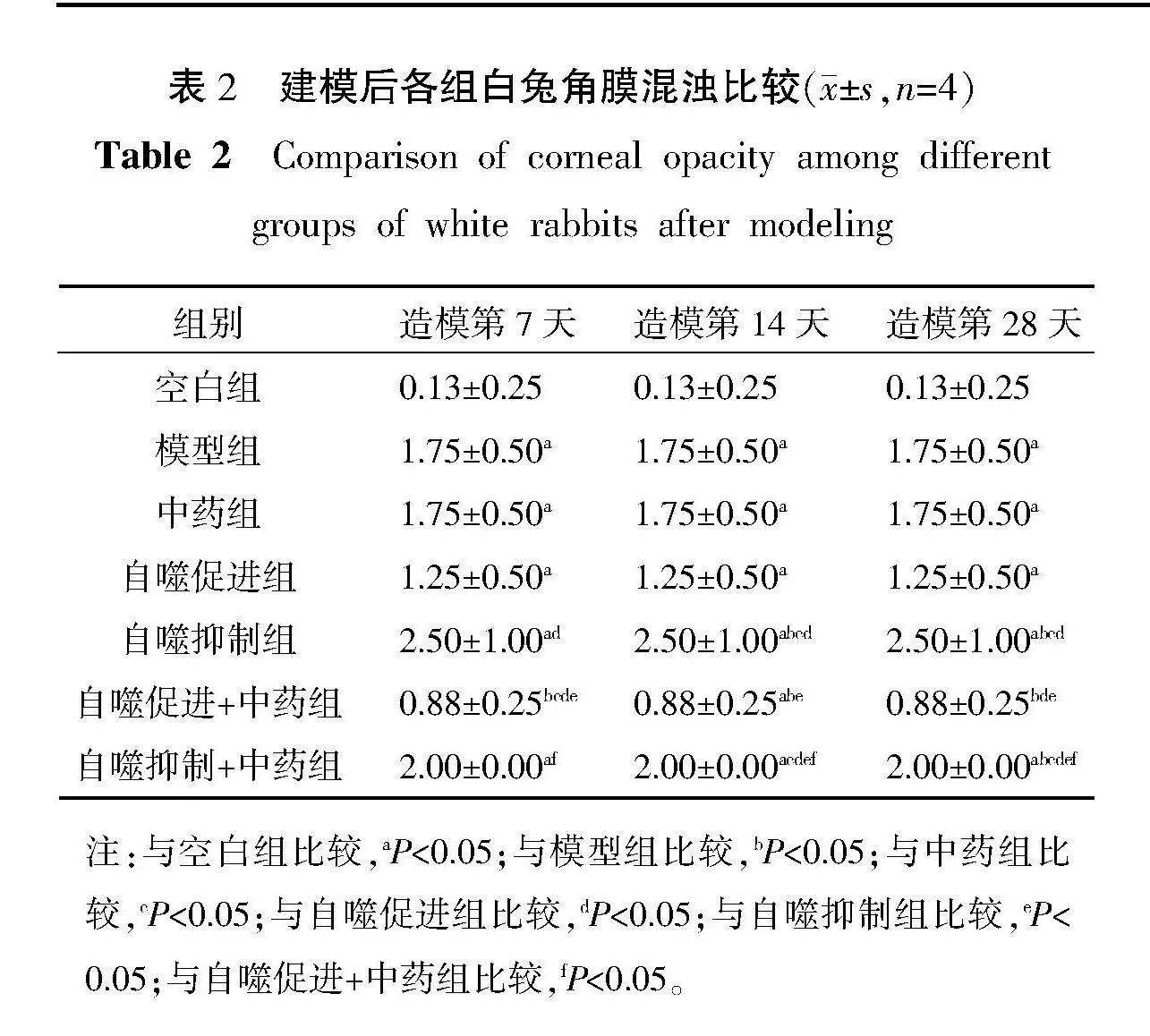
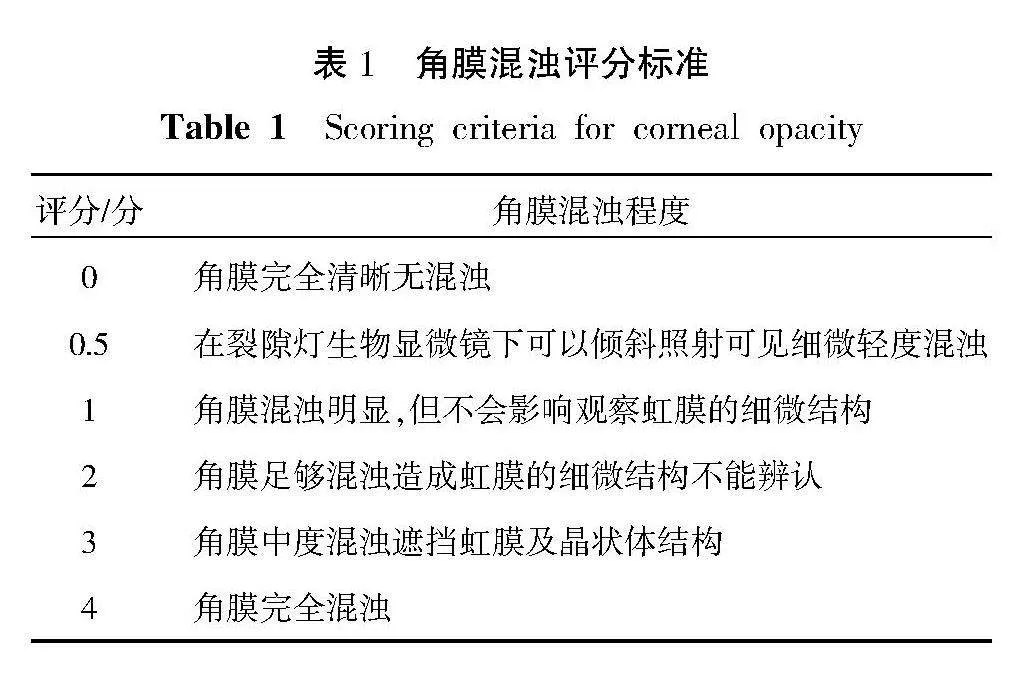
2.4.3" 角膜混濁評分來評估角膜瘢痕的程度" 在造模7、14、28 d后,對7組新西蘭大白兔進行裂隙燈生物顯微鏡觀察下觀察角膜混濁及基本情況進行臨床評分,臨床評分根據SHARMA等[14]和FANTES等[15]報道的量表進行分級,評分細則及具體標準。詳見表1。
2.4.4" Western blot檢測TGF-β1、LC3-Ⅱ/Ⅰ、MMP-2蛋白表達" 準備1×TBST、10×電泳緩沖液、10×電轉緩沖液、5%牛奶封閉液,使用RIPA強裂解液稀釋PMSF,配制裂解液,按每60 mg組織粉末加入150 μL RIPA裂解液振蕩混勻后放入冰盤上,搖床上搖1 h。將裂解溶液放入4 ℃的低溫冰箱中12 000 r/min離心5 min,取上清進行蛋白定量。采用上海碧云天生物有限公司BCA蛋白濃度測定試劑盒測定蛋白質濃度。將不同濃度蛋白上樣、電泳、轉膜、封閉,加入對應的一抗在搖床孵育一夜。第2天回收一抗,清洗后加入對應的二抗,室溫孵育2 h。洗去多余二抗,制備AB液,加入AB混合液,用化學發光成像系統曝光30/60,觀察結果并保存圖片。
2.5" 統計學分析
應用SPSS 25.0軟件進行統計分析。定量結果采用“x±s”表示。多組間定量資料或數值變量資料比較符合正態性及方差齊性則采用單因素方差分析及多重比較;不滿足正態性及方差齊性則采用Kruskal-Wallis H檢驗,兩兩比較。均以Plt;0.05表示差異具有統計學意義。
3 結果
3.1" 角膜基質激光共焦斷層掃描結果
空白組在3次測量時間點皆顯示角膜基質層的基質細胞分布均勻,細胞呈橢圓狀、細胞核高反光,細胞間網狀連接,細胞間未見膠原沉積。模型組在造模后第7天顯示基質細胞密度降低并被細長狀成纖維細胞代替并伴有炎癥細胞浸潤,細胞間聯系模糊;在第14天時,角膜基質見成纖維細胞浸潤;第28天時,基質層見大量肌成纖維細胞及膠原沉積。中藥組在造模7天后顯示基質中有成纖維細胞浸潤;第14天可見成纖維細胞及膠原沉積,第28天可見少量成纖維細胞浸潤及膠原沉積。自噬促進組在造模第7天時可見少許炎癥細胞、成纖維細胞;第14天可見少許成纖維細胞;第28天可見少量成纖維細胞及膠原沉積。自噬抑制組在造模后第7天可見基質細胞密度降低,可見瘢痕;第14天可見大量成纖維細胞及膠原沉積;第28天可較多膠原沉積。自噬促進+中藥組在造模第7天基質細胞密度較低,少量膠原沉積;第14天可基質中少量成纖維細胞浸潤;第28天可見少量成纖維細胞及膠原沉積。自噬抑制+中藥組在造模第7天可見大量成纖維細胞及炎癥細胞浸潤;第14天可見基質間存在成纖維細胞及少量膠原沉積;第28天可見成纖維細胞及肌成纖維細胞,角膜見褶皺現象。詳見圖1。
3.2" 顯微鏡眼前節形態表現
3.2.1" 顯微鏡下角膜情況" 空白組角膜在第7、14、28天皆清晰透明。其余各組第7天均出現角膜混濁,角膜不平整呈半透明狀,熒光素著染,隨著時間推移熒光素著染范圍縮小,角膜混濁逐漸消褪。在第28天,各組熒光素著染范圍較第7天減小,角膜混濁減輕。其中,模型組角膜表層不均勻,角膜混濁伴有輕微的熒光著染,中藥組及自噬促進組在角膜混濁程度較模型組輕,可模糊透間虹膜紋理。自噬促進+中藥組角膜混濁程度較其余各組明顯減輕,可模糊透見虹膜紋理。自噬抑制組在建模后第7、14、28天角膜出現質地不均勻的混濁,不能窺見虹膜結構,尤其在第28天時角膜中央可見新生血管蔓延,中央周圍可見不均勻的角膜瘢痕。自噬抑制+中藥組在建模后第28天角膜混濁程度接近于模型組。詳見圖2。
3.2.2" 角膜混濁評分" 與空白組比較,模型組在造模后第7、14、28天的角膜混濁程度均有升高(Plt;0.05)。與模型組相比較,自噬促進+中藥組在造模后第7、14、28天角膜混濁程度均均有降低(Plt;0.05),而自噬抑制組在造模后第7、14、28天的角膜混濁明顯高于模型組(Plt;0.05)。詳見表2。
3.3" Western blot檢測TGF-β1、LC3、MMP-2相關蛋白表達
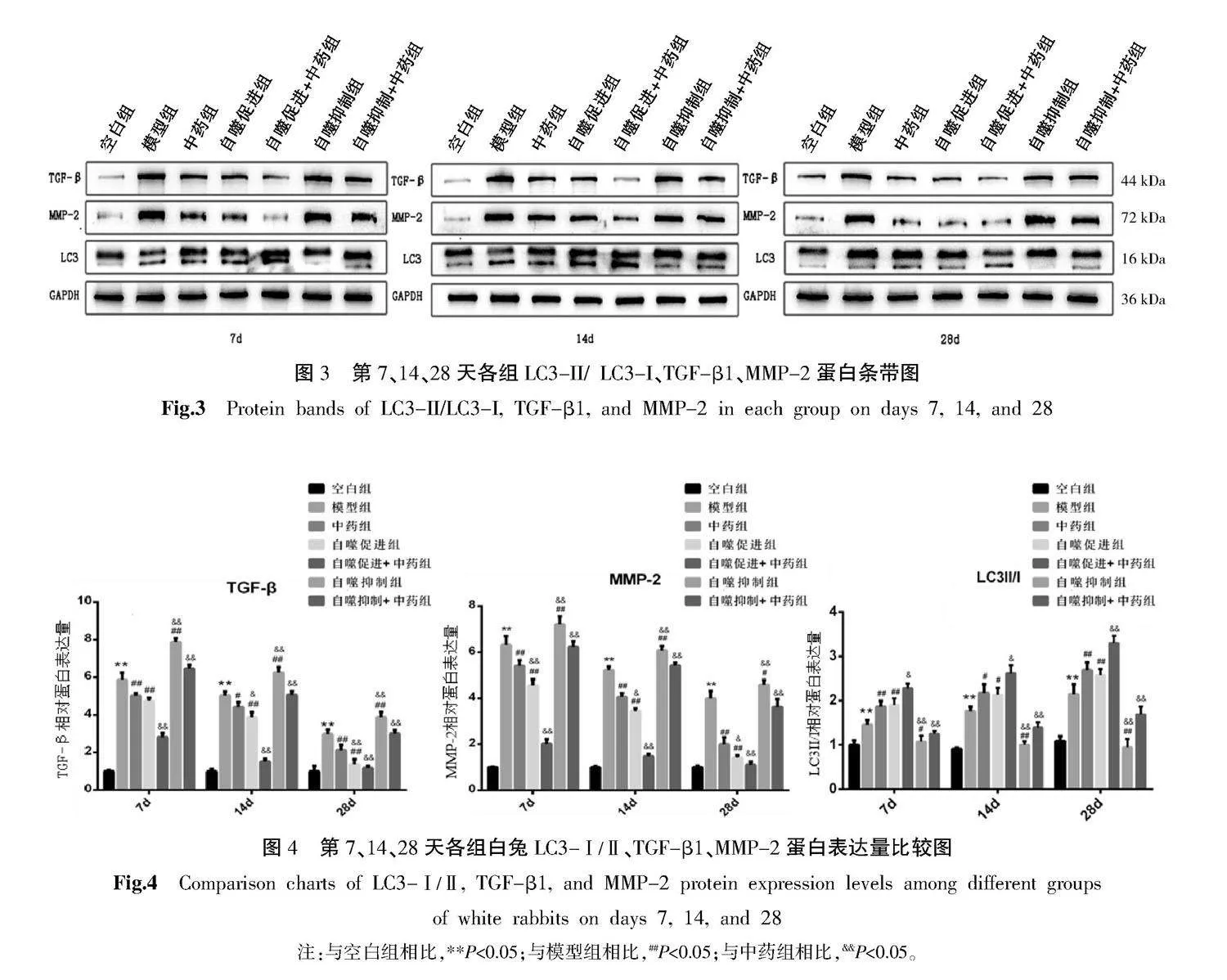
與空白組相比,各時間段模型組LC3-Ⅱ/Ⅰ蛋白表達顯著升高(Plt;0.05)。與模型組相比,各時間段中藥組、自噬促進組LC3-Ⅱ/Ⅰ表達均升高(Plt;0.05),自噬抑制組表達降低(Plt;0.05)。與中藥組相比,各時間段自噬促進+中藥組LC3-Ⅱ/Ⅰ表達較高(Plt;0.05),自噬抑制+中藥組表達較低(Plt;0.05)。
與空白組相比,各時間段模型組TGF-β1、MMP-2蛋白表達顯著升高(Plt;0.05)。與模型組相比,各時間段中藥組、自噬促進組TGF-β1、MMP-2蛋白表達均較低(Plt;0.05),自噬抑制組表達較高(Plt;0.05)。與中藥組對比,各時間段自噬促進+中藥組TGF-β1、MMP-2蛋白表達降低(Plt;0.05),自噬抑制+中藥組TGF-β1、MMP-2蛋白表達升高(Plt;0.05)。詳見圖3—4。
4 討論
角膜損傷修復過程是一個由膠原蛋白、糖胺聚糖、基質金屬蛋白酶等多因子參與的過程[3]。而MMP-2作為MMPs重要成員之一,在該過程中發揮重要作用。當角膜基質受到創傷后,在創傷區周圍激活的角膜基質細胞會進行凋亡來防止在角膜損傷修復過程中有害因素對周圍角膜組織結構產生不良影響[16]。部分激活的角膜基質細胞會在TGF-β1等作用下分化為角膜成纖維細胞并遷移至損傷區域,在TGF-β1的作用下誘導成纖維細胞向不透明的肌成纖維細胞轉化并促進ECM分泌[5]。角膜基質混濁/瘢痕主要是ECM的沉積以及肌成纖維細胞存在的結果[17]。當組織修復到一定程度,成纖維細胞開始凋亡,肌成纖維細胞侵襲并充滿創傷處最終形成瘢痕,經過數月或數年的修復,規則正常的ECM逐漸取代肌成纖維細胞及其產生的混濁ECM[18]。該過程中肌成纖維細胞也會向成纖維細胞轉化,異常ECM被重吸收,角膜細胞重新組成基質,角膜透明度逐漸恢復[19]。角膜傷口愈合過程中基質中ECM沉積過多和出現異常的肌成纖維細胞,將會產生角膜瘢痕,自噬可能有助于減少或清除多余的ECM來減輕瘢痕增生。有研究報道,在角膜疾病中角膜成纖維細胞中的蛋白質如LC3A/B和LAMP-1在角膜傷口表達增加[20],氯化鋰原本是一種廣泛應用于精神和神經系統疾病的治療藥物,近期發現氯化鋰能在一定程度上促進自噬[21-22],CHOI等[23],發現氯化鋰能增加角膜基質中成纖維細胞LC3II/I的比例,同時還TGF-β1的表達隨著氯化鋰的濃度增加而減少。常鳴[24]等在使用哺乳動物雷帕霉素靶蛋白通路抑制劑雷帕霉素作用于小鼠角膜瘢痕后發現,自噬水平的提高降低角膜成纖維細胞轉化為肌成纖維細胞的標志α-SMA的表達,以及TGF-β1的表達[24],從而減輕角膜瘢痕。
角膜歸屬于中醫學黑睛范疇,黑睛常暴露于外,易受外傷及邪毒侵襲,絡脈受損,目珠流失氣血,致氣血不足、瘀血留滯,風熱邪氣乘虛而入,留存于黑睛致氣機郁滯[25]。《傷科匯纂·外邪篇》言“大凡傷損癥,有外邪乃乘虛而入”,并且《原機啟微·卷二》曰 “翳之所生,多因風熱不制”,說明角膜損傷后易感風熱之邪。《眼科秘訣·論退翳法》載:“翳者,氣血津凝而不行,結聚而成云翳。”綜合認為,角膜損傷所產生的翳證的病機為氣血失和,風熱侵襲。除風益損湯由四物湯加藁本、前胡、防風組成,方中四物湯補血養血、活血明目,配合藁本、前胡、防風祛風散邪,使得全方補血而不滯、行血而不過。諸藥合用,養血活血、祛風明目,促使氣血得以暢達目竅用以療養。
本研究發現,眼前節照相及角膜熒光素染色、角膜混濁評分中,隨著時間推移,實驗兔在中藥除風益損湯湯劑灌胃治療和LiCl板層角膜注射治療及聯合治療對比模型組角膜混濁程度較輕,虹膜紋理更為清晰。而通過3-MA板層角膜注射治療對比模型組角膜混濁程度更重,虹膜紋理模糊。以上說明除風益損湯和LiCl板層角膜注射對兔角膜損傷修復有促進作用,且提高自噬水平能促進角膜損傷修復。通過激光共焦斷層掃描在不同時間進行觀察,發現模型組在造模第7、14天時間段內存在炎癥細胞及大量成纖維細胞浸潤,造模28 d可見成纖維細胞浸潤及膠原沉積,而中藥組、自噬促進組、自噬促進+中藥組成纖維細胞浸潤、膠原沉積少,而自噬抑制組對比模型組膠原沉積更多。以上說明成纖維細胞浸潤和LiCl板層角膜注射能減少成纖維細胞的轉化,減輕膠原沉積來從而減輕角膜瘢痕。在Western blot檢測發現實驗兔LC3-Ⅱ/Ⅰ隨時間推移升高,本實驗中自噬促進+中藥組LC3-Ⅱ/Ⅰ表達明顯高于各建模組,中藥組、自噬促進組中LC3-Ⅱ/Ⅰ較模型組高說明除風益損湯和LiCl板層角膜注射能促進角膜自噬水平。而TGF-β1、MMP-2表達在自噬促進+中藥組、中藥組、自噬促進組中均低于模型組,且隨著時間的推移而減少,而自噬抑制組TGF-β1、MMP-2表達高于模型組,這與XU等[26]在角膜損傷予以治療后MMP-2降低相似,由此可知除風益損湯和LiCl板層角膜注射能減少TGF-β1、MMP-2表達,從而減少角膜瘢痕。與空白組相比,模型組TGF-β1、MMP-2蛋白在各時間段表達均升高,TGF-β1、MMP-2增加以促進角膜瘢痕的形成完成角膜基質的重塑,自噬增加以清除多余的ECM,抑制炎癥反應。與模型組相比,中藥組和自噬促進組在3個時間段的LC3-Ⅱ/Ⅰ蛋白表達升高,TGF-β1、MMP-2蛋白表達降低。提示除風益損湯和氯化鋰可增加兔角膜中的自噬效應,自噬活性的升高幫助角膜恢復正常的ECM,限制細胞應激。同時降低TGF-β1、MMP-2減少瘢痕的形成。相反,自噬抑制組與模型組相比,各時間段LC3-Ⅱ/Ⅰ表達降低,TGF-β1、MMP-2表達升高,提示3-MA降低了兔角膜中的自噬,細胞持續處于應激狀態,不利于角膜透明度的恢復和傷口的愈合。與中藥組相比,各時間段自噬促進+中藥組增加自噬更明顯,降低TGF-β1與MMP-2的效果也更加顯著,自噬抑制+中藥組則相反,提示促進自噬有利于除風益損湯發揮更好的修復角膜的作用。
綜上可知,角膜損傷后可以調控TGF-β1、MMP-2和自噬水平來影響角膜愈合及瘢痕的形成。本實驗通過宏觀和微觀的觀察角度,以及分子水平的檢測檢測,發現除風益損湯、氯化鋰對于角膜損傷愈合起到促進作用,并能減少瘢痕形成,其機制可通過促進自噬和調控TGF-β1、MMP-2的水平來實現,二者合用效果更佳。
參考文獻
[1] FLAXMAN S R, BOURNE R R A, RESNIKOFF S, et al. Global causes of blindness and distance vision impairment 1990-2020: A systematic review and meta-analysis[J]. The Lancet Global Health, 2017, 5(12): e1221-e1234.
[2] MATHEWS P M, LINDSLEY K, ALDAVE A J, et al. Etiology of global corneal blindnessand current practicesof corneal transplantation: A focused review[J]. Cornea, 2018, 37(9): 1198-1203.
[3] ZAHIR-JOUZDANI F, SOLEIMANI M, MAHBOD M, et al. Corneal chemical burn treatment through a delivery system consisting of TGF-β1 siRNA: in vitro and in vivo[J]. Drug Delivery and Translational Research, 2018, 8(5): 1127-1138.
[4] 張" 露, 李" 霞. TGF-β在角膜損傷修復中的時間和空間分布[J]. 眼科新進展, 2017, 37(2): 184-188.
[5] 靳" 荷, 李" 霞. TGF-β在角膜瘢痕形成及無瘢痕愈合中的作用[J]. 眼科新進展, 2014, 34(11): 1087-1090.
[6] KEMPURAJ D, MOHAN R R. Autophagy in extracellular matrix and wound healing modulation in the Cornea[J]. Biomedicines, 2022, 10(2): 339.
[7] NIE D Y, PENG Y, LI M, et al. Lithium chloride (LiCl) induced autophagy and downregulated expression of transforming growth factor β-induced protein (TGFBI) in granular corneal dystrophy[J]. Experimental Eye Research, 2018, 173: 44-50.
[8] 蔣鵬飛, 彭" 俊, 陳向東, 等. 除風益損湯加減治療眼內異物取出術后18例[J]. 現代中醫藥, 2020, 40(1): 104-107.
[9] 黃根山. 除風益損湯輔治青光眼白內障聯合術后合并癥療效觀察[J]. 實用中醫藥雜志, 2021, 37(8): 1362-1364.
[10] 王龍龍, 宋若會, 孟" 磊, 等. 除風益損湯加減方對翼狀胬肉術后眼表損傷修復的作用探究[J]. 中醫藥臨床雜志, 2024, 36(3): 570-574.
[11] CONNON C J, MEEK K M. Organization of corneal collagen fibrils during the healing of trephined wounds in rabbits[J]. Wound Repair and Regeneration, 2003, 11(1): 71-78.
[12] 徐路星. 兔角膜穿通傷早期上皮基底膜再生及其對角膜基質纖維化的調控作用[D]. 南寧: 廣西醫科大學, 2020.
[13] 由新英. 角膜病灶板層切除聯合術中基質內注射0.2%氟康唑治療真菌性角膜潰瘍[D]. 濟南: 山東大學, 2015.
[14] SHARMA A, MEHAN M M, SINHA S, et al. Trichostatin a inhibits corneal haze in vitro and in vivo[J]. Investigative Ophthalmology amp; Visual Science, 2009, 50(6): 2695-2701.
[15] FANTES F E, HANNA K D, WARING G O 3rd, et al. Wound healing after excimer laser keratomileusis (photorefractive keratectomy) in monkeys[J]. Archives of Ophthalmology, 1990, 108(5): 665-675.
[16] MARTIN L M, JEYABALAN N, TRIPATHI R, et al. Autophagy in corneal health and disease: A concise review[J]. The Ocular Surface, 2019, 17(2): 186-197.
[17] ESPANA E M, BIRK D E. Composition, structure and function of the corneal stroma[J]. Experimental Eye Research, 2020, 198: 108137.
[18] 張" 璐, 李" 妍, 胡竹林. 角膜基質細胞的表型轉化及其預防瘢痕形成的研究[J]. 國際眼科縱覽, 2018, 42(3): 194-198.
[19] 楊" 怡, 牛" 陽, 袁" 玲. 人角膜基質細胞的表型研究進展[J]. 中華實驗眼科雜志, 2022, 40(9): 874-879.
[20] MARTíNEZ-CHACN G, VELA F J, CAMPOS J L, et al. Autophagy modulation in animal models of corneal diseases: A systematic review[J]. Molecular and Cellular Biochemistry, 2020, 474(1/2): 41-55.
[21] HUANG L, YIN X, CHEN J, et al. Lithium chloride promotes osteogenesis and suppresses apoptosis during orthodontic tooth movement in osteoporotic model via regulating autophagy[J]. Bioactive Materials, 2021, 6(10): 3074-3084.
[22] XIAO Y N, FAN M Y, JIN W, et al. Lithium chloride ameliorated spatial cognitive impairment through activating mTOR phosphorylation and inhibiting excessive autophagy in the repeated cerebral ischemia-reperfusion mouse model[J]. Experimental and Therapeutic Medicine, 2020, 20(5): 109.
[23] CHOI S I, KIM B Y, DADAKHUJAEV S, et al. Inhibition of TGFBIp expression by lithium: Implications for TGFBI-linked corneal dystrophy therapy[J]. Investigative Ophthalmology amp; Visual Science, 2011, 52(6): 3293-3300.
[24] 常" 鳴, 賀司宇, 岳" 娟, 等. mTOR通路抑制劑雷帕霉素對真菌性角膜炎小鼠角膜瘢痕化的影響[J]. 眼科新進展, 2020, 40(6): 520-523.
[25] 李江偉, 姚小磊, 彭" 俊, 等. 彭清華教授運用宣散退翳法治療外傷性角膜損傷術后經驗[J]. 湖南中醫藥大學學報, 2023, 43(9): 1627-1631.
[26] XU X Y, LIU T X, LI H X. Effect of collagen cross-linking on alkali burn-induced corneal neovascularization in rabbits[J]. Journal of Ophthalmology, 2018, 2018: 7325483.
(本文編輯" 蘇" 維)

