404 Not Found
404 Not Found
黃色短桿菌中L-異亮氨酸同位素豐度及分布的分析方法研究
趙雅夢,范若寧,雷 雯*
(1.上海化工研究院有限公司,上海 200062;2.上海市穩定同位素檢測及應用研發專業技術服務平臺,上海 200062)
利用同位素標記技術將化合物中普通原子替換為同位素核素所合成的穩定同位素標記化合物,結合質譜技術,已在蛋白質組學、代謝組學、生物靶標發現、臨床診斷等生命科學研究中發揮重要作用[1-4]。13C、15N標記賴氨酸、精氨酸等是細胞培養中氨基酸的穩定同位素標記技術(SILAC)中必備的關鍵試劑[5-6],也是代謝流量分析中的常用示蹤劑[7-8]。微生物發酵法是同位素標記氨基酸的主要合成方法,將培養基中的營養組分替換為穩定同位素標記化合物,經微生物發酵、提純等即可得到同位素標記氨基酸[9-10]。同位素豐度是穩定同位素標記氨基酸產品的重要參數之一,決定了批次產品的質量水平,也是穩定同位素標記氨基酸在蛋白質定量、代謝流等下游應用研究中的重要考察指標。高豐度穩定同位素標記氨基酸產品的應用需求大,對試劑質量要求也較高。
目前,氣體同位素質譜法和有機質譜法是同位素豐度分析的兩種重要方法,前者通過高溫燃燒等方式將C、N元素轉化為CO2和N2,適用于檢測純度較高的同位素試劑[11]。后者則是基于化合物同位素質量數的差異完成豐度計算,如上海化工研究院開發的基于“質量簇”的有機質譜同位素豐度[12-13]。近年來,高分辨質譜儀因具有超高分辨率、高靈敏度等特點成為同位素豐度和分布分析的主流工具。研究人員利用高分辨質譜儀建立了針對氘標記化合物[14]、13C標記葡萄糖[15]等的同位素分布及豐度檢測方法,可實現復雜樣本中化合物的豐度計算,生產過程的實時監控,以及有效的降低成本等明顯優勢。
本研究基于同位素標記技術,通過色譜、質譜條件的優化及對樣品濃度、質譜掃描次數等影響因素的考察,建立了一種穩定、準確的氨基酸同位素豐度計算方法,實現了L-異亮氨酸產生菌黃色短桿菌發酵液中氨基酸同位素豐度及分布分析,可為發酵反應條件優化、細菌代謝機理研究等提供數據支持。
1 實驗部分
1.1 儀器與試劑
Orbitrap Exploris 120高分辨液相色譜-質譜聯用儀(美國Thermo Fisher 科技有限公司);MAT 271 型氣體同位素質譜儀(美國 Finnigan 質譜公司);XPE105DR 電子天平儀(瑞士Mettler Toledo 集團);Vortex-5渦旋儀(中國其林貝爾儀器制造有限公司);Merck-Milipore SimolicityTM超純水系統(德國Merck公司)。
葡萄糖-13C6(純度為99%,美國劍橋實驗室);L-谷氨酸-15N、L-異亮氨酸-15N、L-亮氨酸-15N、L-賴氨酸-15N、L-苯丙氨酸-15N、L-脯氨酸-15N、L-蘇氨酸-15N、L-纈氨酸-15N(純度均>99%,上海化工研究院有限公司);甲醇、甲酸、乙腈(ACN)(色譜純,美國Thermo Fisher科技有限公司)。
1.2 標準溶液的配制
準確稱取1.0 mg 氨基酸樣品,加入1 mL 50%甲醇水溶液,渦旋30 s 充分混勻,配成質量濃度為1.0 mg/mL 的儲備液。準確移取適量儲備液,以50%甲醇水溶液稀釋成0.1、0.2、0.5、0.8、1、2 μg/mL的工作標準溶液。儲備液和工作標準溶液均保存于4 ℃。
1.3 實驗條件
1.3.1 色譜條件色譜柱:Hypersil Gold Vanquish 色譜柱(100 mm × 2.1 mm,1.9 μm);流動相:流動相A 為超純水,流動相B 為含0.1%甲酸的甲醇溶液;洗脫條件:90% B 等度洗脫5 min;流速:0.3 mL/min;進樣量:1 μL。
1.3.2 質譜條件離子源:ESI;電噴霧電壓(Ion sray voltage):3 200 V;鞘氣(Sheath gas):20 arb(~2.68 L/min);輔助氣(Aux gas):15 arb(~14.03 L/min);離子傳輸管溫度:320 ℃;掃描模式:全掃描(Full scan)模式下正離子掃描;分辨率:12 000;掃描質荷比范圍:70~500m/z。
1.4 細菌培養
L-異亮氨酸產生菌菌種為黃色短桿菌(Brevibacterium flavum),發酵培養基組分為:12 g/L 葡萄糖,3 g/L(NH4)2SO4,0.5 g/L 玉米漿,0.1 g/L K2HPO4,0.025 g/L MgSO4,0.02 g/L FeSO4,0.02 g/L MnSO4,0.01 g/L VB1,0.01 g/L 生物素,pH 7.2。菌種活化、培養及分離純度等過程參照文獻進行[10]。L-異亮氨酸-15N 發酵生產時,將(NH4)2SO4替換為(15NH4)2SO4;13C同位素示蹤研究時,將發酵培養基組分中的葡萄糖換為20%葡萄糖 -13C6和80%葡萄糖。
2 結果與討論
2.1 液相色譜-質譜條件的優化
色譜柱是液相色譜的核心,由于本文只針對L-異亮氨酸進行分析,且采用的是液相色譜-質譜聯用方法,因此選擇高穩定性和重現性的C18色譜柱進行分析。分別以乙腈-水、甲醇-水作為流動相考察了L-異亮氨酸-15N 的保留及色譜峰形情況。由圖1 可知,以乙腈-水為流動相時,樣品在0.8 min 出峰,且在1 min 左右有雜峰出現。而更換流動相為甲醇后,由于甲醇洗脫能力弱于乙腈,保留時間略有延后,但峰形顯著變好,因此選擇甲醇-水流動相體系。在甲醇中加入0.1%甲酸時,信號響應有所提高,這可能是因為酸性條件促進了氨基酸的電離。因此最佳流動相條件選擇以水為A 相,含0.1%甲酸的甲醇為B相。
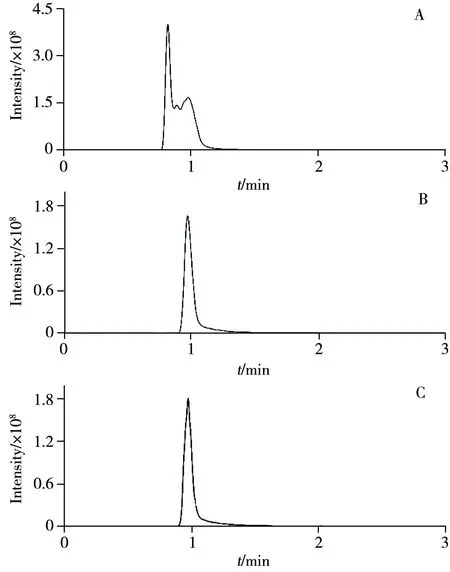
圖1 不同流動相條件下L-異亮氨酸-15N的提取離子流圖Fig.1 Extracted ion chromatograms(EIC) of L-isoleucine-15N under different mobile phase conditions
為保證待測物具有良好的質譜響應,對離子化模式和噴霧電壓、鞘氣及輔助氣等離子源參數進行優化。L-異亮氨酸含有羧基和氨基官能團,在正、負離子模式下均出峰且信號響應較好,本文參照文獻選擇正離子模式進行實驗[16]。電離電壓等離子源參數優化可有效提高待測物的信號響應和檢測靈敏度。研究顯示,噴霧電壓的提高可增強L-異亮氨酸-15N 的質譜響應信號,但過高電壓可能會發生源內裂解而影響同位素豐度的計算,因此選擇3 200 V 為最佳噴霧電壓。進一步考察鞘氣和輔助氣的影響,結果顯示鞘氣和輔助氣分別為20 arb(~2.68 L/min)和15 arb(~14.03 L/min)時,待測物的響應信號最佳。
2.2 同位素豐度計算的影響因素
當同位素標記化合物的相對同位素偏差大于儀器質量偏差時,可直接參照行業標準進行同位素豐度計算[17],如13C、D 標記的化合物均可根據LC-HRMS 的質譜圖進行豐度計算。以L-異亮氨酸-15N 為例,計算得到L-異亮氨酸-15N的同位素偏差為45 ppm,遠大于儀器質量偏差(5 ppm),因此可直接根據質譜峰強度進行豐度計算。
2.2.1 樣品濃度的影響當L-異亮氨酸-15N濃度過低時,存在背景干擾大、部分同位素標記形式低于閾值而無法檢出等情況;然而樣品濃度過高時可能會導致質譜殘留而影響后續使用。本實驗考察了不同濃度(0.05、0.1、0.2、0.5、1、2、5、10 μg/mL)L-異亮氨酸-15N 標準溶液對實驗結果的影響。結果顯示,當樣品濃度較低時,測得的豐度較低且偏差較大。隨著樣品濃度的提高,同位素豐度逐漸提高,在1 μg/mL及以上濃度時趨于穩定(見圖2)。因此后續采用1 μg/mL樣品濃度進行實驗。
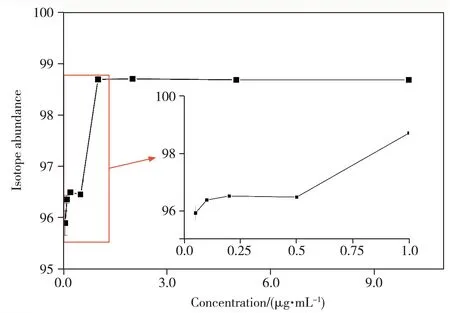
圖2 不同濃度下L-異亮氨酸-15N的同位素豐度計算結果Fig.2 Isotopic abundances of L-isoleucine-15N at different concentrations
2.2.2 同位素豐度計算依據同位素豐度是依據質譜圖中不同標記形式化合物的信號響應進行計算[13-18],目前多以質譜峰強度和峰面積進行計算[19]。考察了這兩種計算形式下同一樣品的同位素豐度,結果顯示根據峰面積計算得到的同位素豐度為98.66%,相對標準偏差(RSD)為0.03%;根據峰強度計算得到的同位素豐度為98.67%,相對標準偏差為0.04%。二者基本一致,說明對于高豐度同位素標記化合物,采用峰面積或峰強度均可得到較為準確的計算結果。但由于采用峰強度計算時只需對一定數量質譜圖進行疊加,使用峰面積時需對不同形式的峰面積進行積分,相對復雜。因此后續以峰強度進行豐度計算。
2.3 不同檢測方法對比
氣體同位素質譜法是同位素豐度測定的常用方法,也是同位素試劑質量控制的重要手段之一。本文以L-谷氨酸-15N、L-賴氨酸-15N 等多種15N 標記氨基酸為例,對比了氣體同位素質譜法(GIMS)與LCHRMS兩種方法計算結果的差異。如表1所示,兩種計算方法得到的同位素豐度值差值均在0.6%以內,LC-HRMS 計算得到的豐度值普遍高于GIMS 的結果,這可能是由于兩種檢測方法原理不同所致。與GIMS 法相比,LC-HRMS 法所需樣品量少,且無需氣體轉化等前處理,操作簡便,實驗時間短,有望成為一種高通量、準確的穩定同位素試劑質量控制方法。
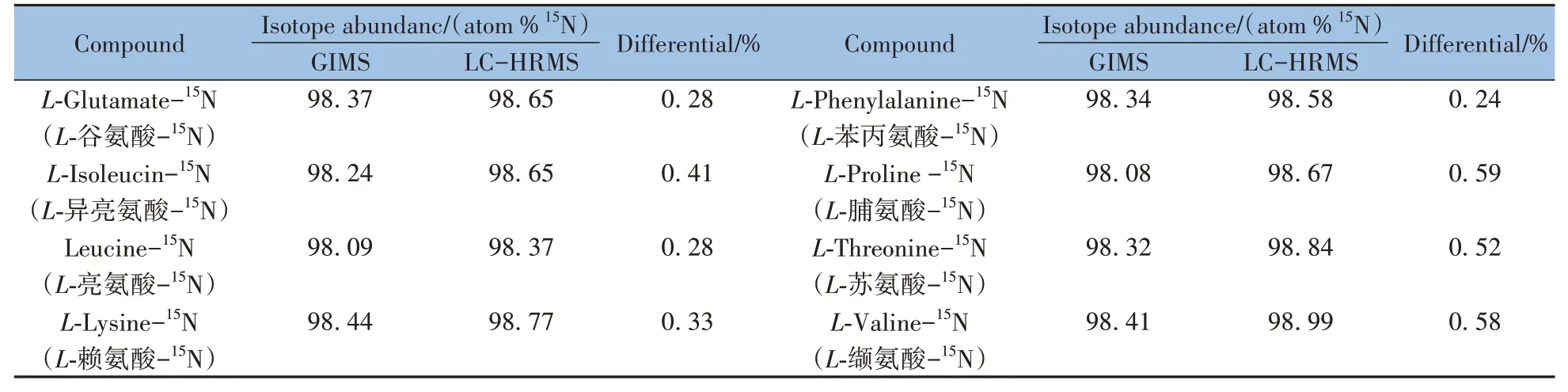
表1 GIMS及LC-HRMS的氨基酸15N同位素豐度測定結果對比Table 1 Comparison of 15N isotope abundance measurements between GIMS and LC-HRMS in isotope labeled amino acid
2.4 方法應用
生物發酵法是國內制備15N 標記氨基酸的主要方法,采用GIMS 進行豐度分析時,需要得到氨基酸純品后再進行分析,若試劑產品質量不合格則需重新進行培養、純化等步驟。而基于LC-HRMS 的豐度分析方法簡便快捷,雜質干擾小,可直接對菌液進行分析。以L-異亮氨酸-15N 產生菌黃色短桿菌菌液為例,在發酵過程中,可能存在賴氨酸等雜質干擾,如圖3 所示,盡管菌液成分復雜,但L-異亮氨酸-15N的提取離子流圖信號響應很高,經計算得到15N同位素豐度為98.58%,相對標準偏差為0.03%。
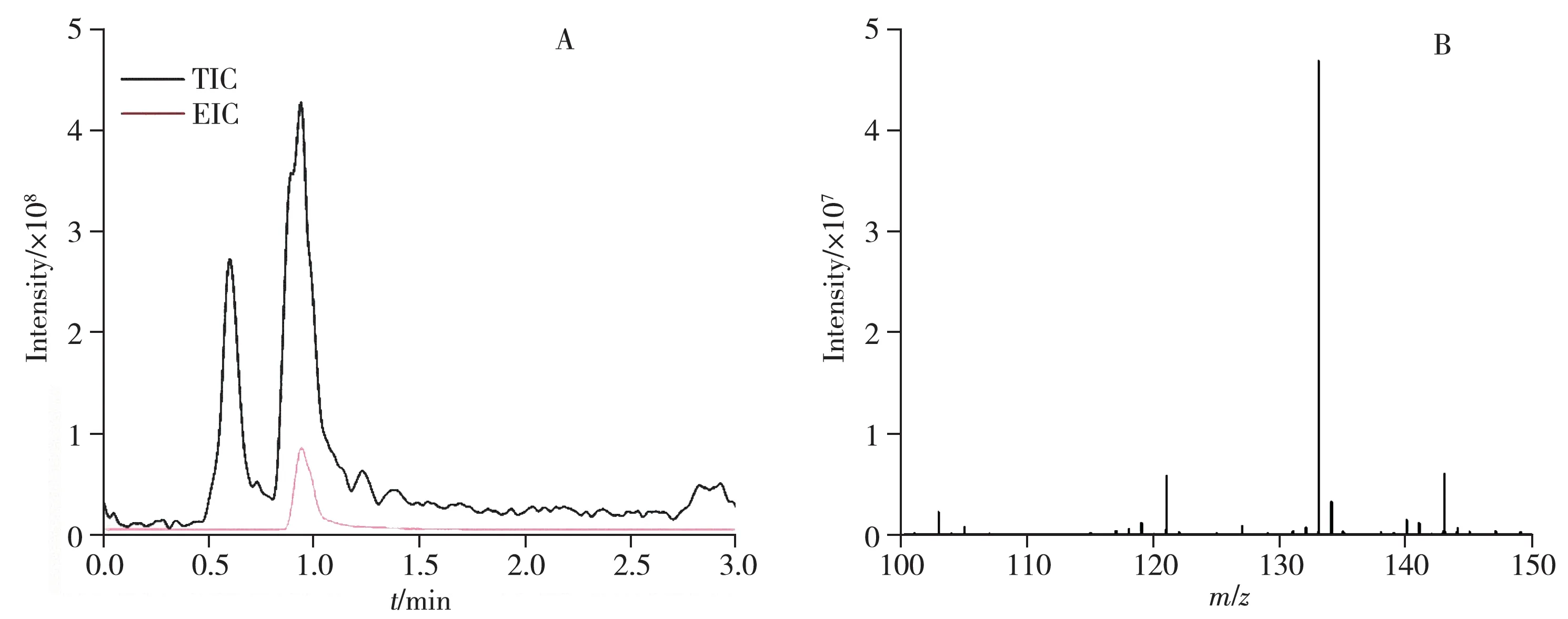
圖3 L-異亮氨酸-15N產生菌黃色短桿菌菌液的離子流圖(A)和質譜圖(B)Fig.3 EIC chromatograms(A) and MS spectra(B) of L-isoleucine-15N producing bacteriophage of Brebvibacterium flavum
將該方法進一步用于13C6-葡萄糖示蹤的黃色短桿菌中同位素分布及豐度分析,在4~72 h 等不同時間點取樣(見表2)。結果顯示,隨著示蹤時間的增加,L-異亮氨酸-15N 的同位素豐度逐漸升高,48 h后基本達到平衡,同位素豐度值約為19 atom %13C,與培養基中同位素試劑的添加比例一致,同位素分布如圖4 所示。除同位素豐度計算外,基于本方法得到的同位素分布也可為代謝流分析、細菌代謝機理闡明等研究提供基礎。

表2 不同示蹤時間下13C標記異亮氨酸的同位素豐度Table 2 Isotope abundance of 13C6-isoleucine within different tracing time
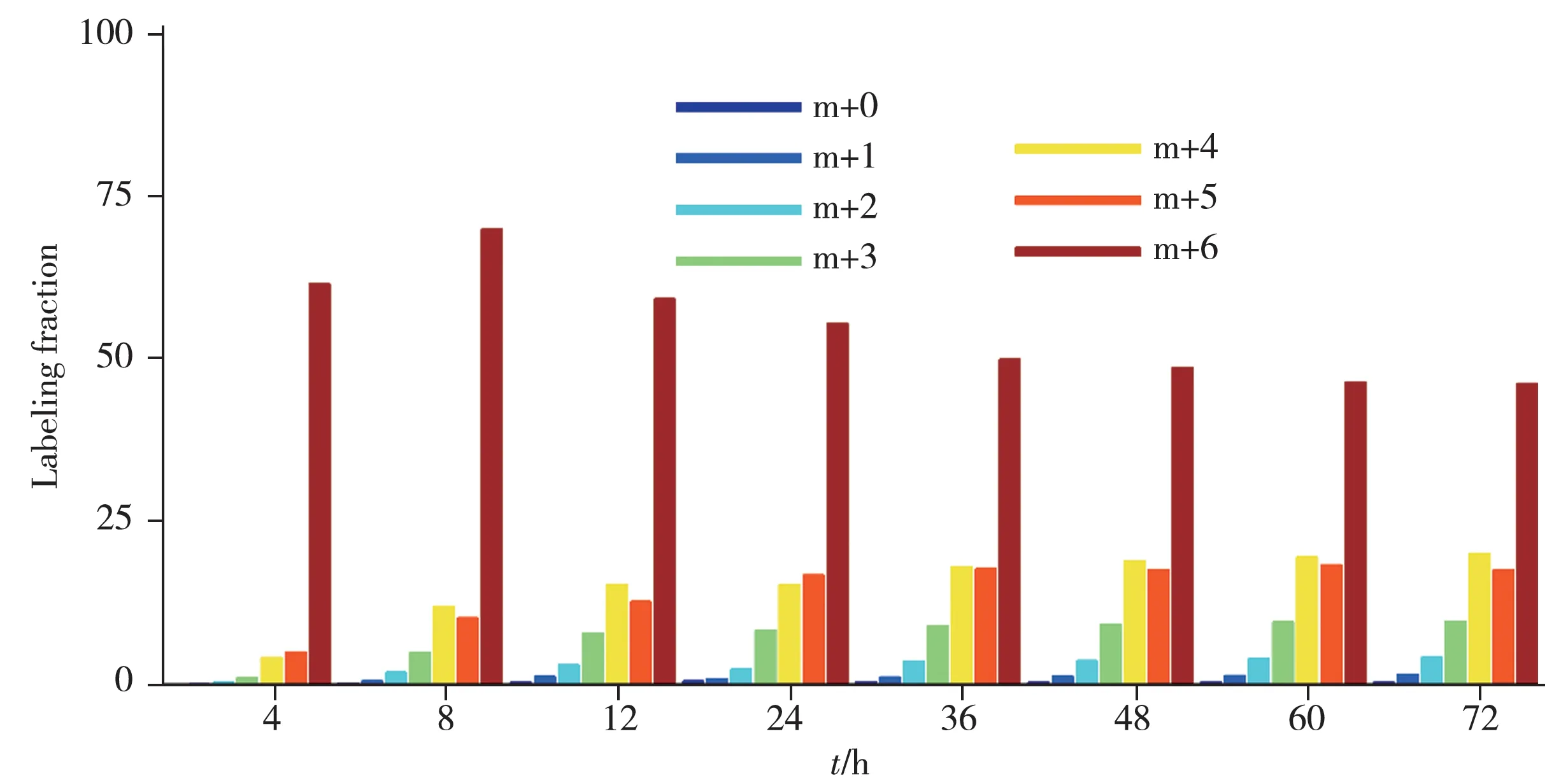
圖4 不同示蹤時間下13C標記異亮氨酸的質量分布圖Fig.4 Isotope abundance of 13C labeled isoleucine within different tracing time
3 結 論
本研究建立了一種可用于L-異亮氨酸同位素分布及豐度分析的LC-HRMS 檢測方法。方法準確可靠,穩定性良好,且所需樣品量少,操作簡便,尤其適用復雜生物樣品如細菌發酵液中L-異亮氨酸同位素豐度與分布的快速檢測,可為工程菌株設計、培養體系篩選等科學研究提供支持,提高穩定同位素標記氨基酸產品的產量,助力生命科學和生物醫藥領域的發展。
