HPLC快速測定發酵液中L–色氨酸
程立坤,徐慶陽,謝希賢,陳 寧
(工業微生物教育部重點實驗室,天津科技大學生物工程學院,天津 300457)
HPLC快速測定發酵液中L–色氨酸
程立坤,徐慶陽,謝希賢,陳 寧
(工業微生物教育部重點實驗室,天津科技大學生物工程學院,天津 300457)
建立一種測定發酵液中 L–色氨酸的高效液相色譜(HPLC)方法.以Agilent C18(5 μm,150.mm×4.6.mm)為分離柱,V(0.03%的KH2PO4溶液)∶V(甲醇)=90∶10為流動相,流量為1 mL/min,在278.nm處檢測L–色氨酸.該方法簡便、快速、準確,在 0.000~1.000.g/L范圍內線性關系良好(R2=0.999 9),平均回收率為 98.93%,精密度(RSD)為0.247%,可有效應用于發酵液中L–色氨酸含量的測定.
L–色氨酸;HPLC;檢測
L–色氨酸(L-tryptophan)對人和動物的生長發育及新陳代謝起重要的作用,被稱為第二必需氨基酸,廣泛用于醫藥、食品和飼料等方面[1].目前,微生物發酵法生產 L–色氨酸已經走向實用并且處于主導地位[2],其中微生物發酵法具有產酸高、成本低、質量好等優勢,將是未來大規模生產 L–色氨酸的首選技術[3].因此,建立一種快速且準確的測定發酵液中 L–色氨酸的方法非常必要.
L–色氨酸的定性和定量測定方法有紙層析法、薄層分析法、比色法、高效液相色譜法、氨基酸分析儀測定法等[4–6].其中最常用的有對二甲胺基苯甲醛比色法和柱前衍生HPLC法.但這兩種方法操作步驟復雜,且分別以50%濃硫酸為顯色反應介質和用2,4–二硝基氟苯作為衍生劑,實驗危險性均很大.由于 L–色氨酸在紫外區有光吸收,因此本文建立了直接利用光電二極管陣列(DAD)檢測器在 278,nm 處測定發酵液中 L–色氨酸含量的 HPLC法,并與對二甲胺基苯甲醛比色測定法和柱前衍生HPLC法進行了比較.
1 材料與方法
1.1 儀器與試劑
Agilent,1200型高效液相色譜儀,包括 DAD檢測器、梯度四元泵、柱溫箱、在線自動脫氣器,數據處理由化學工作站完成.L–色氨酸、L–酪氨酸、L–苯丙氨酸,色譜純,北京索萊寶科技有限公司;甲醇,色譜純,天津市元立化工有限公司;其他試劑為分析純.
1.2 方法
對二甲胺基苯甲醛比色法測定:見參考文獻[7].
2,4–二硝基氟苯衍生法測定:見參考文獻[8].
HPLC分析條件:色譜分離柱 Agilent C18(5,μm,150,mm×4.6,mm),流動相 V(0.03% KH2PO4溶液)∶V(甲醇)=90∶10,流量 1.0,mL/min,柱溫 39,℃,進樣量 20,μL,檢測波長 278,nm.
標準曲線的制作:見參考文獻[9].
樣品處理:取 1.0,mL發酵液 10,000,r/min離心5,min,取上清液稀釋適當倍數使 L–色氨酸濃度介于測定方法的檢測線性范圍內,然后用 0.22,μm 微孔濾膜過濾,所得濾液直接進樣測定.
2 結果與討論
2.1 檢測波長的選擇
L–色氨酸是含有吲哚基的中性芳香族氨基酸,在紫外區下具有光吸收.由圖 1可知,其在 225,nm 和278 nm處均有吸收峰,則在DAD檢測器中設定兩個檢測波長分別為 225,nm和 278,nm.質量濃度為0.100,g/L的L–色氨酸標樣在兩種檢測波長處的高效液相色譜圖如圖2所示.
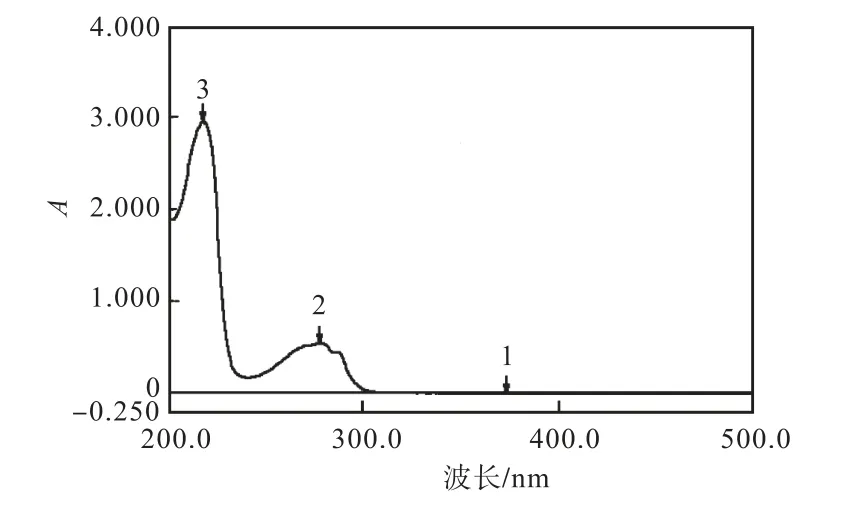
圖1 L–色氨酸紫外吸收光譜Fig.1 UV absorption map of L-tryptophan
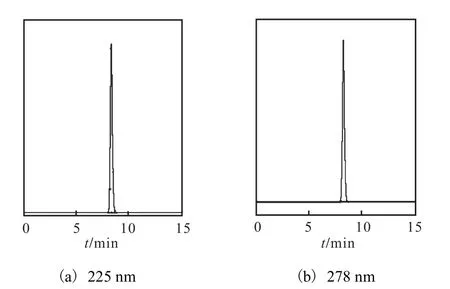
圖2 L–色氨酸標準品(0.100 g/L)高效液相色譜圖Fig.2 HPLC chromatograms of L-tryptophan(0.100 g/L)
由圖2可知,質量濃度為0.100,g/L的L–色氨酸標樣在 225,nm和 278,nm處的保留時間一致.但兩者的峰面積不同,分別為11,699.9和2,902.3,在 225 nm處檢測器的輸出信號約為 278,nm處輸出信號的4倍.由于檢測器所產生的信號在一定范圍內可與被測樣品的量呈一定的函數關系,若檢測器所產生的信號超出一定范圍,輸出信號不能與樣品量呈一定線性關系[10],則可推斷在 278,nm 處檢測 L–色氨酸比在225,nm 處的線性范圍廣.圖 2(a)和圖 2(b)中 L–色氨酸的峰面積分別占相應色譜圖中總峰面積的99.80%和 100.00%,說明在 225 nm 處 L–色氨酸標樣中的雜質有光吸收,而在278,nm處僅對L–色氨酸標樣中的 L–色氨酸有光吸收.因此,選擇 278,nm 作為檢測波長.
2.2 流動相組成的篩選
采用0.03%,KH2PO4溶液-甲醇體系作為流動相,為確定二者之間配比,設置體積比為 85∶15、88∶12、90∶10和92∶8四個體系,實驗結果見圖3.
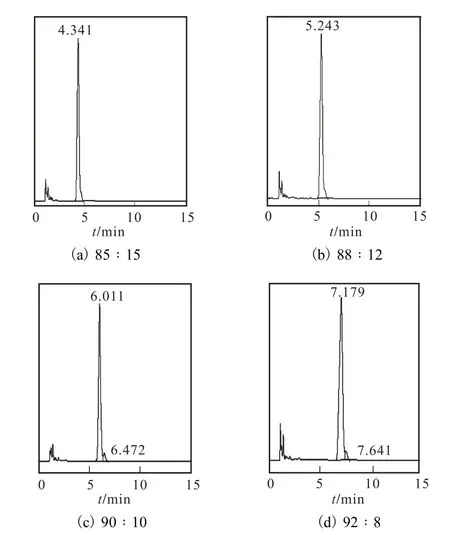
圖3 不同流動相組成體系的色譜圖Fig.3 HPLC chromatograms of different mobile phases
由圖3可知,隨著流動相體系中甲醇組分的增加,L–色氨酸的保留時間逐漸縮短.體系a與體系b不能將 L–色氨酸與其他雜質分開,體系 c與體系 d的分離度(Rs)分別為 2.31、1.69,則選擇體系 c作為流動相,即 V(0.03% KH2PO4溶液)∶V(甲醇)=90∶10.
2.3 流動相流量的確定
分別考察流量為 0.8,、1.0,、1.2,、1.4,mL/min 時發酵液的分離效果,由檢測結果可知,流量過小,分析時間延長,柱效降低,而流量過大時,發酵液中物質分離效果差,且由于壓力升高而損壞泵頭和色譜柱.綜合考慮,最終選定流量為1.0,mL/min.
2.4 柱溫對檢測的影響
柱溫對氨基酸的分離有較為明顯影響,為確定柱溫對發酵液中 L–色氨酸分離的影響.在 33、36、39、42,℃下各進同一種樣品3次,結果見表1.由表1可知,隨著柱溫的升高,L–色氨酸和鄰近 L–色氨酸雜質的保留時間均有所減少,同時柱效增強;柱溫為 39,℃時,分離度 Rs=2.17,兩個峰得到完全分離,因此采用柱溫為39,℃.
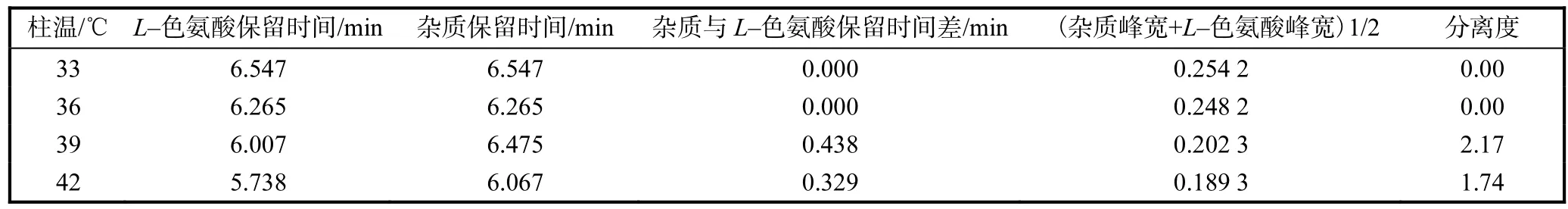
表1 溫度對L–色氨酸分離的影響Tab.1 Effect of temperature on chromatographic separationof L-tryptophan
2.5 色譜條件確定及其工作曲線
由以上實驗確定HPLC檢測L–色氨酸的色譜條件為:流動相 V(0.03% KH2PO4溶液)∶V(甲醇)=90∶10,流量 1.0,mL/min,柱溫 39,℃,進樣量 20,μL,檢測波長 278,nm.在此條件下,HPLC 檢測 L–色氨酸標樣的色譜圖如圖 4所示.將不同質量濃度的 L–色氨酸標準液在擬定色譜條件下進行測定,3組平行樣取其平均值,以 L–色氨酸濃度(x)為橫坐標,峰面積(y)為縱坐標作圖可得一標準曲線(見圖5).
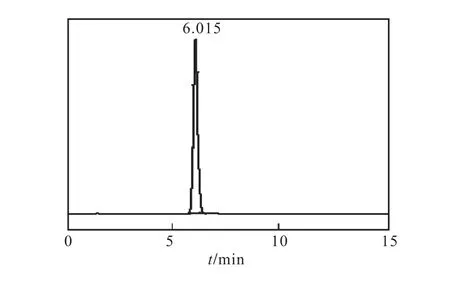
圖4 L–色氨酸(0.100.g/L)標樣的HPLC圖Fig.4 HPLC chromatograms of L-tryptophan(0.100.g/L)
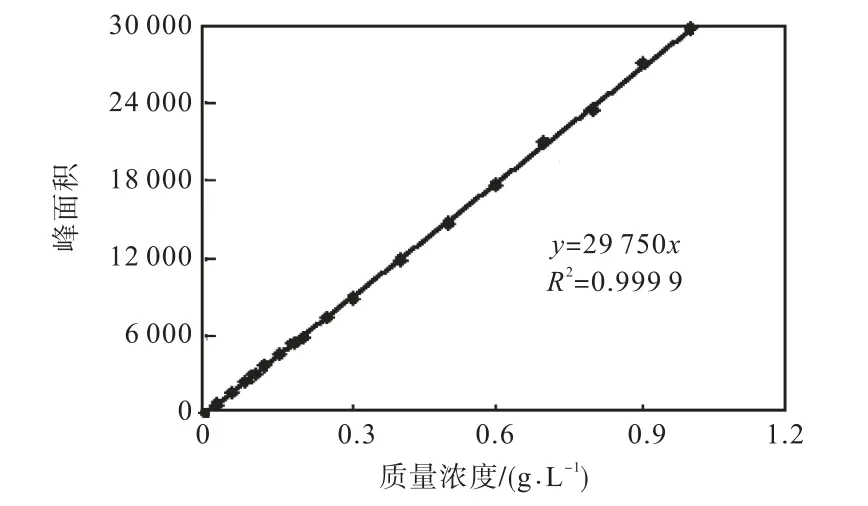
圖5 HPLC測定L-色氨酸標準曲線Fig.5 Standard curve of L-tryptophan determination by HPLC
由圖4可見,L–色氨酸的響應時間為6.015,min.由圖 5結果可知,在該色譜條件下 L–色氨酸質量濃度在0.000~1.000,g/L線性關系良好.
2.6 精密度實驗和回收率實驗
將 0.100,g/L的 L–色氨酸標準儲備液同濃度平行 3份,當日重復進樣 6次[11],峰面積 RSD 為0.247%.在已知濃度的發酵液中分別加入一定量的L–色氨酸對照溶液進行回收率實驗,每個濃度設3個平行,具體添加量及結果見表 2,計算得出其相對回收率為98.93%.
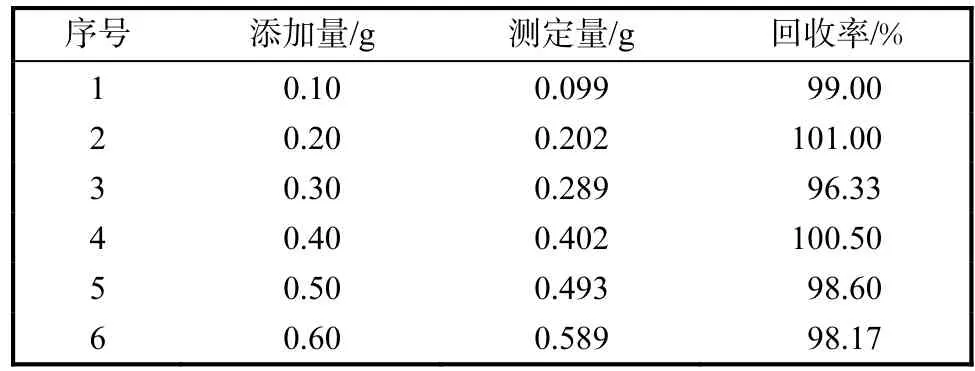
表2 L–色氨酸檢測的回收率結果Tab.2 Results obtained in the recovery test of L-tryptophan
2.7 發酵液樣品的測定及不同檢測方法的比較
圖6是L–色氨酸發酵液HPLC測定色譜圖.

圖6 L–色氨酸發酵液HPLC測定色譜圖Fig.6 Chromatograms of L-tryptophan fermentation
由圖 6可知,色譜柱柱效較高,發酵液樣品中某些其他發酵成分能被檢測到且分離效果良好.與標準曲線對照測得的發酵液中 L–色氨酸含量為32.8,g/L,這與對二甲胺基苯甲醛比色法、2,4–二硝基氟苯衍生測定法測得的 L–色氨酸含量相一致,從而證明該方法可以準確地檢測發酵液中 L–色氨酸的含量.由表 3可知,該方法與對二甲胺基苯甲醛比色法、2,4–二硝基氟苯衍生測定法相比,線性關系更佳、穩定性好、快速、危險性小、操作步驟簡單,且線性范圍可達0.000~1.000,g/L.

表3 L–色氨酸測定方法比較Tab.3 Comparison of determination methods for L-tryptophan
2.8 其他芳香族氨基酸的干擾
酪氨酸、苯丙氨酸與色氨酸同屬于芳香族氨基酸[12],在 278,nm 處均有光吸收,則在上述擬定色譜條件下對酪氨酸、苯丙氨酸進行檢測,結果如圖 7所示.
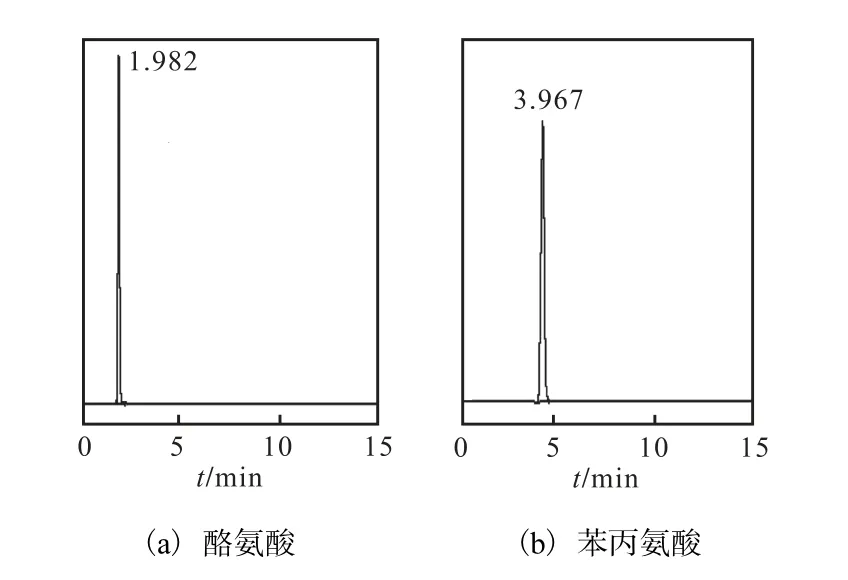
圖7 酪氨酸與苯丙氨酸標樣色譜圖Fig.7 HPLC chromatograms of tyrosine and phenylalanine
由圖7可知,酪氨酸與苯丙氨酸的保留時間分別為 1.982,min和 3.967,min,而色氨酸的保留時間為6.015,min,則說明酪氨酸與苯丙氨酸對發酵液中 L–色氨酸含量的測定沒有干擾,此檢測方法適用性強.
3 結 論
HPLC 色譜條件:以 Agilent,C18(5,μm,150,mm×4.6,mm)為分離柱,V(0.03% KH2PO4溶液)∶V(甲醇)=90∶10為流動相,流量為 1 mL/min,在 278 nm處 L–色氨酸可以很好地被檢測出來,保留時間為6.015 min,且酪氨酸、苯丙氨酸均對其測定沒有干擾,適用性強.與對二甲胺基苯甲醛比色法和柱前衍生高效液相色譜法相比較,線性更佳、穩定性好、快速、危險性小、操作步驟簡單,且線性范圍達 0.000~1.000,g/L,可有效應用于發酵液中 L–色氨酸含量的測定.
[1]趙春光,程立坤,徐慶陽,等. 微生物法生產L–色氨酸的研究進展[J]. 發酵科技通訊,2008,37(4):34-36.
[2]Kim H U,Kim T Y,Lee S Y. Metabolic flux analysis and metabolic engineering of microorganisms[J]. Molecular Biosystems,2008,4(2):113-120.
[3]Yanofsky C. Using studies on tryptophan metabolism to answer basic biological questions[J]. The Journal of Biological Chemistry,2003,278(13):10859-10878.
[4]侯冬巖,回瑞華. 色氨酸和酪氨酸的雙波長熒光光譜的研究[J]. 分析實驗室,2001,20(6):88-89.
[5]楊曉云,徐漢虹,王立世,等. 色氨酸、半胱氨酸和酪氨酸的高效毛細管電泳分析[J]. 分析測試學報,2001,20(3):15-18.
[6]Widner B,Leblhuber F,Walli J,et al. Tryptophan degradation and immune activation in Alzheimer’s disease[J]. Neural Transm,2000,107(3):343-353.
[7]王健,陳寧,徐詠全,等. 發酵液中色氨酸含量的快速測定[J]. 食品與發酵工業,2004,30(2):123-125.
[8]張昌偉,徐慶陽,劉淑云,等. 2,4–二硝基氟苯衍生法測定發酵液中組氨酸方法的優化[J]. 現代化工,2007,27(2):743-745.
[9]陳立仁,蔣生祥. 高效液相色譜基礎與實踐[M]. 北京:科學出版社,2001:114-120.
[10]王宇成. 最新色譜分析檢測方法及應用技術實用手冊[M]. 長春:吉林出版集團,2004:205-212.
[11]饒志明,徐美娟,沈微,等. 高效液相色譜測定發酵液中1,2–二羥基丙酮(DHA)方法的建立[J]. 中國生物工程雜志,2008,28(1):61-64.
[12]Sprenger G A. Aromatic amino acids[J]. Microbiology Monographs,2007,5:93-127.
Quick Determination of L-Tryptophan in Fermented Broth by HPLC
CHENG Li-kun,XU Qing-yang,XIE Xi-xian,CHEN Ning
(Key Laboratory of Industrial Microbiology,Ministry of Education,College of Biotechnology,Tianjin University of Science & Technology,Tianjin 300457,China)
A method to determine L-tryptophan in fermented broth was developed by high performance liquid chromatography(HPLC). An Agilent C18(5 μm,150 mm×4.6 mm)was used with the mobile phase of 0.03% KH2PO4water solution and methanol(the ratio of volume was 90 to 10). The flow rate was at 1.0 mL/min and the detective wavelength was 278 nm. The method was rapid,accurate and simple with a good linearity(R2=0.999 9)in the range of 0.000 to 1.000 g/L for L-tryptophan. The average recovery was 98.93% with the relative standard deviation of 0.247%. The method was applicable for L-tryptophan determination in the fermented broth.
L-tryptophan;HPLC;determination
TQ922
A
1672-6510(2010)01-0009-04
2009-07-03;
2009-10-13
國家“重大新藥創制”科技重大專項課題(2008ZX09401-05);國家“十一五”科技支撐計劃重點項目(2008BAI63B01)
程立坤(1984—),男,山東濱州人,碩士研究生;通信作者:陳 寧,教授,ningch@tust.edu.cn.
- 天津科技大學學報的其它文章
- 基于LabVIEW的磨漿機綜合參數檢測系統設計

