合成聚-β-羥基丁酸芽孢桿菌的篩選、鑒定及碳氮源優(yōu)化*
周 琴, 蔣冬花, 楊 葉, 嵇 豪
(浙江師范大學 化學與生命科學學院,浙江 金華 321004)
聚-β-羥基丁酸(PHB)是細胞內的一類生物聚酯,其力學性質與一些熱塑性材料如聚丙烯相似,并且可以被微生物完全降解,因而被稱之為“生物可降解塑料”,是真正的環(huán)境友好型產品[1-2].研究生物可降解塑料以替代化學合成塑料,可以幫助我們解決塑料污染問題,節(jié)約能源,實現(xiàn)資源與環(huán)境的可持續(xù)發(fā)展[3].PHB是微生物在碳、氮等營養(yǎng)失衡的條件下合成的碳源與能源的高分子儲存物(分子量為50 000~1 000 000)[4-5].作為微生物合成的可降解材料,PHB除了具有與化學合成高分子相似的理化性質外,還具有一般化學合成高分子所沒有的性質,如光學活性、低透氧性、抗紫外輻射、生物可降解性、生物相容性、壓電性和抗凝血性等[6-7],在工業(yè)、農業(yè)、環(huán)保、食品、醫(yī)藥等領域具有十分廣闊的應用前景.如在醫(yī)療領域,PHB可以作為藥物基質植入人體,以控制藥物的釋放,且最終降解產物為β-羥基丁酸,沒有任何毒副作用[8-9].目前,PHB生產菌株主要有真養(yǎng)產堿桿菌(Alcaligeneseutrophus),肥大產堿桿菌(Alcaligeneslatus),巨大芽孢桿菌(Bacillusmegaterium),極端嗜鹽菌(Halobacterium),等等[10].其中真養(yǎng)產堿桿菌是研究最多的PHB生產菌種,轉基因大腸桿菌(Escherichiacoli)將成為PHB生產的重要工程菌種[11].
盡管PHB具有代替石油衍生物生產塑料的優(yōu)勢,但是利用PHB生產可降解塑料的方法受到了限制,原因在于其價格昂貴[12-13].降低PHB生產成本的主要途徑有2條:一是通過微生物如巨大芽孢桿菌、重組大腸桿菌的菌體量的提高,以及菌體PHB含量的提高,使提取PHB的成本降低;二是通過降低培養(yǎng)基原料的成本,使PHB生產成本降低.不同的培養(yǎng)基會使PHB積累量不同[14],并且PHB的合成受到了環(huán)境中C、N等的限制[15].因此,人們對這類微生物碳氮源優(yōu)化做了一系列實驗研究.一般產物產量的持續(xù)提高證明了發(fā)酵條件優(yōu)化的成功性[16].
本實驗從環(huán)境比較惡劣的污泥中篩選具有良好抗逆性的芽孢桿菌菌株,主要依據是PHB可用作碳源和能源的儲備物,并且PHB的存在可以增強細胞對逆境的抵抗力, PHB可以作為碳源被細胞利用,以防止細胞自溶和死亡[5].由于PHB存在的特殊意義,一般抗逆性較強的菌株中PHB比較容易積累,這為篩選得到高產PHB的菌株奠定了一定的基礎.本實驗通過篩選菌株,得到較高產PHB的菌株;并且通過培養(yǎng)基碳氮源優(yōu)化,希望能使產PHB的菌株大量生長,PHB含量提高,同時考慮培養(yǎng)基原料成本,以降低PHB生產成本.
1 實驗部分
1.1 實驗材料
芽孢桿菌菌株分離篩選自浙江省各地(紹興、寧波、金華、杭州、臺州、麗水、溫州、嘉興、嵊州、義烏)采集的土壤.土壤主要來源有河底淤泥、花壇土壤、菜地土壤、排污口岸泥土等.高產聚-β-羥基丁酸的芽孢桿菌從金華排污口岸泥土分離得到.
1.2 主要儀器和試劑
聚-β-羥基丁酸(Sigma公司),蘇丹黑(上海生工生物工程有限公司).LRH-280生化培養(yǎng)箱(廣東儀器設備廠),C24KC搖床(美國New Brunswick公司),MIKRO-22R離心機(德國Eppendorf公司),PB-10 pH計(德國Sartorius公司),UV-7504分光光度計(上海欣茂儀器有限公司),電子顯微鏡(德國Leica公司).
1.3 培養(yǎng)基
1)牛肉膏蛋白胨培養(yǎng)基[17]:牛肉膏3 g/L,蛋白胨5 g/L,NaCl 1 g/L,瓊脂20 g/L,pH 7.2~7.4.用于菌種分離.
2)種子培養(yǎng)基:牛肉膏25 g/L,蛋白胨10 g/L,NaCl 5 g/L,pH 7.4.
3)發(fā)酵培養(yǎng)基[18]:蔗糖10 g/L,牛肉膏5 g/L,MgSO4·7H2O 0.2 g/L,CaCl20.05 g/L,F(xiàn)eCl30.01 g/L,K2HPO40.04 g/L,KH2PO40.03 g/L,NaH2PO4·2H2O 0.05 g/L,H3BO30.005 g/L,pH 7.8.
1.4 菌株分離和培養(yǎng)方法
1.4.1 菌種分離純化和初篩
取0.2 g污泥土,加入5 mL蒸餾水,85 ℃加熱15 min,進行10-1~10-4梯度稀釋,選擇10-2濃度的溶液100 μL涂布于牛肉膏蛋白胨培養(yǎng)基平板上,30 ℃培養(yǎng)24 h,出現(xiàn)圓形乳白色菌落;挑取單菌落,進一步分離、純化后,獲得純菌株.用蘇丹黑染色初步篩選產生PHB菌株,編號并保存.
1.4.2 種子培養(yǎng)
挑取蘇丹黑染色初篩得到的純菌株單菌落接種于150 mL錐形瓶(含30 mL種子培養(yǎng)基)中,30 ℃,200 r/min培養(yǎng)24 h,用作發(fā)酵種子.
1.4.3 發(fā)酵培養(yǎng)
將80 mL發(fā)酵培養(yǎng)基裝入250 mL錐形瓶中,按8%接種發(fā)酵種子,30 ℃,200 r/min培養(yǎng)40 h用于PHB的定量分析.
1.5 定量分析
1.5.1 PHB的初步定量
用蘇丹黑染色法[5,19].將少許細菌熱固定于載玻片上后,用3 g/L蘇丹黑乙二醇溶液染色10~15 min,二甲苯浸泡脫色,再用5 g/L番紅水溶液復染30 s.置油鏡下觀察,PHB顆粒呈藍黑色,菌體呈紅色.
1.5.2 PHB的精確定量
按Law和Slepecky法[20]對PHB進行定量分析.經培養(yǎng)、離心獲得的菌體細胞用V(CHCl3)∶V(無水乙醇)=2∶1抽提液60 ℃抽提1 h后,用濃硫酸于100 ℃處理10 min,用紫外分光光度計在235 nm波長下測定吸光度值.
經PHB標準品的標準曲線測定,得到標準曲線方程為
Y=0.173 4X,R2=0.998 7.
其中:Y代表吸光度;X代表PHB的質量濃度,單位為μg/L.根據菌體中提取PHB的吸光度,計算菌體中PHB的含量.
1.5.3 菌體干質量的測定
50 mL發(fā)酵培養(yǎng)液經10 000 r/min離心5 min,沉淀的菌體用蒸餾水洗3遍,80 ℃烘箱烘干至恒重,之后轉化為每1 L發(fā)酵液中菌體的質量.
1.6 菌株的鑒定
1.6.1 形態(tài)特征觀察
牛肉膏蛋白胨培養(yǎng)基平板上28 ℃培養(yǎng)48 h,觀察菌落特征;培養(yǎng)24 h進行革蘭氏染色,觀察菌體形態(tài)及染色結果[21].
1.6.2 生理生化實驗
Methyl-Red(M. R.)實驗、Vagex-Proskauer(V. P.)實驗、淀粉水解實驗、明膠水解實驗、吲哚實驗、H2S實驗、硝酸還原實驗、卵磷脂水解實驗、碳源利用實驗和氮源利用實驗,分別參照文獻[21-22]的方法進行.
1.6.3 16S rRNA的PCR擴增、序列測定和系統(tǒng)發(fā)育分析
用UNIQ-10細菌基因組DNA抽提試劑盒提取樣品的基因組DNA.采用16S rDNA正反向通用引物[23]:5-AGAGTTTGATCCTGGCTCAG-3和5-AAGGAGGTGATCCAGCCGCA-3,用Pfu酶進行PCR擴增.PCR擴增程序為:98 ℃ 5 min,95 ℃ 35 s,55 ℃ 35 s,72 ℃ 1 min,35個循環(huán);72 ℃ 4 min.擴增產物經純化后連入克隆載體pMD18-T,由上海生物工程技術有限公司完成測序.將測得的基因序列通過Blast程序與GenBank中核酸數(shù)據庫(http://www.ncbi.nlm.nih.gov/blast)進行對比分析,并利用MEGA4以N-J法繪制系統(tǒng)發(fā)育樹.
2 結 果
2.1 產PHB芽孢桿菌菌株的分離、純化和篩選
通過分離、純化和初步鑒定,共獲得416株芽孢桿菌,經蘇丹黑染色初步定量,得到產生PHB的量較高的48株芽孢桿菌,篩選得到的最高產PHB的芽孢桿菌Bm-10的蘇丹黑染色結果見圖1.將篩選出的各菌株接入發(fā)酵培養(yǎng)液中培養(yǎng)40 h后,用紫外分光光度計分析測定菌體細胞中PHB含量,每個地區(qū)取樣泥土中分離篩選得到的最高產PHB菌株中PHB含量的比較見圖2.從圖2可以看出,不同的芽孢桿菌菌株菌體產生PHB的能力有較大的差異,其中Bm-10菌株PHB產量最高達0.763 g/L.
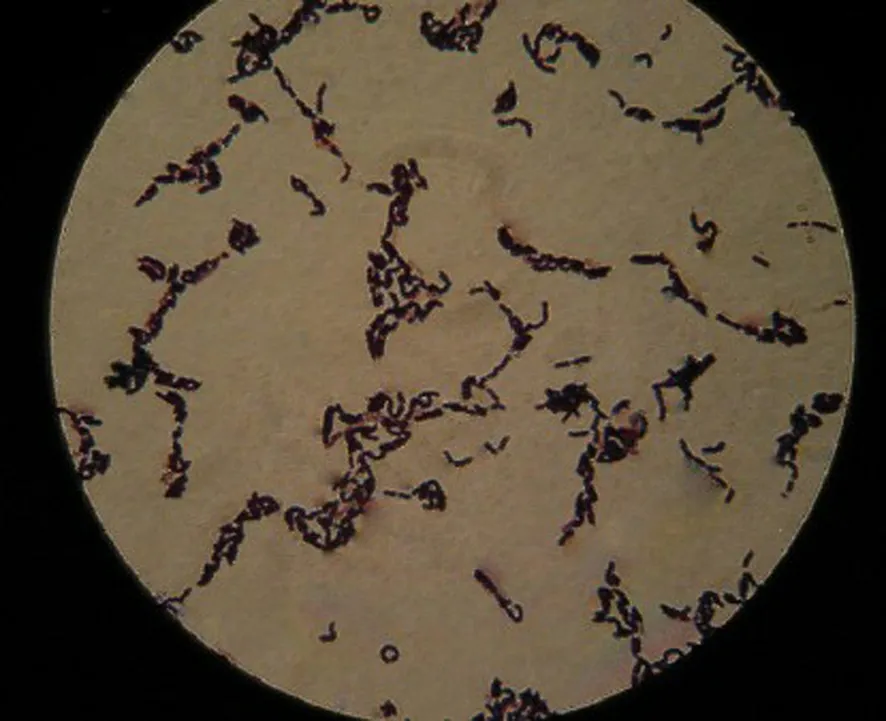
圖1 芽孢桿菌Bm-10菌體的蘇丹黑染色
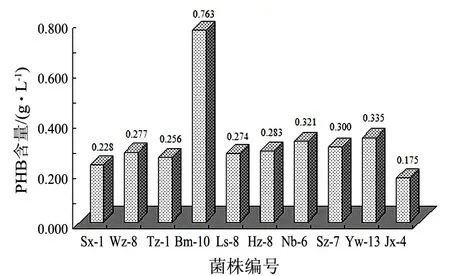
圖2 10株芽孢桿菌菌體中PHB含量
2.2 碳氮源對Bm-10菌株PHB產量的影響
2.2.1 氮源對Bm-10菌株PHB產量的影響
在發(fā)酵培養(yǎng)液中加入不同的氮源,30 ℃搖瓶培養(yǎng)40 h,測定菌體生長量及PHB積累情況.實驗結果(見表1)表明:有機氮源有利于菌體生長,牛肉膏相對蛋白胨而言更有利于PHB的積累;一般無機氮源不利于菌體的生長,并且胞內PHB含量相對較低,雖然硝酸鈉為氮源時菌體長勢良好,但極不利于PHB的積累.由于牛肉膏作為氮源時PHB產率顯著高于其他氮源,因此選擇牛肉膏作為該菌株積累PHB的氮源.
2.2.2 碳源對Bm-10菌株PHB產量的影響
碳源對Bm-10菌株菌體生長及PHB積累的影響見表2.由表2可見:以葡萄糖為碳源時菌體生長良好,PHB積累量相對較高;而以丁酸為碳源時,菌體生長最差,PHB積累量也較低.從表2可以看出,蔗糖也比較有利于Bm-10菌體的生長與PHB的積累,但是PHB在菌體中所占的比例較低.因此,選擇葡萄糖作為最佳碳源.
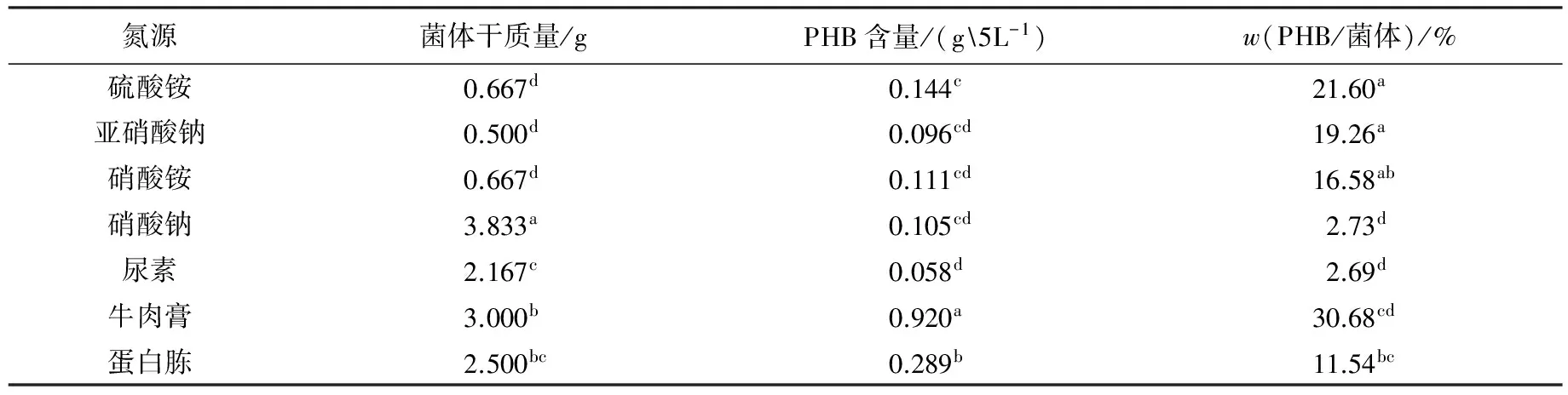
表1 氮源對Bm-10菌株菌體生長及PHB積累的影響
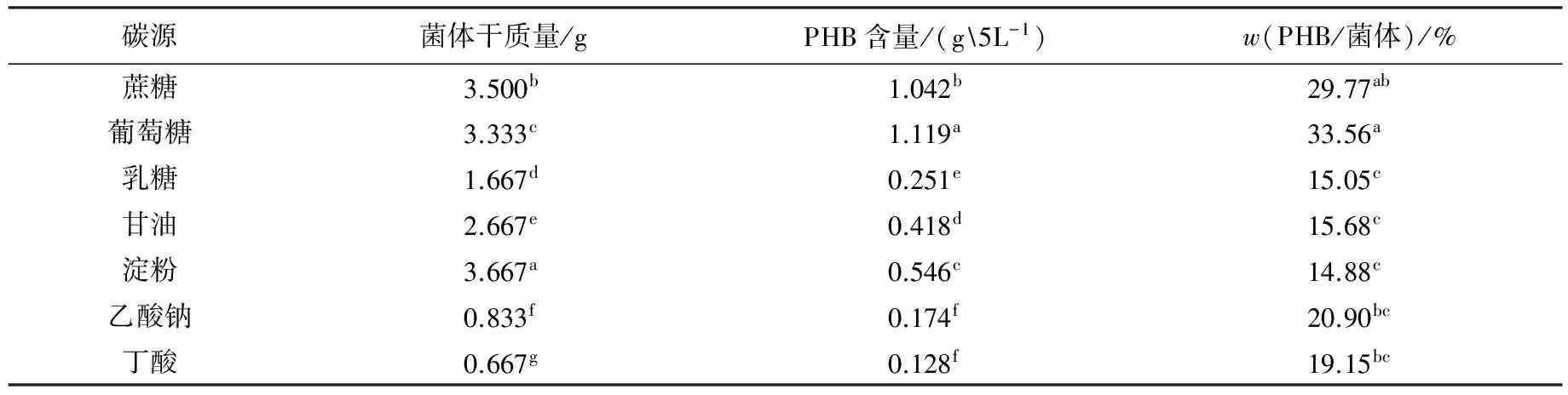
表2 碳源對Bm-10菌株菌體生長及PHB積累的影響
2.3 芽孢桿菌Bm-10菌株的鑒定
2.3.1 形態(tài)特征
Bm-10菌株在牛肉膏蛋白胨培養(yǎng)基平板上培養(yǎng)24 h后,菌落呈乳白色,表面和邊緣光滑,圓形不透明,直徑為0.2~0.4 cm(見圖3(a)).顯微鏡觀察菌體細胞呈桿狀或近橢圓形桿狀,粗大,長度為2.0~4.5 μm,寬度為1.0~1.2 μm,趨于扭曲的短鏈,周生鞭毛,具運動性(見圖3(b)),革蘭氏染色呈陽性.
2.3.2 生理生化特征
Bm-10菌株的生理生化特征和生長條件實驗結果見表3和表4.根據Bm-10菌株的表型特征、生長條件實驗和生理生化特性實驗,參考文獻[24],初步鑒定Bm-10菌株屬于芽孢桿菌科.
2.3.3 16S rDNA基因序列
Bm-10菌株基因組DNA的提取結果見圖4(a).采用細菌的16S rDNA通用引物進行PCR擴增,獲得一長度為1 513 bp的基因(見圖4(b)),序列測定由上海生物工程技術公司完成.
基于16S rDNA 序列分析進行細菌鑒定是國際上通用的鑒定技術.一般認為:16S rRNA序列同源性小于98%,可以認為種不同;同源性小于93%~95%,可以認為屬不同[25].將Bm-10菌株16S rDNA基因序列通過Blast比對分析,Bm-10菌株與巨大芽孢桿菌1431的遺傳距離最小,同源性高達99.7%.基于16S rDNA基因序列建立的芽孢桿菌屬系統(tǒng)發(fā)育樹見圖5.故將Bm-10菌株鑒定為巨大芽孢桿菌(Bacillusmegaterium).
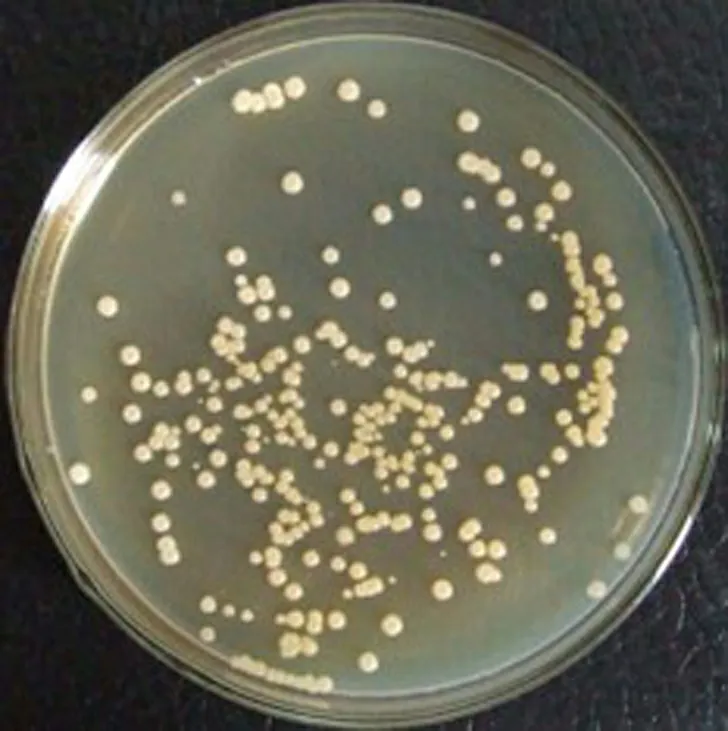
(a)菌落特征
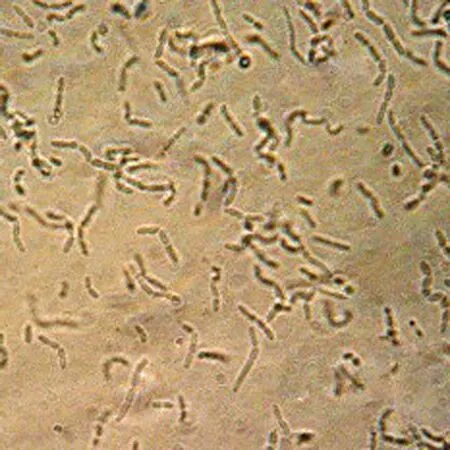
(b)菌體細胞形態(tài)

表3 芽孢桿菌Bm-10菌株的生理生化特征

表4 芽孢桿菌Bm-10菌株的生長條件
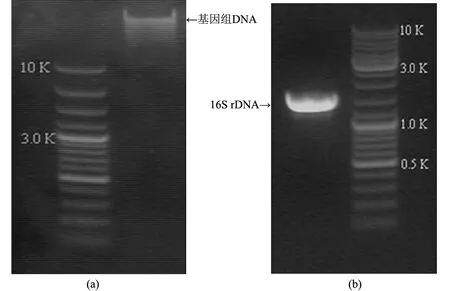
圖4 Bm-10菌株電泳分析結果
3 討 論
從污泥中篩選高產聚-β-羥基丁酸菌株,得到了一株PHB生產能力較好的菌株——芽孢桿菌Bm-10.
在Bm-10菌株氮源優(yōu)化中,牛肉膏作為氮源時PHB產率顯著高于其他氮源,因此選擇牛肉膏作為該菌株積累PHB的氮源.牛肉膏作為有機氮源,相對無機氮源而言,含有多種營養(yǎng)成分,有利于菌體的生長及PHB的積累.碳源優(yōu)化實驗結果表明,葡萄糖是Bm-10菌株菌體生長和合成PHB的最適碳源.葡萄糖利于菌體生長和PHB積累的原因可能是葡萄糖容易被細菌利用進入TCA循環(huán),在TCA循環(huán)中生成乙酰輔酶A,之后經過PHB合成途徑形成PHB.
對Bm-10菌株進行了一般傳統(tǒng)方法的鑒定——形態(tài)鑒定及生理生化鑒定,并為了得到可靠的結果,對該菌株也進行了16S rDNA基因序列鑒定.經過雙重認定,確定該菌株為巨大芽孢桿菌(Bacillusmegaterium).
本實驗于浙江金華污泥中分離篩選出一株巨大芽孢桿菌(Bm-10菌株),該菌的16S rRNA基因序列已登錄于Genbank,登錄號為GQ866974.該菌在牛肉膏蛋白胨培養(yǎng)基中不僅生長迅速,而且胞內能產生大量的PHB聚合物顆粒,PHB的積累量占菌體干質量的33.56%.該菌經過培養(yǎng)基繼續(xù)優(yōu)化、上罐條件優(yōu)化,將有望進一步開發(fā)成PHB新型生產菌.
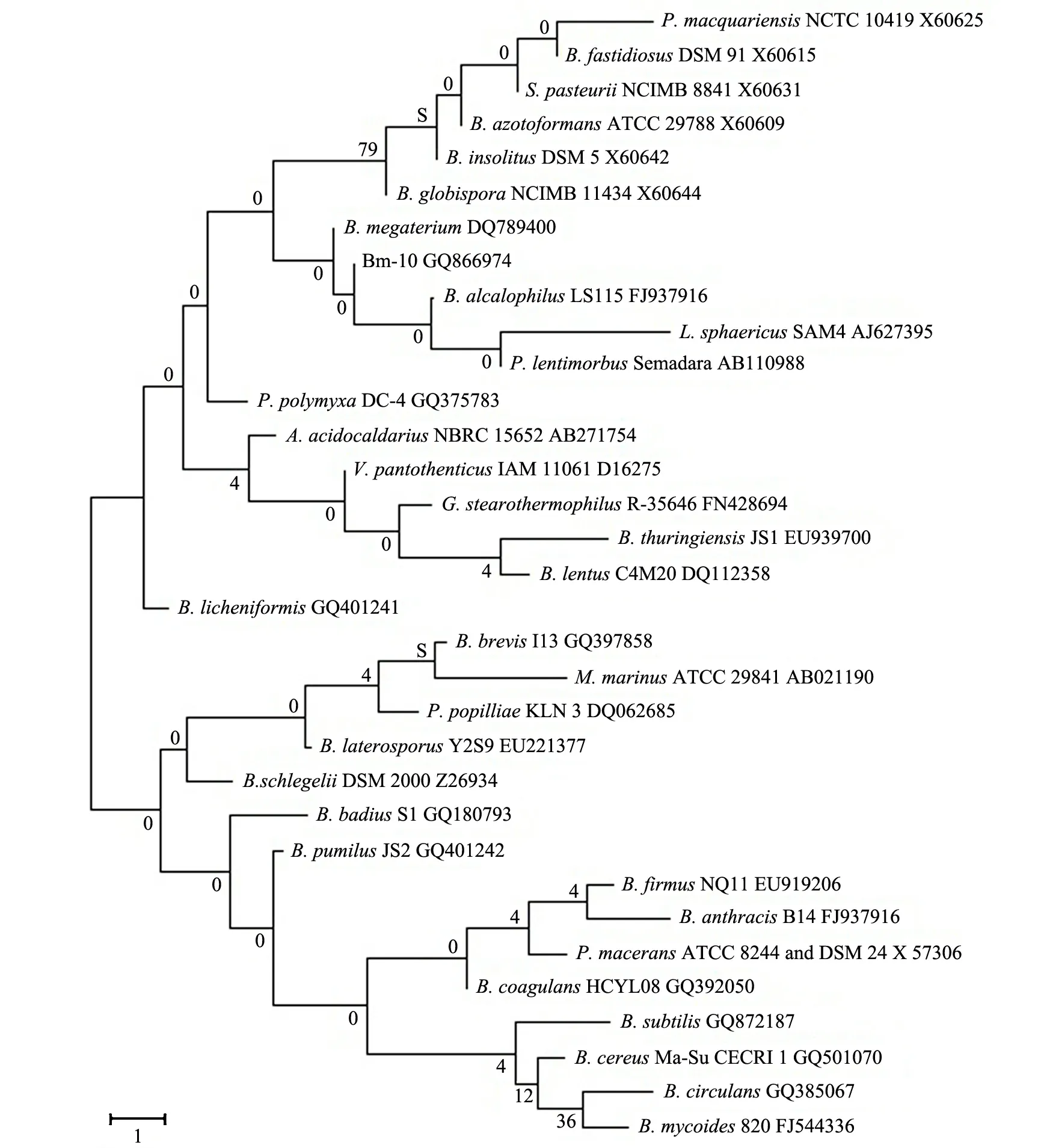
圖5 基于16S rDNA基因序列建立的芽孢桿菌屬系統(tǒng)發(fā)育樹
[1]Brandl H,Gross R A,Lenz R W,et al.Plastics from bacteria and for bacteria:poly(β-hydroxyalkanoates) as natural,biocompatible,and biodegradable polyesters[J].Adv Biochem Eng Biotechnol,1990,41:77-93.
[2]Birgit G,Dieter J.Assay of poly(3-hydroxybutyrate) depolymerase activity and product determination[J].Applied and Environmental Microbiology,2006,72(9):6094-6100.
[3]Luengo J M,Garcia B,Sandoval A,et al.Bioplastics from microorganisms[J].Current Opinion in Microbiology,2003,6(3):251-260.
[4]郭秀君,于昕.一種新型生物塑料(PHB)的研究進展和開發(fā)前景[J].生物工程進展,1997,17(5):61-65.
[5]Khanna S,Srivastava A K.Recent advances in microbial polyhydroxyalkanoates[J].Process Biochemistry,2005,40(2):607-619.
[6]Bruce A R,Kanda L.Production of poly(3-hydroxybutyric-C0-β-hydroxy-valeric) acids[J].Applied and Environmental Microbiology,1990,56(7):2093-2098.
[7]Roland G L,Gjalt W H,Hans P,et al.Formation of polyesters byPseudomonasoleovorans:effect of substrates on formation and composition of poly-(R)-3-hydroxyalkanoates and poly-(R)-3-hydroxyalkenoates[J].Applied and Environment Microbiology,1988,54(12):2924-2932.
[8]許天開,趙樹杰.PHB在生物醫(yī)學中的應用研究進展[J].應用與環(huán)境生物學報,1995,1(1):85-91.
[9]Freed L E.Composition of cell-polymer cartilage implants[J].Biotechnology and Bioengineering,1994,43(7):605-614.
[10]蘇濤,周河治,梁靜娟.微生物合成可降解塑料聚羥基鏈烷酸(PHA)[J].工業(yè)微生物,1997,27(3):37-44.
[11]Aoyama T,Carlos A J,Saito H,et al.Strain recovery mechanism of PBT/rubber thermoplastic elastomer[J].Polymer,1999,40(13):3657-3663.
[12]Taguchi S,Doi Y.Evolution of polyhydroxyalkanoate (PHA) production system by "enzyme evolution":successful case studies of directed evolution[J].Macromolecular Bioscience,2004,4(3):146-156.
[13]Nomura C T,Taguchi S.PHA synthetase engineering towards super biocatalysts for custom-made biopolymers[J].Applied Microbiology and Biotechnology,2006,73(5):969-979.
[14]Hsieh W C,Wada Y,Chang C P.Fermentation,biodegradation and tensile strength of poly(3-hydroxybutyrateco-4-hydroxybutyrate) synthesized byDelftiaacidovorans[J].Journal of the Taiwan Institute of Chemical Engineers,2009,40(2):143-147.
[15]Braunegg G,Lefebvre G,Genser K F.Polyhydroxyalkanoates,biopolyesters from renewable resources:physiological and engineering aspects[J].Journal of Biotechnology,1998,65(2/3):127-161.
[16]Choi K H,Chisti Y,Moo-Young M.Comparative evaluation of hydrodynamic and gas-liquid mass transfer characteristics in bubble column and airlift slurry reactors[J].The Chemical Engineering Journal,1996,62:223-229.
[17]李順鵬.微生物學實驗指導[M].北京:中國農業(yè)出版社,2003:111-112.
[18]陳接鋒.產聚β-羥基丁酸球衣菌分離篩選及發(fā)酵和提取的研究[D].福州:福建師范大學生物工程學院,2003.
[19]Singheton P,Sainsbury D.Dictionary of Microbiology and Molecular Biology[M].2nd ed.New York:John Wiley and Sons Inc,1988:854.
[20]Law J H,Slepecky R A.Assay of poly-hydroxybutyric acid[J].Journal of Bacteriology,1961,82(1):33-36.
[21]紀忠.微生物分類學[M].上海:復旦大學出版社,1990:4-6.
[22]Priest F G,Goodfellow M,Todd C.A numerical classification of the genus bacillus[J].J Gen Microbiol,1988,134(7):1847-1882.
[23]宋聰,李正國,邊萬平,等.果實采后病害拮抗菌的篩選及鑒定[J].西南師范大學學報:自然科學版,2007,32(2):76-81.
[24]布坎南 R E,吉本斯 N E.伯杰細菌鑒定手冊[M].中國科學院微生物研究所《伯杰細菌鑒定手冊》翻譯組,譯.北京:科學出版社,1984:729-794.
[25]Fry N K,Warwick S,Saunders N A,et al.The use of 16S ribosomal RNA analyses to investigate the phylogeny of the familyLegionellaceae[J].Journal of General Microbiology,1991,137(5):1215-1222.

