釀酒酵母W5及休哈塔假絲酵母20335原生質體制備條件的確定
張麓巖,張夢云,葛菁萍
(黑龍江大學生命科學學院微生物黑龍江省高校重點實驗室,黑龍江哈爾濱 150080)
自1974年匈牙利學者Ferenczy報道了白地霉(Geotrichum candidum)營養缺陷型突變株的原生質體融合后[1],微生物原生質體融合技術迅速發展。融合的種屬范圍逐漸擴大,融合的親緣關系由最初的種內株間融合,發展到種間、屬間,甚至科間的遠源融合,融合的技術也由最初的化學融合法擴展到電細胞融合法、電磁融合法、激光融合法等[2]。發展至今,原生質體融合技術已成為一種系統、成熟的微生物育種手段,在微生物工業育種中發揮著重要的作用。木質纖維素原料是地球上最豐富、最廉價的可再生資源,但目前大部分木質纖維素資源尚不能夠被人類利用。隨著石油等不可再生資源的日漸匱乏以及糧食危機的繼續存在,如何以豐富的木質纖維素類資源為原料,代替糧食進行可再生清潔能源—生物乙醇的發酵成為當前研究的熱點[3]。由于木糖是木質纖維素水解物中含量僅次于葡萄糖的一種單糖[4],因此如何有效地利用木糖,成為木質纖維素生物轉化生產乙醇的關鍵環節之一。釀酒酵母(Saccharom yces cerevisiae)具有細胞大、細胞壁厚、乙醇耐受性好、耐高糖、耐抑制物、代謝副產物少且在發酵過程中不易污染雜菌等特點[5],成為生物乙醇發酵的首選微生物。但由于釀酒酵母本身缺少木糖代謝途徑中的關鍵酶,從而不能利用木糖生產乙醇。休哈塔假絲酵母(Candida shehatae)具有木糖代謝流,能較好地利用木糖產生乙醇[6]。利用原生質體融合的方法,構建釀酒酵母與休哈塔假絲酵母融合株,避免了其他常規育種手段的冗繁環節,可在較短的時間內實現雙親株遺傳物質較大程度上的重組,獲得優良性狀的融合子。本文旨在確定釀酒酵母W5、休哈塔假絲酵母20335原生質體制備的條件,為雙親株原生質體融合工作奠定基礎。
1 材料與方法
1.1 材料
1.1.1 菌種 釀酒酵母W5,原養型,由本實驗室保存;休哈塔假絲酵母20335,原養型,由本實驗室保存。
1.1.2 培養基 ①YEPD液體培養基:酵母膏1%,蛋白胨2%,葡萄糖2%;②YEPDS液體培養基:在YEPD液體培養基中加入17%的蔗糖;③YEPD、YEPDS固體培養基均在對應液體培養基中添加2%的瓊脂粉。以上培養基于108℃,滅菌20 min。
1.1.3 試劑 ①脫壁預處理劑:0.1 mol/L pH 5.8檸檬酸-磷酸鹽緩沖液(CPB)中含0.2%β-巰基乙醇(體積比)及0.06 mol/L EDTA;②原生質體制備液:0.1 mol/L pH 5.8檸檬酸-磷酸鹽緩沖液(CPB)中含0.8 mol/L山梨醇和0.01 mol/L EDTA;③2%蝸牛酶液:用0.1 mol/L pH 5.8檸檬酸-磷酸鹽緩沖液配置,0.22μm細菌濾器過濾除菌;④高滲溶液:15%的蔗糖溶液。
1.2 方法
1.2.1 雙親株對數生長期的測定 取4℃保藏的雙親株斜面菌種,活化1~2代。挑取活化后的菌體,接種于100 mL/250 mL YEPD培養基中,30℃、140 r/min搖瓶培養14 h。吸取菌懸液,按5%接種量轉接于100 mL/250 mL YEPD培養基中,30℃、140 r/min搖瓶培養。每隔1 h取菌液,于600 nm下測定其OD值,并繪制曲線。
1.2.2 雙親株原生質體制備及再生 菌體培養至對數生長期中期,4 500 r/min離心10 min收集菌體沉淀。無菌水洗滌菌體沉淀2次,并調整細胞數為108個/mL,吸取6 mL調整細胞數后的菌懸液,4 500 r/min離心10 min。向得到的菌體沉淀中加入3 mL脫壁預處理劑,30℃、100 r/min處理30 min,4 500 r/min離心收集菌體沉淀。用原生質體制備液洗滌菌體沉淀,并用4 mL制備液重懸菌體沉淀于50 mL三角瓶內。向三角瓶內加入預先用2 mL CPB溶解的0.12 g蝸牛酶,使得酶的終濃度為2%,30℃、100 r/min酶解處理30 min。吸取酶解處理后的菌液,分別用高滲溶液和無菌水進行梯度稀釋,依次涂布YEPDS及YEPD平板,30℃培養36~48 h,計數再生菌落數(B)及裂解計數(C)。
以未經酶解的菌懸液作為對照組,無菌水梯度稀釋后涂布YEPD平板,記錄為總菌數(A)。根據A、B、C值計算原生質體的制備率及再生率。
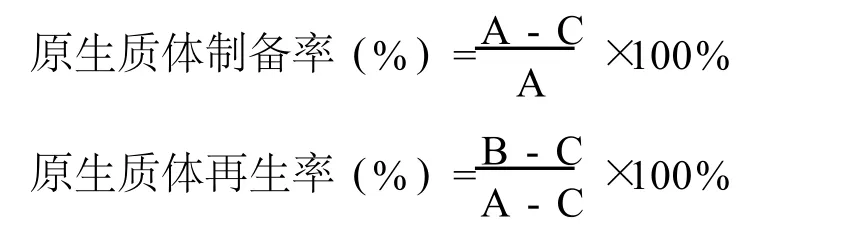
式中:A—蝸牛酶處理前的活菌數(個/mL)
B—酶處理組高滲溶液稀釋后再生菌落數(個/mL)
C—蝸牛酶處理后,經無菌水裂解處理,在YEPD平板上長出的菌落數(個/mL)
1.2.3 脫壁預處理時間對原生質體制備率的影響 將脫壁預處理時間調整為20、30和40 min,其他條件按照1.2.2的過程制備雙親株原生質體,研究不同預處理時間對雙親株原生質體制備率的影響。
1.2.4 酶解時間對原生質體制備率及再生率的影響 將1.2.2中的酶解時間調整為15、30、45、60和75 min,制備雙親株原生質體,計算原生質體的制備率及再生率,研究不同酶解時間對原生質體制備率及再生率的影響。
2 結果與分析
2.1 雙親株對數生長期的測定
由于菌體的生理狀態不同,其細胞壁結構、代謝水平、菌體活力等均不相同。研究發現酵母菌對數生長期的細胞代謝活躍,生長率高,群體細胞的化學組成、形態及生理特征比較一致[7]。因此,酵母菌原生質體制備時一般取對數生長期的細胞。W5與20335在培養3 h后均進入對數生長期,W5培養3~7 h時生長較迅速,當培養至8小時后生長減慢,基本進入穩定期,選用培養4~5 h的菌體進行原生質體的制備;20335生長較W5緩慢,培養3~10 h為對數生長期,10 h后進入穩定期,選用培養6~7 h的菌體用于原生質體的制備,見圖1。
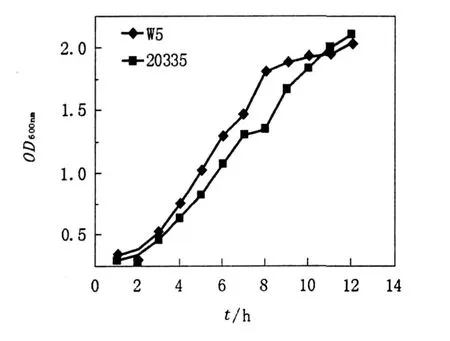
圖1 雙親株生長曲線Fig.1 The growth curve of the two parent strains
2.2 脫壁預處理時間對原生質體制備率的影響
原生質體制備時,所使用的脫壁預處理劑中含有β-巰基乙醇及EDTA,前者可以使細胞壁中蛋白質分子內的二硫鍵被還原,從而切開分子鏈,使酶更容易滲入,發揮更好的酶解作用[8]。EDTA則是一種金屬螯合劑,加入EDTA后,可以有效地去除反應體系中金屬離子對酶的影響,從而提高酶的水解效率[9]。通過試驗結果可以看出,在一定的預處理時間范圍內對菌體進行處理后,可以在較短時間內獲得較高的原生質體得率,但當原生質體制備率較高時,繼續增加脫壁預處理時間,對原生質體得率的影響并不顯著。當預處理20 min時,W5、20335原生質體制備率均為90%左右,處理時間延長10 min后,制備率分別上升為98.3%及94.4%,見表1。在此基礎上再延長10 min后,雙親株原生質體得率均沒有明顯的提高。鑒于脫壁預處理劑可能會損傷原生質體膜,影響原生質體的再生,因此,選擇30 min作為預處理的最佳時間。
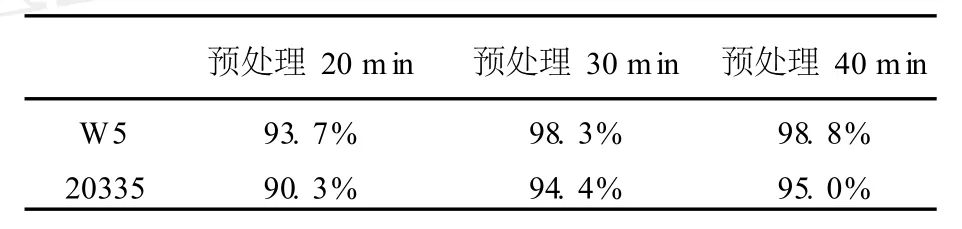
表1 不同脫壁預處理時間對W5、20335原生質體制備率影響Table 1 The effect of different preprocessing time to the protoplast preparation ratio of W5 and 20335
2.3 酶解時間對原生質體制備率及再生率的影響
酶作用時間及體系中酶的終濃度是原生質體制備過程中較為重要的影響因素。酶解時間過長,對于先形成的原生質體膜有毒害作用,并且酶解時間過長,微生物細胞去壁太徹底,嚴重影響原生質體的再生。但如果酶解時間太短,則導致原生質體的形成率太低,也不利于原生質體的融合[10]。同時,酶用量過大,就會導致酶中帶有的對原生質體有害的雜酶量增加,當雜酶濃度達到一定值時,必然會影響原生質體的活性,從而影響原生質體的融合與再生[11]。
本試驗以體系中使用的固體酶量0.12 g為基準,分別研究了酶解15、30、45、60和75 min時,W5和20335原生質體制備率與再生率。由圖2和圖3可知,隨著酶解時間的延長,W5、20335原生質體的制備率不斷升高,并且趨近于100%。原生質體的再生率則隨著酶解時間的增加呈現降低的趨勢。其中,酶解15 min時,W5原生質體的制備率為86.4%,再生率為9.4%,當酶解時間為75 min時,制備率增加為99.5%,再生率卻下降為1.4%。同樣,酶解15 min時20335原生質體的制備率為97.1%,隨著酶解時間增加到75 min時,制備率為99.9%,再生率卻由31.4%下降到5.2%。根據試驗結果,選擇制備率與再生率乘積最大的酶處理時間為最佳的原生質體制備時間。因此,確定W5、20335的酶解時間均以15 min為宜。
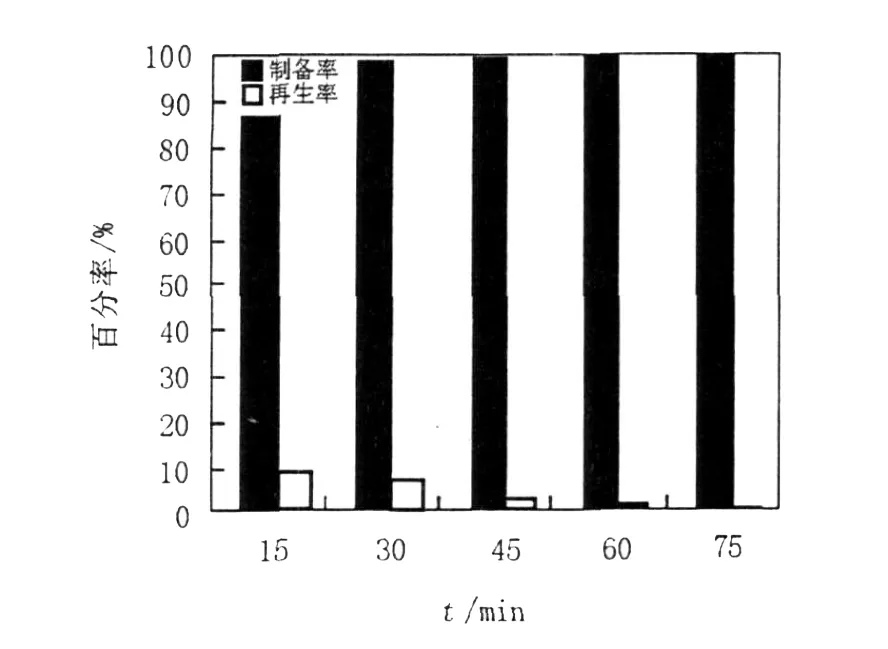
圖2 酶解時間對W5原生質體制備率及再生率的影響Fig.2 The effect of different enzymolysis time to the protoplast preparation ratio and regeneration ratio ofW5
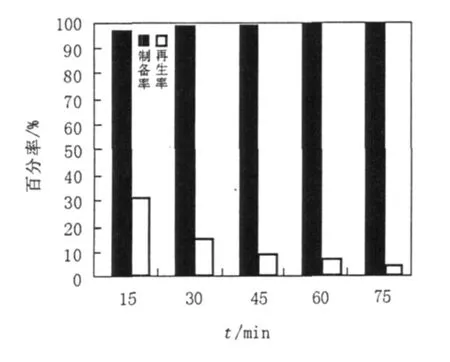
圖3 酶解時間對20335原生質體制備率及再生率的影響Fig.3 The effect of different enzymolysis time to the protoplast preparation ratio and regeneration ratio of 20335
3 結 論
試驗研究了脫壁預處理時間及酶解時間對W5、20335原生質體制備率及再生率的影響。結果發現,其他條件相同時,經過脫壁預處理的菌體更容易在較短的時間內得到原生質體,且原生質體的得率與脫壁預處理時間有關。在一定時間范圍內,原生質體的得率隨脫壁預處理時間的增加而上升,但達到一定制備率后,繼續延長預處理時間原生質體得率上升不明顯。綜合考慮預處理劑對原生質體制備和再生的影響,最終確定30 min為最佳預處理時間。隨著酶解時間的延長,W5、20335原生質體制備率呈現上升的趨勢,再生率則呈下降趨勢。根據制備率與再生率乘積最大的原則,最終確定了W5、20335酶解處理時間均為15 min。綜上所述,最終確定W5、20335原生質體制備的最佳條件為:選取W5、20335培養4~5 h及6~7 h的菌體,30℃、100 r/min預處理30 min,固體酶用量0.12 g,30℃、100 r/min酶解處理15 min,可以達到W5、20335原生質體融合的較理想的制備率及再生率。
[1] 譚周進,肖啟明,肖克宇,等.原生質體融合技術在微生物菌種選育中的應用[J].生物技術,2003,13(1):35-37.
[2] 平文祥,周東坡.微生物原生質體融合[M].哈爾濱:黑龍江科學技術出版社,1990:8-9.
[3] 王凡強,許平.產乙醇工程菌研究進展[J].微生物學報,2006,46(4):673-675.
[4] 宋昕磊.植物纖維的酒精發酵[D].北京:北京化工大學,2007:6.
[5] Cheng ChangLina,Pao Chuan Hsieha,JengLeunMaub.Construction of an intergeneric fusion fromSchizosaccharomyces pombeandLentinula edodesfor xylan degradation and polyol production[J].Enzyme and Microbial Technology,2005,36:107-117.
[6] 岳瑞雪,陳葉福,肖冬光,等.休哈塔假絲酵母發酵木糖生產乙醇的研究[J].釀酒科技,2007,9:45-52.
[7] 譚文輝,李燕萍,許楊.微生物原生質體制備及再生的影響因素[J].現代食品科技,2006,22(3):263-265.
[8] Yali Cheng,Richard R.Belanger.Protoplast preparation and regeneration from spores of the biocontrol fungus Pseudo-zyma focculosa[J].FEMS Microbiology Letters,2000,190:287-291.
[9] MingHua Dai,Sara Ziesman,Thomas Ratclife.Visualization of protoplast fusion and quantitation of recombination in fused protoplasts of auxotrophic strains of Escherichia coli[J].Metabolic Engineering,2005,2(7):45-52.
[10] 鄭重誼,譚周進,肖克宇,等.不同因素對兩株細菌原生質體制備的影響[J].生物技術通報,2007,5:131-135.
[11] 孫劍秋,周東坡.微生物原生質體技術[J].生物學通報,2002,37(7):9-11.

