正確理解熱力學第三定律
蘇許輝
(寧波中學 浙江 寧波 315100)
高中人教版《物理·3-3》主要包括熱學的相關內容.熱力學的三大定律是熱學的基礎,課本對熱力學第一定律和第二定律已經有了比較詳細的介紹,而對第三定律只有簡單的一個表述:任何系統都不能通過有限的步驟使自身溫度降低到絕對零度,即絕對零度不可達到.
在教學的過程中,每次講到這里,都有不少同學對此充滿好奇,問:為什么絕對零度不能達到呢?由于受到高中物理知識廣度和深度方面的限制,許多老師和學生習慣于從分子動理論出發,對熱力學第三定律——絕對零度不能達到的原因進行了較片面地理解,不少老師也都是按下面的方法進行解釋的.
1 依據分子動理論對“絕對零度不能達到”進行解釋
根據經典熱力學,溫度是物體分子熱運動平均動能的標志,它們之間的關系可以表達為
(1)
式中,k為玻爾茲曼常量;i為分子各種運動自由度數,包括分子的平動自由度、轉動自由度、振動自由度.
從(1)式可見,由于物體內分子無規則運動的平均能量與溫度成正比,因此如果絕對零度能夠達到,則分子的平均動能為零,分子將處于完全靜止的狀態,而這與分子動理論對分子的熱運動的描述:“物體是由大量分子組成的,分子永不停息地做無規則運動”相矛盾.
上面依據分子動理論的知識,從經典熱力學做出的解釋好像能夠說明絕對零度為什么不能達到.但是隨著實踐的進展,經典熱學理論已顯示出它的局限性:如果在絕對零度下粒子是靜止不動的,那么它的速度為零,這時它的位置就是確定的.這樣的話,位置和速度兩者的值我們都知道了,這不符合海森伯的不確定原理——它只允許知道一個.所以,近代物理的量子理論對經典熱力學作了修正,指出:即使溫度能夠達到絕對零度,分子也不會完全靜止,因為分子還具有“零點能”.并且,零點能的存在已經從實驗中得到了證實.
可以看出,依據分子動理論的相關內容,從經典熱力學出發,認為分子在絕對零度會靜止不動的觀點是站不住腳的,以此來解釋絕對零度不能達到就有一定的局限性.
2 熱力學零度不能達到的原因
現從能斯特定理出發,來證明絕對零度為什么不可達到[1].
首先考慮降溫的手段,即考查經歷何種過程降溫最有效.顯然,放熱降溫當然有效,但又必須有更低溫度的熱源,這是不實際的.因此,只有絕熱降溫是可取的方式.這又有兩種選擇:可逆或不可逆.我們來分析這兩種方式.假定以(T,y)為獨立參數,y可能是實驗可控的體積、壓強等.
對于可逆過程,隨著溫度的增加系統的熵亦增加.在S-T圖(圖1)上,假定物體系由y1線上的一點A經歷絕熱可逆過程(熵不變,沿水平線)到達y2線的B點.兩狀態的溫度分別記為TA和TB.
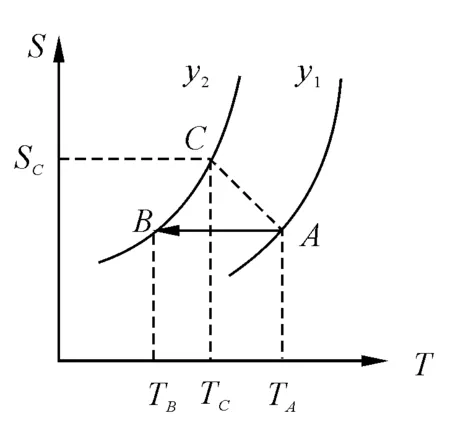
圖1 物體系熵隨溫度T和y的變化趨勢
如果由A經歷不可逆絕熱過程(熵增加)到達y2線,則應到達熵更大的一點C,顯然有
TC>TB
可見,可逆過程降溫更為有效,即絕熱可逆過程降溫是最有效的途徑,故而我們只討論絕熱可逆過程.
熵的計算公式
(2)
量子理論與實驗都給出,在極低溫度下,非金屬定容摩爾熱容CV∝T3,金屬CV∝T,所以
上述(2)式在T→0時收斂.并且,當物體系由A(TA,yA)經絕熱可逆過程(熵不變)至B(TB,yB)時,有
SA=SB
由能斯特定理
S(0,yA) =S(0,yB)
因而
(3)
如果
TA>0
則有
亦必有
TB>0
即絕熱可逆過程不能將溫度降至絕對零度.
因此,任何有限步驟都不能將體系的溫度降至絕對零度.
3 展望
熱力學第三定律雖明確指出,絕對零度不可能達到,但這并沒有阻止人們向這個最冷的極地逼近.早在1926年,德拜和吉奧克用磁冷卻法達到了10-3K.后來又有人攻破了10-6K.1995年,科羅拉多大學和美國國家標準研究所的兩位物理學家愛里克·科內爾和卡爾威曼成功地使一些銣原子達到了令人難以置信的溫度,即2×10-8K.2003年,科學家更獲得5×10-10K.當然,我們相信科學家一定還可以達到更低的溫度.然而,人們發現,溫度越低,進一步逼近絕對零度就更加困難.這所有的努力都說明熱力學第三定律的正確,即絕對零度是低溫的極限,是不可能達到的.
參考文獻
1 王竹溪. 熱力學. 北京:高等教育出版社,1955.355~365

