共抑制分子PD-1在類風濕關節炎模型免疫系統及滑膜組織的表達①
郭國寧 尚永軍 朱國宴 文 亮 向 強 (第三軍醫大學附屬西南醫院急診科,重慶 400038)
共抑制分子PD-1在類風濕關節炎模型免疫系統及滑膜組織的表達①
郭國寧 尚永軍②朱國宴③文 亮④向 強 (第三軍醫大學附屬西南醫院急診科,重慶 400038)
目的:探討共抑制分子PD-1在牛二型膠原(CII)誘導的類風濕關節炎模型(CIA)小鼠免疫器官、關節及RA患者滑膜組織內的表達。方法:使用牛二型膠原免疫DBA-1/j小鼠,建立小鼠類風濕關節炎模型;免疫組化檢測類風濕關節炎標本PD-1的表達變化;流式細胞分析術(FACs)檢測對PD-1陽性細胞進行定位。結果:免疫組化的結果證實,小鼠的骨髓、胸腺、脾臟及淋巴結有中有大量的PD-1陽性細胞,FACs分析結果表明這些PD-1+細胞主要為CD3+T細胞,B220+B細胞,CD68+巨噬細胞及CD11c+樹突狀細胞,統計分析表明CIA小鼠體內PD-1表達及分布相對于對照組小鼠沒有顯著提高。此外,RA患者及CIA小鼠的滑膜組織內僅發現少量PD-1陽性的細胞。結論:PD-1陽性細胞可能不參與類風濕性關節炎的發生發展過程。
PD-1;類風濕關節炎;滑膜組織;免疫器官;免疫組化
①本文受國家自然科學基金(30700855及60971117)資助
②內蒙古赤峰學院第一附屬醫院骨科,赤峰024000
③重慶江陵醫院婦產科,重慶400038
④通訊作者
類風濕關節炎(Rheumatoid arthritis,RA)是以對稱性多關節滑膜炎為主要臨床癥狀的自身免疫性疾病。多數病人有永久性骨破壞,并可出現關節外損害,若無恰當治療,則最終形成終生殘疾甚至危及生命[1]。
對RA關節損傷的病理研究發現,持續性活化的自身反應性T細胞在RA的病程中有重要作用。而對T細胞活化機制的研究表明,T細胞的有效活化和效應發揮需要共刺激信號,缺乏共刺激信號的抗原刺激易引起免疫耐受(Tolerance)、無反應性(Anergy)或細胞凋亡(Apoptosis)[2]。已知的幾種共刺激分子(CD28、CTLA-4、ICOS 、PD-1、BTLA 等)在多種疾病中起主導作用,合理的增強或封閉這些共刺激途徑已經應用于腫瘤、病毒和寄生蟲感染、移植排斥及自身免疫性疾病等的實驗治療并取得了良好的效果[2]。特別是,基于CTLA-4及CD40等共刺激途徑的免疫調節藥物已經應用于RA的臨床治療并取得了初步成效[3,4]。如K remer等[3]使用CTLA-4-Ig融合蛋白對220例處于活動期的RA患者進行治療,發現CTLA-4-IgFc治療6個月后,患者關節炎癥減輕,生活質量及關節功能均得到明顯改善,并且與CTLA-4-IgFc融合蛋白的使用劑量呈正相關。表明通過共刺激途徑來誘導T細胞對自身抗原的免疫耐受并應用于RA的臨床治療是—項很有前景、值得嘗試的研究。
PD-1(Program death-1)是1999年鑒定的胞內具有兩個免疫受體酪氨酸抑制性基序(ITIMs)共刺激分子受體,其結構和功能類似于CTLA-4。PD-1與其配體PD-L1或PD-L2交叉聯結后可下調TCR信號并最終抑制T細胞的活化[5]。而PD-1基因敲除小鼠可自發產生狼瘡樣的增生性關節炎,表明該信號在維持外周耐受中有關鍵作用[6]。最近的研究表明,PD-1基因的多態性與類風濕關節炎的發生相關,在RA患者的關節積液內也發現有顯著增多的CD4+PD-1+T細胞[7-9]。此外,使用PD-L1IgGFc融合蛋白增強PD-1信號可顯著降低CIA小鼠關節炎癥,提示PD-1信號可調節類風濕關節炎的發生及進程[10]。
雖然對PD-1在類風濕關節炎中的作用已經有了文獻報道。但是迄今對PD-1在小鼠及RA患者體內尤其是滑膜組織內的分布尚未知。本研究主要對比分析PD-1在CIA小鼠及正常對照小鼠骨髓、胸腺、脾臟及淋巴結表達變化,分析PD-1在滑膜組織內的分布情況,為進一步闡明PD-1在類風濕關節炎的病理進程中的作用提供新的線索。
1 材料與方法
1.1 材料 類風濕關節炎患者的滑膜組織:4例類風濕關節炎患者的標本取自西南醫院關節外科。患者經生化指標檢測、抗風濕因子抗體滴度及滑膜組織H&E染色都證實為類風濕關節炎。所有的手術患者在術前3個月內都未接受任何激素治療。標本使用4%甲醛固定,脫水后使用石蠟包埋。
1.2 方法
1.2.1 類風濕關節炎模型小鼠的建立 6周齡大小的雄性DBA-1/j小鼠購自上海中國科學院實驗動物中心并飼養于第三軍醫大學實驗動物中心。CIA模型的建立及評價如文獻[11]報道。簡單介紹如下:100μg牛二型膠原溶解于100μl的醋酸并使用完全佛氏佐劑充分乳化。選擇小鼠的尾根部多點注射。21天后在相同的位置再次使用相同劑量增強免疫。小鼠接受相同體積(100μl)的PBS注射作為對照。
為了評價關節炎癥程度,所有的小鼠每3天觀察一次。連續觀察40天。小鼠的關節炎癥臨床評分按如下標準劃分:0.所有的關節無任何腫脹或變紅;1.部分關節變紅但不腫脹;2.多數關節腫脹及變紅;3.關節及指頭都腫脹及變紅;4.關節僵硬或畸形強直[12]。
取經40天CII膠原免疫誘導的CIA模型(關節炎評分=4,n=5)及PBS對照(n=5)小鼠骨髓、胸腺、脾臟、腋下淋巴結組織。4%多聚甲醛固定并脫水后石蠟包埋。
1.2.2 PD-1表達的免疫組化 RA患者的滑膜組織及小鼠(PBS處理對照組及CIA模型)的免疫器官組織制成3~5μm的切片。免疫組化按常規方法進行。即切片經脫蠟及復水后,使用0.01 mol/L的枸櫞酸鈉抗原修復液進行抗原修復。待冷卻后使用0.03%H2O2處理30分鐘去掉內源性過氧化物酶活性。0.01%磷酸鹽緩沖液(PBS)沖洗5分鐘,3次后使用0.01%牛血清白蛋白(BSA)封閉30分鐘,隨即滴加山羊抗小鼠PD-1多抗(10μg/m l,該抗體也與人PD-1有交叉反應,R&D System),4℃條件下過夜孵育。次日滴加EnVision+TM(EnVisionTM System,HRP,mouse/rabbit,Dako)二抗并于室溫孵育 70分鐘。同時以山羊的IgG1作為同型對照。最后使用DAB對標本進行顯色,顯微鏡下控制顯色時間,使用蘇木素復染細胞核,水洗,脫水,透明后中性樹膠封片。
為了對比分析PD-1陽性細胞在PBS及CIA小鼠各器官內的表達變化,骨髓、淋巴結及胸腺各切片隋機選擇5個區域(放大倍數×600,0.018mm2/區域)進行照相。而脾臟切片則僅僅選擇白髓區域進行照相。陽性細胞使用Pro-Plus 5.0軟件進行計算。
1.2.3 PD-1表達的流式分析 使用流式細胞儀分析PD-1在CD4+T細胞、CD8+T細胞、B220+B細胞及CD11c+樹突狀細胞的分布。實驗步驟如下:骨髓,胸腺,脾臟及淋巴結組織制成單細胞懸液。細胞隨即加入 PE-PD-1、FITC-CD4、FITC-CD8、FITC-B220、FITC-CD11c抗體并室溫孵育30分鐘。隨后10 000細胞/樣進行上機檢測。實驗結果使用CellQuest軟件進行分析。
1.3 統計學分析 使用t檢測對PD-1陽性細胞在關節炎及對照小鼠各器官的表達變化進行對比分析。P<0.05為顯著差異。
2 結果
2.1 CIA模型的建立 PBS對照組小鼠后爪關節正常,而DBA-1/j小鼠在經牛Ⅱ型膠原免疫40天后,腳趾包括趾骨關節,掌骨關節,近端和遠端指間關節都出現明顯的腫脹。此外,H&E染色顯示CIA模型小鼠有大量炎細胞浸潤并出現滑膜增生,骨破壞及血管翳的形成(圖1),表明DBA-1/j小鼠在經牛Ⅱ型膠原免疫40天后可誘發關節炎。
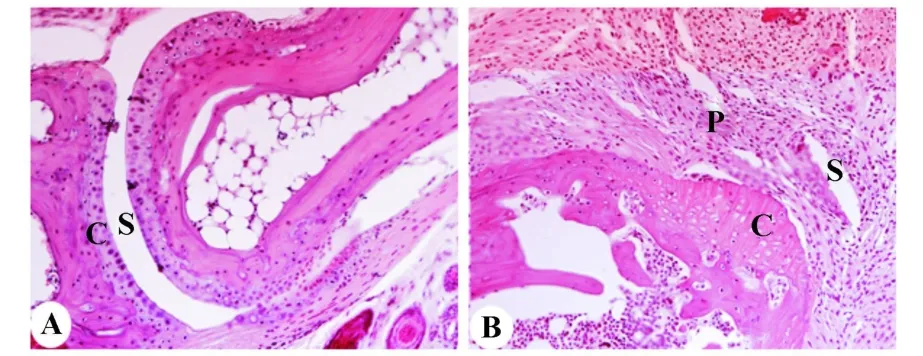
圖1 類風濕關節炎小鼠模型的建立Fig.1 H istological analysis in the joint of hind limbs during CIA
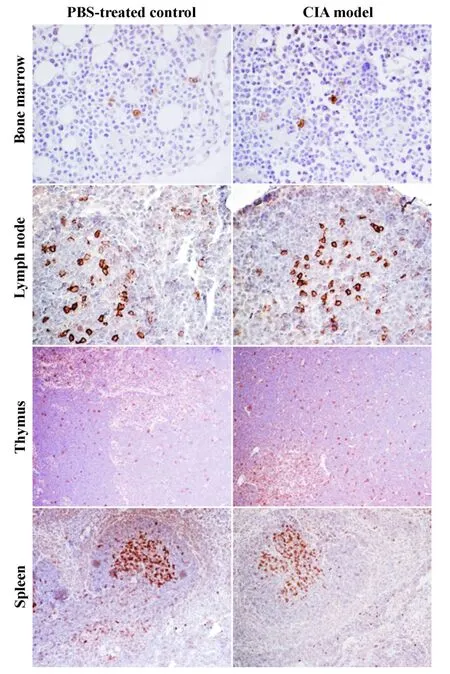
圖2 免疫組化分析PD-1在PBS及CIA小鼠各免疫器官的表達及分布Fig.2 The expression of PD-1 in the immune organs was determ ined by immunohistochem istry
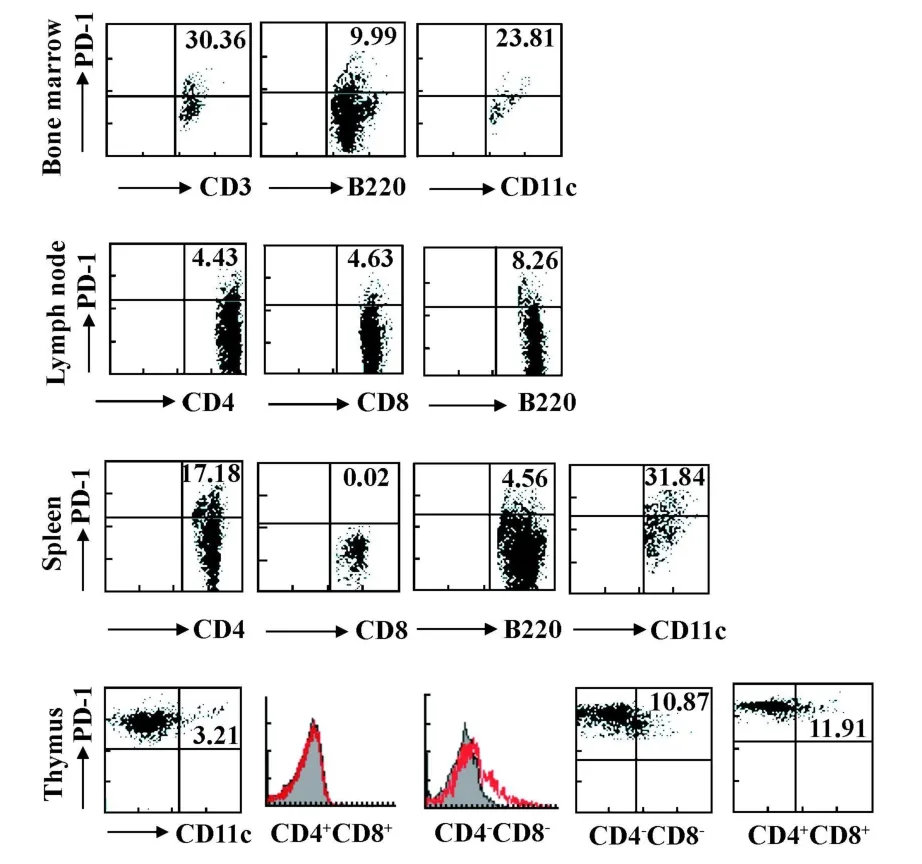
圖3 FACs分析PD-1在各免疫器官內的表達Fig.3 The phenotype of PD-1+cells in immune organswas determ ined by flow cetometry
2.2 PD-1表達分析結果 為了探討關節炎的發生及進程是否與免疫器官內PD-1的表達變化相關,我們使用免疫組化技術對CIA模型及對照組小鼠的免疫器官包括骨髓,胸腺,脾臟及掖下淋巴結的PD-1表達進行了分析。如圖2所示,PD-1主要表達于骨髓淋巴樣細胞;而淋巴結處,PD-1陽性的細胞也主要分布于皮質區;胸腺內PD-1陽性的細胞廣泛分布于胸腺髓質及皮質區;而脾臟,PD-1主要表達白髓區內淋巴樣的細胞,紅髓及白髓/紅髓連接區也有少量PD-1陽性的細胞。進一步使用FACs對骨髓、胸腺、脾臟及淋巴結的 CD4+T細胞、CD8+T細胞,B220+B細胞及CD11c+樹突狀細胞PD-1的表達情況進行了分析,結果顯示PD-1表達于這些器官內CD11c+樹突狀細胞、巨噬細胞、B細胞及T細胞。此外,在胸腺,CD4+CD8+雙陽性胸腺細胞缺乏PD-1表達(圖3)。
我們對CIA模型及對照組小鼠免疫器官內PD-1陽性細胞的數目分別進行了計算,統計分析結果表明PD-1陽性細胞的數目在兩組之間沒有顯著差異(圖4),表明在關節炎發生及進程中,免疫器官內的PD-1功能狀態未發生變化。
2.3 PD-1在滑膜組織的表達 為了進一步分析關節內PD-1的表達情況,我們對PBS對照、CIA模型小鼠及關節炎患者的滑膜組織進行免疫組化分析,如圖5所示,PBS對照及CIA模型小鼠的關節處發現有少量PD-1陽性的細胞。此外,人RA患者的滑膜組織也發現有少量的PD-1陽性細胞,表型分析其主要是樹突狀細胞。關節炎滑膜組織內有少量的PD-1陽性細胞表明滑膜內PD-1陽性細胞可能不參與類風濕關節炎的病理進程的調節。
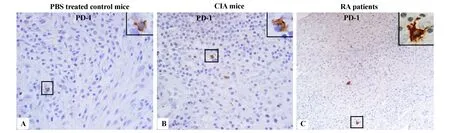
圖5 PD-1在小鼠關節及RA患者滑膜組織內的表達Fig.5 The expression and distribution of PD-1 in joints of normalm ice,rheumatoid synovium from CIAm ice aswellasRA patients

圖4 PD-1陽性細胞的數目在PBS處理組及CIA模型小鼠兩組之間的統計分析Fig.4 Thenumber of PD-1+cells in immune organs between PBS-treated m ice vs CIA m ice
3 討論
類風濕關節炎(Rheumatoid arthritis,RA)是一種累及滑膜關節為主的系統性自身免疫性疾病,早期以關節炎性腫脹、疼痛為主要表現,若未進行及時有效地治療,可逐漸出現關節軟骨及骨的損傷,最終導致關節畸形與強直,嚴重影響患者的生活質量及工作能力[1,2]。當前,RA的臨床治療仍以非甾體抗炎藥物和慢作用抗風濕藥物為主,糖皮質激素也較為常用。這些藥物均有一定療效,但由于毒副反應較人,病人難以長期服用。因此,急需新的特異性作用靶點或新的干預手段來對RA患者進行治療。
由于共刺激信號PD-1/PD-L在維持外周耐受中有關鍵作用,因此探討該途徑在疾病中的功能是目前研究的熱點。最近的研究表明,PD-1基因的多態性與類風濕關節炎的發生相關[7,8]。雖然在RA患者的關節積液內也發現有顯著增多的PD-1+T細胞[9]。但是迄今對PD-1在關節炎患者體內,尤其是免疫器官及滑膜組織的表達及分布況尚未未知。本研究我們系統分析了PD-1在關節炎模型小鼠及人滑膜組織內的表達情況。FACs檢測結果表明在正常小鼠,PD-1主要表達于免疫器官內的抗原遞呈細胞包括樹突狀細胞,巨噬細胞及免疫細胞如T細胞及B細胞。免疫組化分析表明,PD-1主要表達于骨髓內淋巴樣細胞;在胸腺,PD-1陽性的細胞廣泛分布于胸腺髓質及皮質;而在脾臟,PD-1主要表達白髓區淋巴細胞;我們也發現大量PD-1陽性的細胞位于淋巴結的皮質區。此外,我們對CIA模型及對照組小鼠免疫器官內PD-1陽性細胞的數目分別進行了計算,統計分析表明PD-1陽性細胞的數目在兩組之間沒有顯著差,表明在關節炎進程中,炎癥并沒有改變免疫器官內PD-1的表達。
為了進一步分析關節內PD-1的表達情況,我們對CIA模型小鼠及關節炎患者的滑膜組織進行免疫組化分析。結果顯示CIA模型小鼠的關節處僅僅發現有少量的PD-1陽性細胞。此外,人RA患者的滑膜組織也發現少量的PD-1陽性細胞。關節炎滑膜組織內沒有增多的PD-1陽性細胞浸潤表明關節及滑膜內的PD-1信號可能沒有參類風濕關節炎的病理進程的調節。
總之,本研究首次分析了PD-1在類風濕關節炎內的表達情況,為進一步基于通過PD-1/PD-L信號通路進行體內干預治療提供了理論基礎。
1 Goekoop-Ruiterman Y P,Huizinga TW.Rheumatoid arthritis:can we achieve true drug-free rem ission in patients with RA?[J].Nat Rev Rheumatol,2010;6:68-70.
2 Sharpe A H,Abbas,A K.T-cell costimulation-biology,therapeutic potential,and challenges[J].N Engl JM ed,2006;355:973-975.
3 Kremer JM,WesthovensR,Leon Metal.Treatment of rheumatoid arthritisby selective inhibition of T-cellactivation with fusion protein CTLA 4I[J].N Engl JMed,2003;349:1907-1915.
4 PiererM,Schulz A,RossolMetal.Herpesvirus entrymediator-Ig treatment during immunization aggravates rheumatoid arthritis in the collageninduced arthritismodel[J].J Immunol,2009;182:3139-3145.
5 Riley JL.PD-1 signaling in primary T cells[J].Immunol Rev,2009;229:114-125.
6 Nishimura H,Nose M,Hiai Hetal.Development of lupus-like autoimmune diseasesby disruption of the PD-1 gene encoding an ITIM motifcarrying immunoreceptor[J].Immunity,1999;11:141-151.
7 Prokunina L,Padyukov L,BennetAetal.Association of thePD-1.3A allele of the PDCD1 gene in patientswith rheumatoid arthritis negative for rheumatoid factor and the shared epitope[J].Arthritis Rheum,2004;50:1770-1773.
8 Lin S C,Yen JH,Tsai J Jetal.Association of a programmed death 1 gene polymorphism with the development of rheumatoid arthritis,but not system ic lupuserythematosus[J].Arthritis Rheum,2004;50:770-775.
9 HatachiS,Iwai Y,Kawano Setal.CD4+PD-1+T cells accumulate as unique anergic cells in rheumatoid arthritis synovial fluid[J].JRheumatol,2003;30:1410-1419.
10 Wang G,Hu P,Yang Jetal.The effectsof PDL-Ig on collagen-induced arthritis[J].Rheumatol Int,2009;25:1249-1250.
11 Kim SH,Kim S,Evans C Hetal.Effective treatment of established murine collagen-induced arthritisby systemic administration of dendritic cells genetically modified to express IL-4[J].J Immunol,2001;166:3499-3505.
12 Arnett F C,Edworthy SM,Bloch DAetal.The American Rheumatism Association 1987 revised criteria for the classification of rheumatoid arthritis[J].A rthritis Rheum,1988;31:315-324.
[收稿2010-07-29 修回2010-08-10]
(編輯 許四平)
Expression and distribution of the co-inhibitory molecule PD-1 in tissues from rheumatoid arthritis
GUOGuo-Ning,SHANGYong-Jun,ZHUGuo-Yan,WENLiang,XIANGQiang.DepartmentofWest-SouthHospital,the3rdMilitaryMedicalUniversity,Chongqing400038,China
Objective:To detect PD-1 protein expression in immuneorgans from bovine collagenⅡ(CII)-inducedmouse rheumatoid arthritis(CIA)and synovial tissuesof RA patients.Methods:Theexpression and distributionof PD-1 antigen was analyzed by immunohistochemistry.Moreover,flow cytometry(FACs)was further used to characterize PD-1 expression.Results:Immunohistochemicalanalysis revealed that PD-1 positive cellswere found in thymus,spleen,lymph nodes and bonemarrow,and FACs further demonstrated that PD-1 positive cellswere CD3+T cells,B220+B cells,CD68+macrophages or CD11c+dendritic cells.However,the exp ression and distribution of PD-1 were not changed significantly between normaland CIAm ice.Interestingly,seldom PD-1 positive cellswere found both in synovial tissues of CIAm ice and in RA patients.Conclusion:PD-1 signalm ightnotbe involved in regu lating the pathogenesis of RA.
PD-1;Rheumatoid arthritis;Synovial tissues;Immuneorgans;Immunohistochemistry
R392.3
A
1000-484X(2010)12-1119-05
10.3969/j.issn.1000-484X.2010.12.014
郭國寧(1974年-),男,博士,主治醫師,主要從事免疫調節的基礎及臨床研究,E-mail:gotoguoguo@126.com。

