STK15的表達對NIH3T3細胞的影響
朱 焱,王祿增,楊 威,于 洋,王 維,董婉維,汪 瑛,秦 英,鄭志紅
(1.中國醫科大學實驗動物部,沈陽 110001;2.沈陽市公安醫院,沈陽 110001)
STK15基因是絲/蘇氨酸激酶家族成員之一[1]。STK15基因是一種與中心體結構及功能緊密相關的基因,并具有高水平的酪蛋白激酶活性[2]。STK15基因的擴增和過表達使中心體異常擴增,從而導致染色體的異常分配及不穩定,最終癌基因激活,導致腫瘤產生[3],所以STK15的過表達與腫瘤的發生存在一定的聯系。本實驗構建了pcDNA3.1-STK15質粒,并將其瞬時轉染NIH3T3,觀察STK15高表達對NIH3T3細胞的影響,以進一步闡明STK15基因在腫瘤發生發展中的作用。
1 材料和方法
1.1 實驗材料
脂質體轉染試劑、DMEM培養基、TR IZOL均購自Invitrogen。反轉錄試劑盒、回收試劑盒均購自Qiagen。限制性內切酶、TaqE、dNTP、連接試劑盒、小量質粒提取試劑盒均購自TaKaRa。小牛血清購自天津灝洋。兔抗人STK15多克隆抗體購自AbD Serotec。HRP標記的山羊抗兔的二抗購自中山公司。S-P試劑盒購自福州邁新生物技術公司。MTT購自華美公司。重組人基底膜購自BD公司。
1.2 實驗方法
1.2.1 構建質粒pcDNA3.1-STK15:提取人胚肺細胞總RNA,RT-PCR方法擴增STK15cDNA全長,克隆到pTZ57R/T載體,測序。BamH1和XbaI雙酶切pcDNA3.1和T-STK15連接產物,回收、連接、轉化、鑒定,構建pcDNA3.1-STK15質粒。
1.2.2 細胞轉染:將對數生長期細胞(PcDNA3.1、PcDNA3.1-STK15轉染NIH3T3細胞)接種于6孔板,轉染后培養48h。
1.2.3 RT-PCR:提取細胞RNA,RT-PCR試劑盒檢測STK15的表達,擴增片段的長度為498bp。
1.2.4 Western印跡分析:PBS洗2次,裂解液冰上孵育30min,12 000r/min,4℃離心30min,上清液即細胞蛋白。然后加樣、電泳、轉膜、封閉,加入1∶500的兔抗人的STK15多克隆抗體,室溫震蕩2h,洗膜3次,加入1∶2 000的山羊抗兔的二抗,室溫震蕩1h,洗膜3次,顯色。
1.2.5 免疫細胞化學:將轉染后的細胞傳代于有載玻片的六孔板中,次日取出玻片,固定30min。加過氧化物酶阻斷液,室溫下孵育10min,PBS洗3次。封閉,室溫下孵育10min,甩去血清。加一抗(兔抗人STK15抗體1:500稀釋)4℃、過夜,PBS洗3次。加生物素標記的第二抗體,室溫下孵育10min,PBS洗3次。加鏈霉素—過氧化物酶溶液(D),室溫下孵育10min,PBS洗3次。加DAB顯色,自來水沖洗,蘇木素復染30s,返藍,50%甘油封片。
1.2.6 MTT方法:每孔3 000個細胞(NIH3T3細胞、pcDNA3.1轉染的NIH3T3細胞、pcDNA3.1-STK15轉染的NIH3T3細胞)接種于96孔板,在24、48、72h加入MTT(終濃度5mg/mL),37℃、孵育4h,棄上清,加入DMSO 150μL,低速震蕩10min,分光光度計490nm讀取A值。每組設8個復孔,共重復3次。
1.2.7 Transwell小室法:人工基底膜膠冰浴過夜融化,用預冷的無血清的DMEM培養液1:5稀釋,吸取100μL包被于Trans well小室濾膜上,置5%CO2、37℃、培養24h。上室接種轉染的NIH3T3細胞(約2.5×104個細胞)100μL,下室加入10%FBS的DMEM 600μL作為趨化因子,置5%CO2、37℃、培養24h。取出Transwell小室,濾膜用多聚甲醛固定15min,蘇木素染核,200倍顯微鏡下計數上下左右中5個視野的侵襲細胞數,計算平均值。上述實驗重復3次。
2 結果
2.1 RT-PCR
轉染后48h,pcDNA3.1-STK15轉染組擴增出498bp目的基因片段,而pcDNA3.1轉染組未能擴增出片段(圖1)。
2.2 STK15的蛋白表達
與轉染空載體組相比,STK15轉染組在48h后可檢測到STK15蛋白表達的上調。(圖2)
2.3 免疫細胞化學
藍色為蘇木素染色的細胞核,棕紅色為DAB標記的STK15蛋白表達陽性區,表明STK15質粒轉染組(圖3.3)大部分STK15蛋白表達陽性,pcDNA3.1轉染組(圖3.2)和普通NIH3T3細胞(3.1)中,沒有STK15蛋白表達(圖3見彩插2)。
2.4 MTT檢測
轉染STK15質粒的NIH3T3細胞的生長增殖在48、72h顯著高于對照組(P<0.05)。(圖4)
2.5 Transwell結果
用平均穿膜細胞數標化成相對數后進行統計作圖(圖5)。STK15轉染組的細胞穿膜細胞數為258.45±4.95,而NIH3T3細胞和pcDNA3.1轉染組的細胞分別為20.50±4.65和21.00±5.56,,差異均有統計學意義(t分別 =276.00、38.47,P<0.05)。
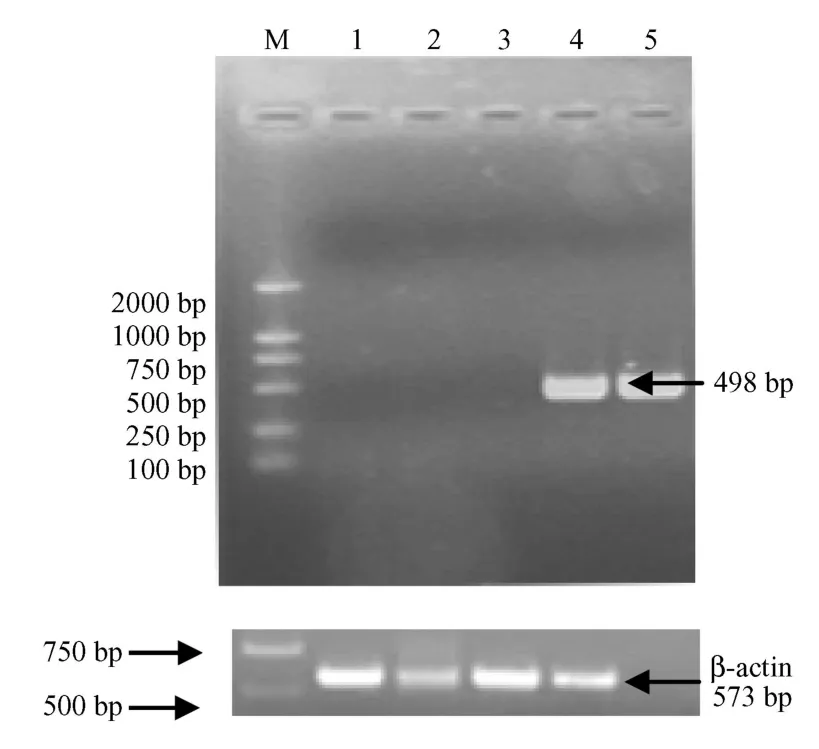
M:DL2000;1:陰性對照;2:N IH3T3細胞中STK15mRNA的表達;3:pcDNA3.1轉染組STK15mRNA的表達;4:pcDNA3.1-STK15轉染組 STK15mRNA的表達;5:陽性對照。圖1 STK15mRNA在轉染NIH3T3細胞中的表達M:DNA markerDL2000;1:Negative control;2:Product of STK15 in NIH3T3 cells;3:Product of STK15 transfected by pcDNA3.1;4:Product of STK15 in the cells transfected by pcDNA3.1-STK15;5:Positive control.Fig.1 Expression of STK15 mRNA in the pcDNA3.1-STK15-transfectN IH3T3 cells

1:NIH3T3細胞STK15蛋白的表達;2:pcDNA3.1轉染組STK15蛋白的表達;3:pcDNA3.1-STK15轉染組STK15蛋白的表達圖2 Western blot檢測STK15蛋白表達1:Product of STK15 of N IH3T3 cells;2:Product of STK15 of cells transfected by pcDNA3.1;3:Product of STK15 of cells transfected by pcDNA3.1-STK15;1:Product ofβ-actin ofN IH3T3 cells;2:Product ofβ-actin of cells transfected by pcDNA3.1;3:Product oβf-actin of cells transfected by pcDNA3.1-STK15Fig.2 The results of STK15 protein expression assayed byWestern blot
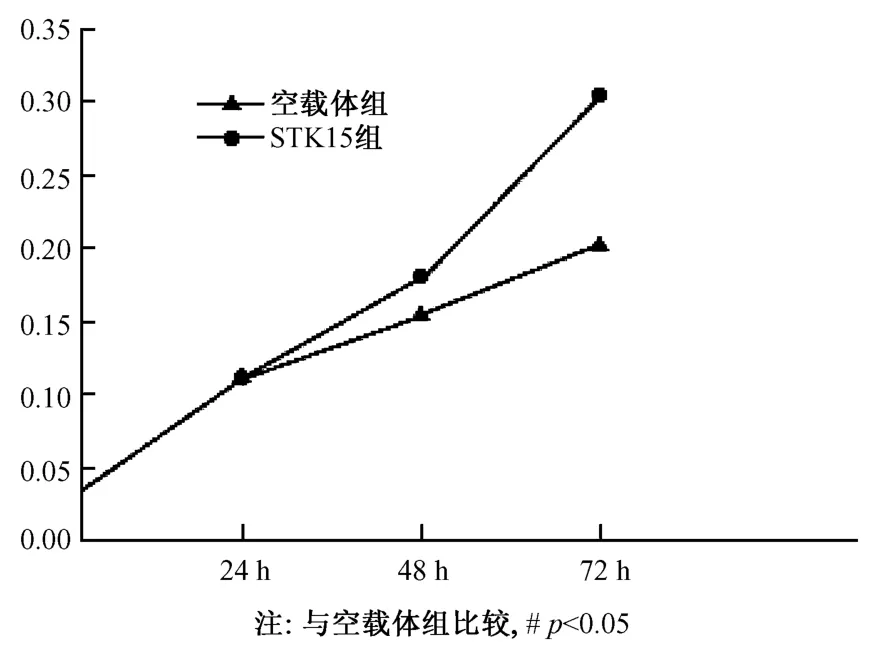
圖4 兩組細胞不同時間點的MTT檢測情況Fig.4 MTT test results of the cells from two groups measured at different times
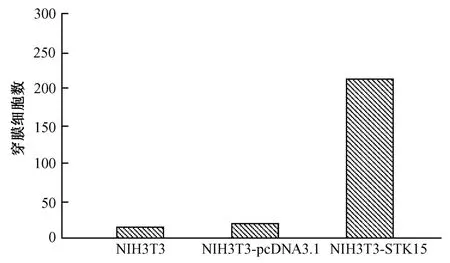
圖5 體外跨室趨化運動實驗中,質粒pcDNA3.1-STK15轉染組與pcDNA3.1轉染組及NI H3T3細胞比較Fig.5 Comparason of the results of Transwell test of the pcDNA3.1plas mid-transfected cellsandpcDNA3.1-STK15 plasmid transfected cells,and N I H3T3 cells.
3 討論
近年來腫瘤研究發現,腫瘤與基因異常密切相關。STK15基因是有絲分裂器的基本調控蛋白,在中心體調節、紡錘體形成、染色體分離、胞質分裂,即有絲分裂的正常進行中發揮至關重要的作用。它的過表達可引起中心體擴增,染色體不穩定,非整倍體的形成而導致腫瘤的發生[4]。
本實驗表明,體外轉染pcDNA3.1-STK15質粒可以有效地使STK15在NIH3T3細胞中高表達,說明細胞轉染成功,MTT結果表明轉染pcDNA3.1-STK15質粒組的細胞增殖速率明顯高于對照組(p<0.05)說明STK15基因可以使細胞的生長速度加快,進而形成細胞的惡性增殖,誘發腫瘤;Katayama等[5]發現抑制STK15的表達可致細胞分裂停滯于G2/M交界點附近,認為STK15可磷酸化p53蛋白,促進了Mdm2介導的p53蛋白泛素化及降解,減弱了p53介導的細胞有絲分裂監視點機制,促進細胞周期進程,使細胞的生長增殖加快;還有人發現在細胞G2/M轉換與STK15磷酸化另一下游抑癌基因產物-BRCA1蛋白有關,認為對細胞G2/M轉換同樣是必需的[6];以上結論最終說明STK15基因的過表達使細胞增殖速度加快。
本實驗采用Trans well小室檢測STK15對細胞體外侵襲力的影響,癌細胞要穿透人工基底膜和直徑只有8μm的聚碳酸酯微孔濾膜,需要降解Matrigel成分。而且穿透Matrigel膜涉及細胞的粘附、基質降解和移動3個過程,這與在人體內的浸潤繼而轉移過程完全相似。實驗結果表明,轉染pcDNA3.1-STK15質粒組的細胞穿透Matrigel基底膜的細胞數明顯高于對照組(P<0.05),而且質粒轉染組表現出比對照組高20倍以上的跨膜運動能力,充分表現出了STK15的高表達可以提高NIH3T3細胞的轉化能力和腫瘤化能力。綜合以上兩點,我們認為將STK15基因轉染NIH3T3細胞提高了NIH3T3細胞的增殖速度和體外侵襲能力,這可能是形成腫瘤發病機制之一。
鑒于STK15基因與惡性腫瘤的關系如此密切,不少研究者已經將STK15基因作為研制抗腫瘤新藥的靶子。各種能抑制STK15基因的擴增、表達及其生物學活性的物質已成為大家研究的焦點。Tong等[7]人將特異性抑制STK15基因表達的外源性siRNA體外瞬時轉染人的食管癌細胞系,結果發現,在轉染后48h和72h轉染siRNA的人食管癌細胞的侵襲能力明顯低于未轉染的人食管癌細胞的侵襲能力。Hamada等[8]用STK15基因和STK15反義基因轉染B細胞淋巴瘤細胞系,發現STK15反義基因轉染的細胞系增殖率更低,并且停頓于G1期的細胞明顯增多,此外抑制細胞增殖的程度與反義寡核苷酸的濃度成正比。隨著研究的深入,STK15基因必將為惡性腫瘤的治療提供新的有效手段,對今后癌癥的早期診斷和早期治療均具有重要的臨床意義。
[1]ReichardtW,Jung V,Brunner C,et al.The putative serine/threoninekinasegeneSTK15onchromosome 20q13.2 is amplified in human gliomas[J].Oncol Rep,2003,10:1275-1279.
[2]Jeng Y M,Peng SY,Lin CY,et al.Overexpression and amplification of Aurora-A in hepatocellular carcinoma.[J].Clin Cancer Res,2004;15,10(6):2065-2071.
[3]Miyoshi Y,Iwao K,Egawa C,et al.Association of centrosomal kinaseSTK15/BTAK mRNA expressionwith chromosomal instability in human breast cancers[J].Int J Cancer,2001,92:370-373.
[4]葉燕,李福才,王淑云.喉癌中STK15基因擴增及表達的研究[J].中華醫學遺傳學雜志,2006,23(3):326-329.
[5]Katayama H,Sasai K,Kawai H,et al.Phosphorylation by aurora kinase A induces Mdm22mediated destabilization and inhibition of p53.Nat Genet,2004,36:55-262.
[6]Hannak E,Kirkham M,Hyman A,et al.Aurora A kinase is required for centrosome maturation in Caenorhabditis elegans[J].J CellBiol,2001,155:1109-21116.
[7]Tong T,Zhong Y,Kong J,et al.Overexpression of aurora-A contributes to malignant development of human esophageal squamous cell carcinoma[J]Clin Cancer Res,2004,10(21):7304-7310.
[8]Hamada M,Yakushijin Y,Ohisuka M,et al.Aurora/BTAK/STK15 is involved in cell cycle check point and cell survival of aggressive non-Hodgkin lymphoma[J].Br J Haematol,2003,121(3):439-447.

