魷魚肝臟蛋白水解液及ACE抑制肽的制備
謝 超,林 琳,裘曉華,林婭萍
(浙江海洋學院食品與藥學學院,浙江 舟山 316000)
魷魚肝臟蛋白水解液及ACE抑制肽的制備
謝 超,林 琳,裘曉華,林婭萍
(浙江海洋學院食品與藥學學院,浙江 舟山 316000)
為高效利用魷魚及其下腳料肝臟蛋白水解物,采用酶解技術和凝膠過濾分離等技術對魷魚肝臟蛋白水解液中抑制肽進行研究。結果表明:胃蛋白酶為魷魚肝臟蛋白水解的最佳酶類,同時以水解度和ACE抑制活性為指標,得出胃蛋白酶水解的最佳條件:在36℃條件下酶解22h,酶與底物的質量比2%,底物質量分數2.5%。經過上述條件處理的水解液再經超濾處理(截留分子質量為20kD)后,用Sephadex G-50進行分離,洗脫得到5個峰,其中組分B的ACE抑制活性最高,其半抑制濃度(IC50)達到1.80mg/mL。
魷魚肝臟蛋白;酶解液;ACE抑制肽
魷魚加工過程中有約占魷魚體質量30%的頭、足、肝臟及表皮等廢棄物產生。對于這些廢棄物,一般的處理方法是加工魚粉,或者掩埋,這不但是對漁業資源的巨大浪費,而且還存在著環境污染的問題[1-3]。在國外,如西班牙和日本對于魷魚肝臟的利用采用自身酶解發酵法生產魷溶漿、魷魚粉等作為魚類飼料。在國內魷魚肝臟的利用和研究還有比較大的發展空間,目前僅有魷魚肝臟干粉的加工,并且是用作飼料,技術水平不高[4-5]。
目前,已有從魷魚皮制備膠原蛋白活性肽,產品具有很強的生物活性,可用于制備抗氧化、降血壓、抗動脈粥樣硬化的保健食品或藥品,但均是從魷魚皮中提出來的。通常ACE抑制肽的生產方法有以下幾種:一是從生物體中分離各類天然ACE抑制肽;二是通過酶制劑水解蛋白質獲得;三是利用分子生物技術合成抑制肽。當前水解蛋白質生成ACE抑制肽因其安全性高、水解過程容易受控制、并且水解條件比較溫和等特點,被廣泛應用在ACE抑制肽的生產中[6-7]。同時水解酶類是酶解法生產抑制肽的關鍵環節,目前廣泛使用的蛋白酶類有堿性蛋白酶、木瓜蛋白酶、胃蛋白酶、胰蛋白酶等。本研究的目的是從廢棄的魷魚肝臟中提取蛋白質和生物活性肽——ACE(血管緊張素轉換酶)抑制肽,制備消化吸收效率更高的蛋白質水解產物,而且制備的生物活性肽還可應用于疾病的防治,用于食品與醫藥行業,為維護人類的健康作貢獻[8-14]。
1 材料與方法
1.1 材料、試劑與儀器
冷凍秘魯魷魚(解凍后取其肝臟,-18℃冷凍保存)市購。胃蛋白酶(1000IU/g)、中性蛋白酶(100000IU/g)、木瓜蛋白酶(1000000IU/g)、風味蛋白酶(1000IU/g)、復合蛋白酶(10000IU/g)、胰蛋白酶(2000IU/g) 廣西南寧龐博生物有限公司。CF16RX高速冷凍離心機、U-2800紫外檢測儀、AL104分析天平、LC600反相高效液相色譜儀 日本日立公司、Labscale TFF超濾裝置 美國伯樂公司。
1.2 魷魚肝臟蛋白的制備
將適量魷魚冷凍肝臟按照質量比1:2加水,充入氮氣10min,并加入0.1%的L-抗壞血酸-6-棕櫚酸酯防止其氧化,再將其放入高壓鍋中(121℃,0.2MPa)加熱20min,然后在6000r/min條件下離心25min左右,去掉最上層的魚油層。用丙酮洗滌,真空干燥后既得脫脂魷魚肝臟蛋白。
1.3ACE抑制活性的測定
ACE抑制活性的測定借鑒Cushman等的方法[15]。首先用含608mmol/L NaCl的0.2mol/L硼酸鹽緩沖液(pH8.3)將底物Hip-His-Leu配成7.6mmol/L的溶液。然后在0.5mL的Eppendof管中分別加入5μL樣品或硼酸緩沖液和15μL ACE(60mU/mL)在37℃靜置5min,再加入25μL底物反應25min,最后加入5μL 0.1%三氟乙酸(TFA)溶液,終止反應后自然冷卻。最后應用反相高效液相色譜測定ACE與底物反應生成馬尿酸的量,以此判斷對ACE的抑制活性。ACE活性抑制50%時所需要的抑制劑的濃度稱為IC50。

1.4 魷魚肝臟蛋白的水解
1.4.1 蛋白水解液標準曲線
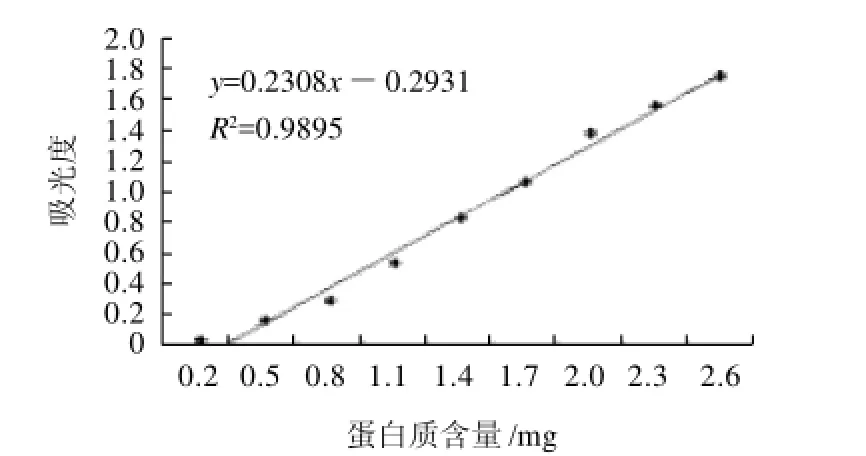
圖1 蛋白水解液標準曲線Fig.1 Standard curve of protein
取完全酶解液0.2~2mL于比色管中,用蒸餾水稀釋至4mL,加pH8的磷酸鹽緩沖液1mL,茚三酮溶液1mL,沸水浴加熱15min,冷卻,用蒸餾水稀釋至25mL。360nm波長處測吸光度。以蒸餾水為參比,另取25mg蛋白質,加水25mL,振蕩均勻后過濾,取相應體積的濾液,按上述方法測吸光度,其與相同體積樣品的吸光度之差對蛋白質含量做工作曲線,見圖1。由圖1可以看出,蛋白質含量與吸光度呈線性關系,線性方程為y=0.2308x-0.2931,相關性R2=0.9895。
1.4.2 魷魚肝臟蛋白酶解液水解度的測定
首先取水解后滅酶的水解液1mL,用蒸餾水稀釋至100mL,經過濾,取濾液2.5mL,再加水至4mL,加pH8緩沖溶液1mL,茚三酮1mL,以沸水浴加熱15min,冷卻后再用蒸餾水稀釋至25mL,用以于280nm波長處測吸光度。
以蒸餾水做對比,取相同濃度未水解蛋白溶液2mL,按以上方法測吸光度,以二者吸光度之差從工作曲線上查蛋白質含量,計算水解度(DH):

式中:A為查表得蛋白質質量/mg;m為稱樣質量/g;V1為水解液總體積/mL;V2為顯色時所用稀釋液體積/mL。
1.4.3 魷魚肝臟蛋白酶制劑的篩選
用胃蛋白酶、木瓜蛋白酶、復合蛋白酶、胰蛋白酶、中性蛋白酶、風味蛋白酶進行酶解比較。在相同的魷魚肝臟蛋白溶液中加入2%的各種蛋白酶制劑,維持恒溫,在各種酶最適合的pH值條件下水解22h。酶解后將溶液pH值調為中性,離心過濾,上清液即為魷魚肝臟蛋白酶解液。測定酶解液的ACE抑制活性,根據抑制ACE活性的來確定所用蛋白酶制劑。
1.4.4 胃蛋白酶酶解條件的優化研究
1.4.4.1 酶與底物質量比的優化
在溫度37℃、pH2.0、底物質量分數2.5%、酶與底物的質量比分別為0%、0.5%、1.0%、2%、5%條件下水解22h,測定酶解液的水解度和對ACE的抑制活性。
1.4.4.2 底物質量分數的優化
在溫度36℃、pH2.0、酶與底物質量比2%、底物質量分數分別在1%、2.5%、5.0%、7.5%、10%條件下水解22h,測定酶解液的水解度和對ACE的抑制活性。
1.4.4.3 酶解時間的優化
在溫度36℃、pH2.0、以酶與底物質量比2%、底物質量分數2.5%的條件下,處理時間分別為2、7、12、17、22、27、32h,測定酶解液的水解度和對ACE的抑制活性。
1.5 魷魚肝臟蛋白酶解液的制備
將脫脂肝臟蛋白,按照體積比1:2的比例加入去離子水,用胃蛋白酶酶解22h,條件為溫度36℃、pH2.0、底物質量分數2%。隨后在90℃條件保持20min終止酶解,冷卻后以超濾膜過濾除去分子質量高于20kD的產物。收集水解產物,以4℃條件保存待用。
1.6 ACE抑制肽的分離及其ACE抑制活性分析
1.6.1 魷魚肝臟蛋白酶解液的超濾處理
超濾裝置連接好后,用恒流泵將魷魚肝臟蛋白的酶解液在室溫下壓入截留分子質量20kD的濾膜,收集小分子濾液。截留液用蒸餾水適當稀釋后繼續超濾,將合并收集的超濾液進行冷凍干燥待用。
1.6.2 用Sephadex G-50分離ACE抑制肽
取超濾后凍干樣品溶解,用Sephadex G-50分離ACE抑制肽,并測定各肽的ACE的抑制活性。將適量超濾凍干樣品配成溶液,用Sephadex G-50凝膠柱對其進行分離,再用蒸餾水進行洗脫,流速24滴/min,在波長280nm處測定各肽的ACE的抑制活性。
2 結果與分析
2.1 魷魚肝臟脫脂蛋白的制備結果
將魷魚肝臟中的魚油分離后,魷魚肝臟蛋白中還含有一定量的脂肪。脂肪的存在會對產品的色澤、風味產生不良影響,且易造成水解液渾濁。為了消除這些不良影響,實驗采取丙酮浸提法。經過丙酮浸提3~5次后,得到脫脂后的魷魚肝臟蛋白。計算得率約為18%。
2.2 蛋白酶制劑的篩選
將各種蛋白酶處理魷魚肝臟蛋白。檢測各種酶制劑所得酶解產物的ACE抑制活性,結果見表1。

表1 各種酶解液的ACE抑制活性Table 1 Effect of protease type on the ACE inhibitory activity of the hydrolysate
從表1可以看出,用胃蛋白酶、復合蛋白酶和中性蛋白酶酶解后的溶液ACE抑制活性較高。通過測定這3種酶解液的水解度,分別為胃蛋白酶酶解液24.6%、復合蛋白酶酶解液20.8%、中性蛋白酶酶解液22.2%。根據ACE抑制活性和水解度的大小,選擇酶解液水解度最高、ACE抑制活性較高的胃蛋白酶作為生產酶制劑。
2.3 胃蛋白酶酶解魷魚肝臟蛋白的優化
2.3.1 底物質量分數對蛋白酶解效果的影響

圖2 底物質量分數對水解度和ACE抑制活性的影響Fig.2 Effect of substrate concentration on the degree of hydrolysis and ACE inhibitory activity of the hydrolysate
當胃蛋白酶底物質量分數在1%~2.5%時,其值增加有利于反應速度的升高,導致水解度的上升(圖2)。但當底物質量分數在2.5%~10%時,伴隨著底物質量分數的升高,蛋白水解度反而呈下降的趨勢。可能是由于底物質量分數較大時,在不斷受熱情況下,蛋白質分子產生交聯聚合現象。導致蛋白酶分子與底物蛋白分子之間的接觸機會減少,影響酶解反應的速度,從而導致水解度下降。同時,實驗結果表明:底物質量分數的變化對抑制ACE活性的影響變化不大,因此,通過綜合考慮選用2.5%為蛋白水酶解反應的底物質量分數。
2.3.2 反應時間對蛋白酶解效果的影響
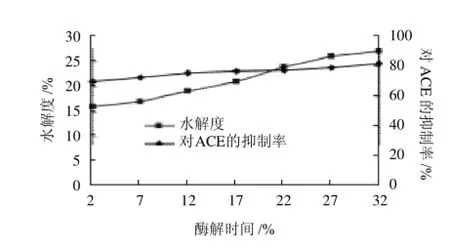
圖3 酶解時間對水解度和ACE抑制活性的影響Fig.3 Effect of hydrolysis duration on the degree of hydrolysis and ACE inhibitory activity of the hydrolysate
由圖3可以看出,當反應時間在2~22h時,蛋白水解度隨著時間的延長而顯著增加,但在22h后,蛋白水解度隨反應時間的延長變化細微。同時,通過研究發現,反應時間的延長對抑制ACE活性的影響變化不大,綜合考慮上述兩個因素確定選用酶解時間為22h。
2.3.3 酶與底物質量比對反應效果的影響
當酶與底物質量比在0~2%時,蛋白水解液的水解度呈上升趨勢,由圖4可以看出,當蛋白酶加入量較低時,水解度增長速度較快。當酶與底物質量比達2%~5%時,水解度變化不是很明顯,由于酶加入量較高
時,它與蛋白質分子肽鏈的接觸機率就越多,導致底物轉化為產物肽的可能性增加。同時,通過實驗得出,酶與底物比的變化對抑制ACE活性的影響變化也不大,綜合考慮各方面的因素,研究選用2%作為酶與底物的質量比。
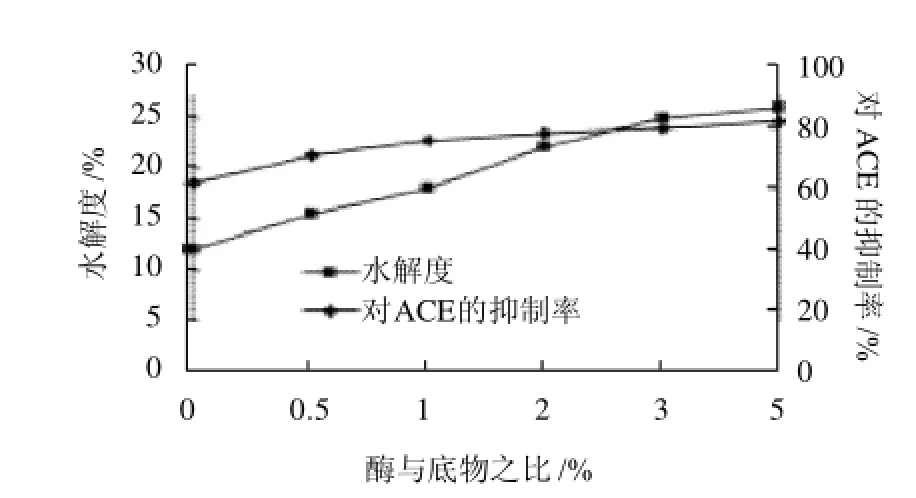
圖4 酶與底物比對水解度和ACE抑制活性的影響Fig.4 Effect of enzyme/substrate ratio on the degree of hydrolysis and ACE inhibitory activity of the hydrolysate
2.4ACE抑制肽的初步分離
采用凝膠過濾法分離魷魚肝臟蛋白酶解的產物。本實驗使用葡聚糖凝膠。葡聚糖凝膠是由一定平均分子質量的葡聚糖(右旋糖)和甘油基以醚橋(—O—CH2—CH—CH2—O)形式相互交聯形成的三維空洞網狀結構。通過控制交聯劑環氧氯丙烷和葡聚糖的配比以及交聯時的反應條件可控制交聯度而獲得具有不同網眼的凝膠,網眼的大小決定了被分離物質能夠自由出入凝膠內部的分子量范圍。
Sephadex G-50的分離范圍是3~10kD。用Sephadex G-50初步分離魷魚肝臟蛋白酶解液,用30%的甲醇作為洗脫液,以24滴/min的恒速進行洗脫,在洗脫過程中,大分子不能進入凝膠內部而沿著凝膠顆粒間的空隙最先流出柱外,從而使樣品中分子大小不同的物質得到分離。實驗中,有5個峰被檢測到,如圖5所示峰值A、B、C、D、E。對每個峰分別收集、真空濃縮、冷凍干燥后測定其ACE抑制活性。
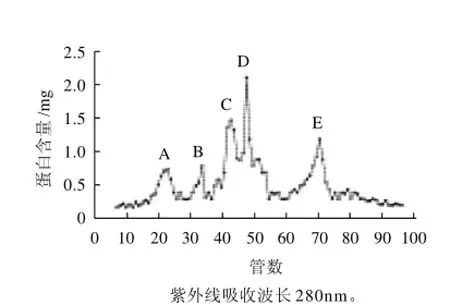
圖5 酶解液在Sephadex G-50上的洗脫圖Fig.5 Sephadex G-50 fractionation of the target hydrolysate

表2 Sephadex G-50初步分離各片斷ACE抑制活性和回收率Table 2 IC50values and recoveries of Sephadex G-50 fractions of the target hydrolysate
如表2所示,第A、B、C區洗脫下來的蛋白具有ACE抑制活性,其IC50分別為2.26、1.80、5.08mg/mL。結果表明分子質量較大的多肽具有較好的ACE抑制活性。
3 結 論
3.1 胃蛋白酶為魷魚肝臟蛋白水解的最佳酶類,其水解的最優條件為在36℃酶解22h、酶與底物的質量比2%、底物質量分數2.5%,此時酶解效果最好。3.2經過上述條件處理后的水解液經超濾處理(截留分子質量為20kD)后,用Sephadex G-50進行分離,洗脫得到5個峰,檢測各峰值的抑制活性,其中組分B的ACE抑制活性最高,其半抑制濃度(IC50)達到1.80mg/mL。
[1]袁亞輝, 姚美君. 利用魷魚內臟生產海味素的研究[J]. 漁業現代化, 2002(1): 28-29.
[2]FAO. Fishery statistics: capture production[M]. Food and Agriculture Organization of UN, 1998: 46-49.
[3]陳意. 魷魚的營養及食用價值[J]. 食品與藥品, 2006, 8(6): 75-76.
[4]趙紅偉. 魷魚肝臟的綜合利用: 魷魚肝臟在蝦飼料中的應用研究[D].大連: 大連水產學院, 2003.
[5]秦玉青, 劉承初, 王慥. 魷魚皮膠原蛋白的測定與回收[J]. 上海水產大學學報, 2002, 11(2): 138-144.
[6]陳修, 陳維洲, 曾貴云. 心血管藥理學[M]. 3版. 北京: 人民衛生出版社, 2003: 346-348.
[7]GOMEZ-RUIZ J A, RAMOS M, RECIO I. Identification and formation of angiotensin-converting enzyme-inhibitory peptides in Manchego cheese by high-performance liquid chromatography tandem masss pectrometry [J]. Journal of Chromatography A, 2004, 1054: 269-277.
[8]MORIMURA S, NEGATE H, UEMURA Y, et a1. Development of an effective process for utilization of collagen from livestock and fish waste [J]. Process Biochemistry, 2002, 37: 1403-1412.
[9]程云輝, 文新華. 生物活性肽制備的研究進展[J]. 食品與機械, 2001 (4): 4-7.
[10]吳建平, 丁霄霖. 食品蛋白質降血壓肽的研究進展[J]. 中國糧油學報, 1998, 13(5): 10-14.
[11]陳吉球. 血管緊張素轉換酶[J]. 桂林醫學院學報, 1997, 10(1): 131-134.
[12]趙海珍. 天然食品來源的血管緊張素轉換酶抑制肽的研究進展[J]. 中國生化藥物雜志, 2004, 25(5): 315-317.
[13]何海倫, 陳秀蘭, 孫彩云, 等. 血管緊張素轉化酶抑制肽的研究進展[J]. 中國生物工程雜志, 2004, 24(9): 7-11.
[14]范俊峰, 李里特, 張艷艷, 等. 2種蛋白酶的大豆蛋白水解物對血管緊張素轉換酶的抑制作用[J]. 食品與發酵工業, 2004, 30(1): 80-84.
[15]CUSHMAN D W, CHEUNG H S. Spectrophotometric assay and properties of the angiotennsin I converting enzyme of rabbit lung[J]. Biochemical Pharmacology, 1971, 20: 1637-1648.
Preparation and Separation of ACE Inhibitory Peptides from Hydrolyzed Squid Liver Protein
XIE Chao,LIN Lin,QIU Xiao-hua,LIN Ya-ping
(College of Food and Pharmacology, Zhejiang Ocean University, Zhoushan 316000, China)
Squid liver as a byproduct of squid processing was processed into protein. The protein was enzymatically hydrolyzed and ACE inhibitory peptides were obtained from the hydrolysate after ultrafiltration and Sephadex G-50 fractionation. Pepsin was found optimal for the hydrolysis of squid liver protein. The optimal pepsin hydrolysis conditions for both higher degree of hydrolysis and ACE inhibitory ratio were as follows: substrate concentration 2.5%; enzyme/substrate ratio 2%; and temperature 36 ℃ for a hydrolysis duration of 22 h. The smaller molecular weight fractions after ultrafiltration through a membrane with 20 kD molecular weight cutoff (MWCO) were fractionized on Sephadex G-50 column, resulting in five elution peaks. Among them, fraction (peak) B presented the highest ACE inhibitory activity, with an IC50of 1.80 mg/mL.
squid liver protein;hydrolysate;ACE inhibitory peptides
R151.1
A
1002-6630(2010)18-0139-04
2010-06-23
浙江省重大科技專項(2009C12025);浙江省公益基金項目(2009C22023);2009年舟山市重大項目(092033)
謝超(1975—),男,講師,碩士,研究方向為水產品加工。E-mail:xc750205@163.com

