石榴花色苷的微波輔助提取及抗氧化活性研究
李巨秀,王仕鈺,房紅娟,張小寧
(西北農(nóng)林科技大學(xué)食品科學(xué)與工程學(xué)院,陜西 楊凌 712100)
石榴花色苷的微波輔助提取及抗氧化活性研究
李巨秀,王仕鈺,房紅娟,張小寧
(西北農(nóng)林科技大學(xué)食品科學(xué)與工程學(xué)院,陜西 楊凌 712100)
以陜西臨潼甜石榴為試驗(yàn)材料,通過(guò)正交試驗(yàn),采用pH差示法測(cè)定石榴總花色苷含量,優(yōu)化微波輔助提取石榴花色苷的工藝參數(shù)。同時(shí),采用DPPH法、FRAP法、ABTS法、螯合亞鐵能力法分析石榴花色苷的體外抗氧化活性。結(jié)果表明:微波輔助提取石榴花色苷的最佳工藝參數(shù)為溶劑pH1、料液比1:13(g/mL)、提取時(shí)間210s、乙醇體積分?jǐn)?shù)70%、微波輸出功率360W。此條件下,花色苷得率為184.81μg/g。微波輸出功率對(duì)石榴汁花色苷的提取得率有顯著影響(P<0.05)。石榴花色苷含量與DPPH自由基清除率、鐵還原力、ABTS+自由基清除率和螯合亞鐵離子有顯著的相關(guān)性(相關(guān)系數(shù)R2分別為0.9928、0.9925、0.9913、0.9945),呈明顯的量效關(guān)系,IC50值分別為2.44、1.14、4.08、101.05mg/L。
微波輔助提取;石榴;花色苷;抗氧化活性
石榴是石榴科石榴屬(Punica granatum L.)石榴的果實(shí),原產(chǎn)于以伊朗為主的中亞國(guó)家[1-3]。我國(guó)主要產(chǎn)區(qū)為山東、安徽、陜西、河南、云南和新疆[4]。近幾年,石榴的消費(fèi)量逐年增長(zhǎng),主要原因是石榴中含有豐富的保健功能成分,其組分主要是以花色苷、單寧、鞣花酸為主的多酚類(lèi)化合物[5-7]。已有研究表明,石榴具有抗癌、抗動(dòng)脈粥樣硬化、消炎、抗氧化等功能,在食品、醫(yī)藥領(lǐng)域具有廣泛的應(yīng)用前景等[8-11]。Richard等[12]的研究結(jié)果還表明石榴汁對(duì)老年性癡呆癥具有一定的治療作用,而B(niǎo)ianca等[13]認(rèn)為石榴汁能抑制泡沫細(xì)胞的形成和動(dòng)脈粥樣硬化斑塊的形成,降低細(xì)胞中低密度脂蛋白的氧化和膽固醇的合成。石榴中花色苷主要組分是矢車(chē)菊糖苷、飛燕草糖苷和天竺葵糖苷[7]。本研究利用微波輔助技術(shù),分析乙醇體積分?jǐn)?shù)、pH值、料液比、微波功率、提取時(shí)間對(duì)花色苷提取得率的影響,優(yōu)化出石榴花色苷提取的適宜工藝參數(shù),并采用4種方法分析石榴花色苷的抗氧化活性,為石榴保健功能的評(píng)價(jià)和產(chǎn)品的開(kāi)發(fā)提供科學(xué)依據(jù)。
1 材料與方法
1.1 材料與試劑
石榴:市售陜西臨潼出產(chǎn)的甜石榴,挑選表皮干凈無(wú)傷的石榴儲(chǔ)藏于0℃冷庫(kù)中備用。
試劑:無(wú)水乙醇、鹽酸、氯化鉀、硼酸、無(wú)水乙酸鈉、冰醋酸等(所有試劑均為分析純);TPTZ(2.4.6-Tri(2-pyridyl)- s-triazine) 美國(guó)Sigma Aldrich Fluka公司;Trolox(水溶性VE) 美國(guó)Cayman化學(xué)試劑公司;ABTS [2,2'-聯(lián)氮-雙(3-乙基苯并噻吡咯啉-6-磺酸)]、啡咯嗪[5,6-聯(lián)苯基-3-(2-吡啶基)-1,2,4-三吖嗪,99%]、DPPH· (二苯代苦味酰基自由基,1,1-dipheny,1-2-picrylhydrazyl)美國(guó)Sigma公司;EDTA標(biāo)品(乙二胺四乙酸二鈉鹽) 西安化學(xué)制劑廠。
1.2 儀器與設(shè)備
WD900B格蘭仕微波爐(實(shí)驗(yàn)裝置是在普通微波爐基礎(chǔ)上改裝而成,具體裝置見(jiàn)圖1) 順德市格蘭仕電器實(shí)業(yè)有限公司;UV-1700紫外分光光度計(jì) 日本島津公司;SC-3610低速離心機(jī) 安徽中科中佳科學(xué)儀器有限公司;PHS-3C型pH計(jì) 上海雷磁儀器廠;RE-201D旋轉(zhuǎn)蒸發(fā)儀 鞏義市予華儀器有限責(zé)任公司;AG135分析天平 瑞士梅特勒-托利多公司。

圖1 微波輔助提取石榴花色苷裝置圖Fig.1 Schematic diagram for the microwave-assisted extraction of anthocyanins from sweet pomegranate fruits
1.3 方法
1.3.1 微波輔助提取石榴花色苷的優(yōu)化試驗(yàn)
在單因素試驗(yàn)基礎(chǔ)上,選用L16(45)正交試驗(yàn)設(shè)計(jì)表,以溶劑pH值(A)、料液比(B)、提取時(shí)間(C)、乙醇體積分?jǐn)?shù)(D)、提取功率(E)為影響因素,以花色苷含量為評(píng)價(jià)指標(biāo),優(yōu)化提取的各項(xiàng)工藝參數(shù),以篩選出最佳的提取工藝條件和工藝參數(shù)。因素水平安排如表1所示。所有組合進(jìn)行兩次平行試驗(yàn)。

表1 因素水平表Table 1 Factors and levels in the orthogonal array design
1.3.2 石榴花色苷的抗氧化活性分析
1.3.2.1 石榴花色苷清除DPPH自由基效果
參照文獻(xiàn)[14],略作改動(dòng)。
(1) Trolox標(biāo)準(zhǔn)曲線的制作
準(zhǔn)確稱(chēng)取Trolox 5.006mg,室溫放置30min,蒸餾水溶解后,定容至100mL,得到濃度為200μmol/L Trolox標(biāo)準(zhǔn)貯備液,用蒸餾水稀釋成20~160μmol/L的標(biāo)準(zhǔn)溶液,分別取1mL標(biāo)準(zhǔn)溶液與4.5mL 100μmol/L的DPPH甲醇溶液(準(zhǔn)確稱(chēng)取7.856mg DPPH,用甲醇定容至200mL)充分混合,在室溫下放置30min,于517nm波長(zhǎng)處測(cè)吸光度(A試驗(yàn))。對(duì)照組用4.5mL無(wú)水甲醇代替DPPH溶液(A對(duì)照),空白組為1mL蒸餾水代替樣品(A空白),各組平行3次測(cè)定,按式(1)計(jì)算Trolox對(duì)DPPH自由基清除率。

以Trolox濃度為橫坐標(biāo)、清除率為縱坐標(biāo),繪制標(biāo)準(zhǔn)曲線,其回歸方程為y=0.4188x-0.6915(R2=0.9942)。
(2) 樣品測(cè)定
取適量經(jīng)旋轉(zhuǎn)蒸發(fā)濃縮的石榴花色苷提取物,稀釋不同倍數(shù),按照標(biāo)準(zhǔn)曲線制作方法測(cè)定樣品清除DPPH自由基的清除率,計(jì)算其IC50值。
1.3.2.2 石榴花色苷的鐵還原力[15]
(1) 標(biāo)準(zhǔn)曲線的制作
用蒸餾水將200μmol/L Trolox標(biāo)準(zhǔn)溶液分別稀釋成20~160μmol/L的系列標(biāo)準(zhǔn)溶液,分別取1mL Trolox標(biāo)準(zhǔn)系列溶液與4.5mL TPTZ工作液(由30mmol/L乙酸鈉-乙酸緩沖液、10mmol/L TPTZ溶液、20mmol/L FeCl3溶液按體積比為10:1:1混合配制而得;10mmol/L TPTZ溶液:準(zhǔn)確稱(chēng)取TPTZ 0.3123g,用40mmol/L HCl溶液溶解并定容到100mL)充分混合,室溫下放置30min,于593nm波長(zhǎng)處測(cè)吸光度(A試驗(yàn))。對(duì)照組以4.5mL蒸餾水代替TPTZ工作液(A對(duì)照),空白組以1mL蒸餾水代替樣品液(A空白),各組平行3次。按式(2)計(jì)算Trolox的鐵還原力。

以Trolox濃度為橫坐標(biāo)、鐵還原力為縱坐標(biāo),繪制標(biāo)準(zhǔn)曲線,得到回歸方程為y=0.0074x+0.0111,相關(guān)
系數(shù)R2=0.9977。
(2) 樣品的測(cè)定
將旋轉(zhuǎn)蒸發(fā)濃縮的石榴花色苷提取液稀釋至適宜的濃度梯度,各取1mL樣品液按照標(biāo)準(zhǔn)曲線制作方法測(cè)定樣品的鐵還原力,計(jì)算IC50值。
1.3.2.3 石榴花色苷對(duì)ABTS+自由基的清除效果[16]
(1) 標(biāo)準(zhǔn)曲線的制作
用蒸餾水將200μmol/L Trolox標(biāo)準(zhǔn)溶液分別稀釋成40~160μmol/L的系列標(biāo)準(zhǔn)溶液,各取1mL標(biāo)準(zhǔn)溶液與4.5mL ABTS+自由基工作液(10mL 7mmol/L的ABTS溶液與5mL 7.35mmol/L K2S2O8溶液混合后在室溫下避光放置16h形成ABTS+自由基儲(chǔ)備液,使用前用無(wú)水乙醇稀釋成工作液,在734nm波長(zhǎng)處的吸光度為0.70±0.02。充分混合均勻,室溫放置6min,于波長(zhǎng)734nm處測(cè)吸光度(A試驗(yàn))。對(duì)照組以4.5mL無(wú)水乙醇代替ABTS+自由基工作液(A對(duì)照),空白組以1mL蒸餾水代替樣品液(A空白),各組均進(jìn)行3次平行測(cè)定。按式(3)計(jì)算ABTS+自由基的清除率。

以Trolox濃度為橫坐標(biāo)、ABTS+自由基清除率為縱坐標(biāo),繪制標(biāo)準(zhǔn)曲線,得到回歸方程:y=0.4277x-2.5834,相關(guān)系數(shù)R2=0.9933。
(2) 樣品的測(cè)定
取石榴花色苷濃縮液稀釋成適當(dāng)梯度的樣品液,取1mL樣品液與4.5mL ABTS+工作液混合,按照標(biāo)準(zhǔn)曲線制作方法測(cè)定樣品清除ABTS+自由基的能力,計(jì)算IC50值。1.3.2.4石榴花色苷螯合亞鐵能力測(cè)定[17]
(1) EDTA標(biāo)準(zhǔn)曲線的制作
用蒸餾水將0.1g/L EDTA標(biāo)準(zhǔn)儲(chǔ)備液(準(zhǔn)確稱(chēng)取0.1g EDTA標(biāo)品溶于蒸餾水后,定容至1L,制成0.1g/L EDTA標(biāo)準(zhǔn)儲(chǔ)備液)分別稀釋成0.01~0.08g/L的系列標(biāo)準(zhǔn)溶液。各取1mL系列標(biāo)準(zhǔn)溶液,加入3.7mL甲醇,振蕩混勻后,加入0.1mL 2mmol/L FeCl2,30s后再加入0.2mL 5mmol/L啡咯嗪,避光反應(yīng)10min,4℃離心10min,取上清液,于562nm波長(zhǎng)處測(cè)吸光度(A試驗(yàn))。對(duì)照組以0.3mL蒸餾水代替0.1mL 2mmol/L FeCl2和0.2mL 5mmol/L啡咯嗪,空白組以1mL蒸餾水代替樣品液。各組均平行測(cè)定3次,用式(4)計(jì)算EDTA螯合亞鐵離子百分?jǐn)?shù)。
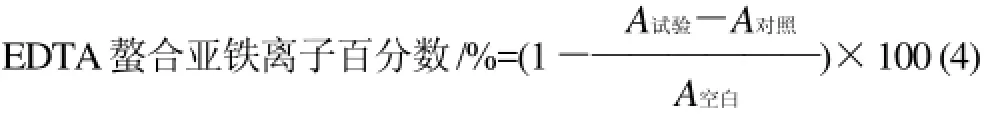
以EDTA標(biāo)準(zhǔn)溶液濃度為橫坐標(biāo)、螯合亞鐵離子百分?jǐn)?shù)為縱坐標(biāo),繪制標(biāo)準(zhǔn)曲線,得到回歸方程,y=898.17x+ 6.6368,相關(guān)系數(shù)R2=0.9945。
(2) 樣品的測(cè)定
取石榴花色苷濃縮提取液,稀釋成適宜的梯度樣品液,取1mL樣品液按照標(biāo)準(zhǔn)曲線的制作測(cè)定吸光度,根據(jù)標(biāo)準(zhǔn)曲線計(jì)算IC50值。
1.3.3 石榴花色苷的測(cè)定方法
參照文獻(xiàn)[18],采用pH差示法測(cè)定石榴花色苷含量,即利用在pH1的緩沖溶液中和pH4.5的緩沖溶液中510nm和700nm波長(zhǎng)處吸光度的差值,最后換算成以矢車(chē)菊-3-葡萄糖苷為主的總花色苷的含量。
1.3.4IC50值
IC50值表示當(dāng)自由基清除率為50%或吸光度為0.5時(shí)的樣品濃度。
1.4 數(shù)據(jù)分析
用DPS 7.55統(tǒng)計(jì)軟件和Excel 2003分析實(shí)驗(yàn)數(shù)據(jù)。
2 結(jié)果與分析
2.1 微波輔助提取石榴花色苷的優(yōu)化試驗(yàn)
在單因素試驗(yàn)基礎(chǔ)上,選用L16(45)正交試驗(yàn)設(shè)計(jì)表,對(duì)影響石榴汁花色苷提取的各參數(shù)進(jìn)行優(yōu)化,得到試驗(yàn)結(jié)果見(jiàn)表2,方差分析見(jiàn)表3。

表2 正交試驗(yàn)設(shè)計(jì)及結(jié)果Table 2 Orthogonal array design layout and experimental results

表3 方差分析表Table 3 Analysis of variances for anthocyanin yield with various extraction conditions
由表2可知,五個(gè)因素對(duì)花色苷提取得率的影響的主次順序?yàn)镋>C>A>D>B,即微波輸出功率>提取時(shí)間>溶劑pH值>乙醇體積分?jǐn)?shù)>料液比。試驗(yàn)所得到的最佳優(yōu)化工藝組合為A1B4C3D3E3,即溶劑pH1、料液比1:13(g/mL)、提取時(shí)間210s、乙醇體積分?jǐn)?shù)70%、微波輸出功率360W。
由表3方差分析結(jié)果可知,溶劑pH、料液比、提取時(shí)間、乙醇體積分?jǐn)?shù)、微波輸出功率五個(gè)因素中只有微波輸出功率對(duì)石榴汁花色苷的提取得率表現(xiàn)出顯著影響(P<0.05)。
由于得到的優(yōu)化組合不在此正交試驗(yàn)設(shè)計(jì)表內(nèi),故以該優(yōu)化組合的參數(shù)進(jìn)行了2次重復(fù)驗(yàn)證實(shí)驗(yàn),經(jīng)計(jì)算花色苷得率為184.81μg/g,證明該最佳工藝條件比較理想。
2.2 石榴花色苷的體外抗氧化活性
2.2.1 石榴花色苷清除DPPH自由基效果
二苯基苦基苯肼(DPPH自由基)是一種很穩(wěn)定的以氮為中心的自由基,若受試物能清除它則表明受試物具有清除羥自由基、烷自由基或過(guò)氧自由基的能力,從而中斷脂質(zhì)過(guò)氧化鏈反應(yīng)[19]。
不同含量花色苷樣品清除DPPH自由基得到的結(jié)果見(jiàn)圖2 。

圖2 石榴花色苷對(duì)DPPH自由基的清除效果Fig.2 Concentration dependent DPPH scavenging effect of anthocyanins from sweet pomegranate fruits
由圖2可知,石榴花色苷含量在0.74~3.70mg/L的范圍內(nèi),對(duì)DPPH自由基的清除率范圍為6%~68%,相當(dāng)于Trolox濃度為49.26~171.15μmol/L,花色苷含量與DPPH自由基清除率呈現(xiàn)顯著的正相關(guān)性(R2=0.9928),其IC50值為2.44mg/L,表明石榴汁花色苷對(duì)DPPH自由基有較強(qiáng)的清除效果。
2.2.2 石榴花色苷的鐵還原力
Benzie和Strain建立的FRAP法原理明確,操作簡(jiǎn)便,不需特殊儀器,易于標(biāo)準(zhǔn)化,已用于測(cè)定不同抗氧化物質(zhì)、食物與生物樣品的抗氧化活性,它反映樣品的總還原能力,可用來(lái)反映樣品總抗氧化活性[20]。石榴花色苷鐵還原力分析結(jié)果見(jiàn)圖3。

圖3 石榴花色苷的還原力Fig.3 Concentration dependent ferric reducing antioxidant power of anthocyanins from sweet pomegranate fruits
由圖3可知,石榴花色苷含量在0.15~1.48mg/L范圍內(nèi),還原力為0.15~1.17,花色苷含量與還原力呈現(xiàn)之間有顯著量效關(guān)系(R2=0.9925),相當(dāng)于Trolox的濃度為11.31~81.76μmol/L。石榴花色苷還原力的IC50值為1.14mg/L,表明石榴汁花色苷的還原能力較強(qiáng)。
2.2.3 石榴花色苷清除ABTS+自由基的效果
抗氧化劑清除ABTS+自由基可作為評(píng)價(jià)抗氧化劑的總抗氧化能力。石榴花色苷清除ABTS自由基的結(jié)果見(jiàn)圖4。
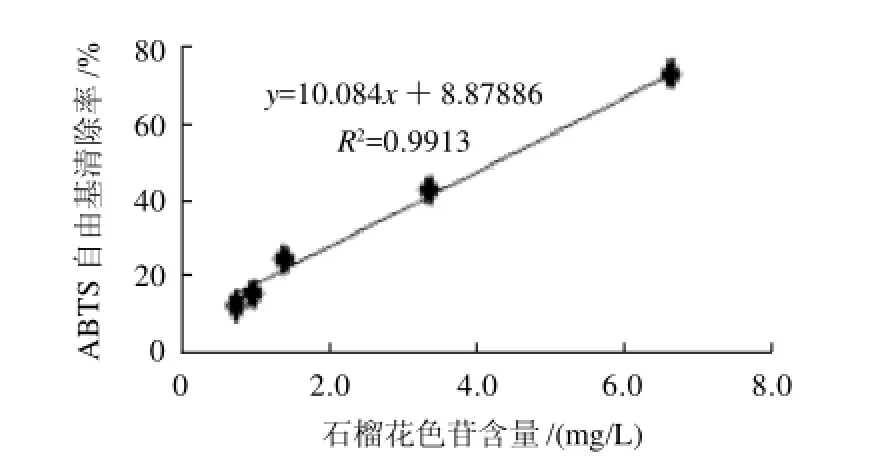
圖4 石榴花色苷對(duì)ABTS自由基的清除率Fig.4 Concentration dependent ABTS+radical scavenging effect of anthocyanins from sweet pomegranate fruits
從圖4可看出,當(dāng)石榴花色苷含量在0.66~6.55mg/L范圍內(nèi),對(duì)ABTS+自由基的清除率為13.5%~73.9%,兩者間有顯著的正相關(guān)性,其線性回歸方程為y=10.084x+8.8786,R2=0.9913,相當(dāng)于Trolox濃度為37.69178.85μmol/L。石榴花色苷清除ABTS+自由基的
IC50值為4.08mg/L。
2.2.4 石榴花色苷的亞鐵螯合力
亞鐵離子是脂質(zhì)過(guò)氧化反應(yīng)的催化劑,其不僅加速自由基的產(chǎn)生,產(chǎn)生活性氧,縮短脂肪氧化的誘導(dǎo)期,同時(shí)加速氫過(guò)氧化物的分解,加劇脂質(zhì)氧化反應(yīng)。石榴花色苷螯合亞鐵的結(jié)果見(jiàn)圖5。

圖5 石榴花色苷的亞鐵離子螯合能力Fig.5 Concentration dependent ferrous ion chelating capacity of anthocyanins from sweet pomegranate fruits
由圖5可知,石榴花色苷含量在26.22~131.09mg/L范圍時(shí),其螯合亞鐵離子的能力為16.7%~67.3%,兩者間有明顯的量效關(guān)系,相關(guān)系數(shù)R2為0.9945,相當(dāng)于EDTA的質(zhì)量濃度為0~66.31mg/L。石榴花色苷螯合亞鐵離子的IC50值為101.05mg/L,表明石榴花色苷具有一定的金屬螯合能力。
3 結(jié) 論
波輔助提取法具有節(jié)省溶劑、提取時(shí)間短、提取含量高、操作方便等優(yōu)點(diǎn)。石榴花色苷具有清除自由基的能力,且花色苷濃度與其抗氧化活性有一定的量效關(guān)系。
3.1 微波輔助提取石榴花色苷的最佳提取工藝參數(shù)為提取溶劑的pH1、料液比1:13(g/mL)、提取時(shí)間210s、乙醇體積分?jǐn)?shù)70%、微波輸出功率360W。在此條件下得到的花色苷提取率為184.81μg/g。試驗(yàn)因素對(duì)石榴花色苷提取得率的影響順序?yàn)槲⒉ㄝ敵龉β剩咎崛r(shí)間>溶劑pH>乙醇濃度>料液比,其中微波輸出功率對(duì)提取得率有顯著的影響(P<0.05),其他因素的影響均不顯著。
3.2 石榴汁花色苷清除DPPH自由基的IC50為2.44mg/L,當(dāng)石榴汁花色苷含量在0.74~3.70mg/L時(shí),相當(dāng)于Trolox濃度為49.26~171.15μmol/L。石榴汁花色苷鐵還原力的IC50為1.14mg/L,當(dāng)石榴汁花色苷含量在0.15~1.48mg/L時(shí),其鐵還原力相對(duì)應(yīng)的Trolox濃度為11.31~81.76 μmol/L。石榴汁花色苷清除ABTS+自由基的IC50為4.08mg/L,當(dāng)石榴汁花色苷含量在0.66~6.55mg/L時(shí),相當(dāng)于Trolox濃度為37.69~178.85μmol/L。石榴汁花色苷螯合亞鐵能力的IC50值為101.05mg/L,當(dāng)石榴汁花色苷含量在26.22~131.09mg/L時(shí),相當(dāng)于EDTA質(zhì)量濃度為0~66.31mg/L。
[1]郭松年, 董周永, 孫海燕, 等. 石榴汁花色苷熱穩(wěn)定性及其降解動(dòng)力學(xué)研究[J]. 農(nóng)業(yè)工程學(xué)報(bào), 2008, 24(3): 256-259.
[2]楊彬彬. 我國(guó)石榴濃縮汁的產(chǎn)業(yè)現(xiàn)狀及發(fā)展趨勢(shì)[J]. 陜西農(nóng)業(yè)科學(xué), 2009(1): 94-96.
[3]董周永, 胡青霞, 郭松年, 等. 石榴果皮中抑菌活性物質(zhì)提取工藝優(yōu)化[J]. 農(nóng)業(yè)工程學(xué)報(bào), 2008, 24(3): 274-277.
[4]YUAN Zhaohe, YIN Yanlei, QU Jianlu, et al. Population genetic diversity in Chinese pomegranate (Punica granatum L.) cultivars revealed by fluorescent-AFLP markers[J]. Journal of Genetics and Genomics, 2007, 34(12): 1061-1071.
[5]FILIZ T, MINE G, TUGBA D, et al. Antioxidant activity and total phenolic, organic acid and sugar content in commercial pomegranate juices[J]. Food Chemistry, 2009, 115: 873-877.
[6]NEGI P S, JAYAPRAKASHA G K, JENA B S. Antioxidant and Antimutagenic activities of pomegranate peel extracts[J]. Food Chemistry, 2003, 80(3): 393-397.
[7]JAISWAL V, DERMARDEROSIAN A, PORTER J R. Anthocyanins and polyphenol oxidase from dried arils of pomegranate (Punica granatum L.)[J]. Food Chemistry, 2010, 118(1): 11-16.
[8]ROSENBLAT M, HAYEK T, AVIRAM M. Anti-oxidative effects of pomegranate juice (PJ) consumption by diabetic patients on serum and on macrophages[J]. Atherosclerosis, 2006, 187(2): 363-371.
[9]MUSTAFA O, COSKUN D, SEDAT S, et al. Chemical and antioxidant properties of pomegranate cultivars grown in the Mediterranean region of Turkey[J]. Food Chemistry, 2008, 111(3): 703-706.
[10]MUSTAFA C, YASAR H, GOKHAN D. Classification of eight pomegranate juices based on antioxidant capacity measured by four methods [J]. Food Chemistry , 2009, 112: 721-726.
[11]MOUSAVINEJAD G, EMAM-DJOMEH Z, REZAEI K, et al. Identification and quantification of phenolic compounds and their effects on antioxidant activity in pomegranate juices of eight Iranian cultivars[J]. Food Chemistry, 2009, 115(15): 1274-1278.
[12]HARTMAN R E, SHAH A, FAGAN A M, et al. Pomegranate juice decreases amyloid load and improves behavior in a mouse model of Alzheimes disease[J]. Neurobiology of Disease, 2006, 24: 506-515.
[13]FUHRMAN B, VOLKOVA N, AVIRAM M. Pomegranate juice inhibits oxidized LDL uptake and cholesterol biosynthesis in macrophages[J]. Journal of Nutritional Biochemistry, 2005, 16(9): 570-576.
[14]GARZON G A, WROLSTAD R E. Major anthocyanins and antioxidant activity of Nasturtium flowers (Tropaeolum majus)[J]. Food Chemistry, 2009, 114(1): 44-49.
[15]WONG Chichun, LI Huabin, CHENG Kawing, et al. A systematic survey of antioxidant activity of 30 Chinese Medicinal plants using the ferric reducing antioxidant power assay[J]. Food Chemistry, 2006, 97 (4): 705-711.
[16]ARTS M, DALLING S, VOSS H P, et al. A new approach to assess the total antioxidant capacity using the TEAC assay[J]. Food Chemistry, 2004, 88: 567-570.
[17]AK T, GLIN I. Antioxidant and radical scavenging properties of curcumin [J]. Chemico-Biological Interactions, 2008,, 174(1): 27-37.
[18]SHWARTZA E, GLAZERA I, BAR-YA AKOV I, et al. Changes in chemical constituents during the maturation and ripening of two commercially important pomegranate accessions[J]. Food Chemistry, 2009, 115(3): 965-973.
[19]薛紅瑋, 陳向民. 花色苷類(lèi)色素抗氧化活性研究進(jìn)展[J]. 食品研究與開(kāi)發(fā), 2009, 30(7): 190-192.
[20]郭長(zhǎng)江, 楊繼軍. FRAP法測(cè)定水果不同部分抗氧化活性[J]. 中國(guó)公共衛(wèi)生, 2003, 19(7): 841-843.
Microwave-assisted Extraction and Antioxidant Activity Evaluation of Anthocyanins from Pomegranate (Punica granatum L.) Fruits
LI Ju-xiu,WANG Shi-yu,F(xiàn)ANG Hong-juan,ZHANG Xiao-ning
(College of Food Science and Engineering, Northwest A & F University, Yangling 712100, China)
Pomegranate (Punica granatum L.) fruit is rich in anthocyanins, which has attracted great attention for its health benefits. The aim of this study was to optimize five parameters for the microwave-assisted extraction of anthocyanins from sweet pomegranate fruits from Lintong region, Shaanxi province and to evaluate the in vitro antioxidant activity of the extracted anthocyanins by DPPH radical scavenging, ferric reducing antioxidant power (FRAP), 2,2'-azinobis(3-ethylbenzothiazoline-6-sulfonic acid) radical cation (ABTS+) and ferrous ion chelating assays. The optimal extraction parameters of anthocyanins were as follows: pH value 1; solid/liquid ratio 1:13; length of extraction time 210 s; microwave power 360 W; and ethanol concentration 70%. An anthocyanin yield of 184.81μg/g was achieved under these conditions. Microwave power had a significant effect on anthocyanin yield (P < 0.05). The extracted anthocyanins had the ability to scavenge DPPH and ABTS+radicals, ferric reducing antioxidant power and ferrous ion chelating capacity in a linear concentration-dependent manner, with corresponding correlation coefficients (R2) of 0.9928, 0.9925, 0.9913 and 0.9945, and the IC50values were 2.44, 1.14, 4.08 mg/L and 101.05 mg/L, respectively.
microwave assistance;pomegranate;anthocyanin;antioxidant activity
TS201.2
A
1002-6630(2010)18-0165-05
2010-06-23
李巨秀(1972—),女,副教授,博士,研究方向?yàn)槭称坊瘜W(xué)。E-mail:juxiuli@msn.com

